血浆SEPT9基因甲基化对结直肠癌诊断价值的研究进展
血浆SEPT9基因甲基化对结直肠癌诊断价值的研究进展
庄璐1,2李兆申1,2*
第二军医大学附属长海医院消化内科1(200433)第二军医大学临床流行病学与循证医学中心2
Early Diagnosis
2014年最新统计数据表明,结直肠癌(colorectal cancer, CRC)的发病率在全球范围内位居恶性肿瘤的第三位,每年约有60万人死于CRC;在美国,CRC也是肿瘤导致死亡的第三大病因,预计2014年将有136 830例新发病例,估计其中超过50 000例会因CRC死亡[1]。CRC同样是中国的三大癌症之一,其发病率和死亡率逐年上升。目前已证实,早期筛查和诊断CRC可有效提高患者生存率并改善预后。Ⅰ/Ⅱ期CRC患者若加以合理治疗、干预,5年生存率可达到90%以上。不幸的是,约80%的CRC患者在就诊时即为中晚期,早期诊断率仅为11.8%。因此,CRC的早期筛查、早期诊断对于疾病的转归至关重要。
CRC筛查指南推荐50岁以上平均风险人群接受以粪便隐血试验[FOBT,包括愈创木脂FOBT(gFOBT)、粪便免疫化学检测(FIT)]和结肠镜检查(金标准)为主的筛查方法进行定期普查[2]。然而,数据显示,在美国至少有1/3的受检者因粪便样本采集不便、对有创性结肠镜检查的恐惧等原因而规避常规CRC筛查,致使每年约有44 000例患者因漏诊CRC而死亡[3]。国内也存在同样的问题,2012年上海市疾控中心监测数据显示,仅有不到5%的受检者做过FOBT,结肠镜检查的参与率则更低,仅为3%[4]。此外,在结直肠非创伤性检查中,目前使用最广泛、并已有大规模随机对照试验支持的gFOBT检出CRC的敏感性仅为35%~64%,FIT检测的敏感性和特异性相对较高,分别为65%~81%和87%~97%[5]。但这两种FOBT检测方法检出无出血性CRC效果较差。不仅如此,由于取样不便和可能需要重复检测,gFOBT和FIT的患者依从性均较差。因此,寻找以血液为基础的CRC特异性分子标记物对提高受检者筛查依从性具有重要意义。现行的CRC血液学检查主要包括血清CEA、CA19-9、CA242、CA724、CA125、血浆SEPT9基因甲基化、全血mRNA结直肠警哨检测(ColonSentry)等。CEA等糖蛋白类肿瘤标记物诊断CRC的敏感性和特异性均较低(18.8%~52.2%),对CRC早期筛查和诊断的参考意义有限,而mRNA标记物含量变化大,影响因素多,且提取过程中易降解,很难成为大规模使用的商业化检测方法。新型血浆SEPT9甲基化检测方法应运而生,成为目前国外较为流行的外周血CRC早期检测方法。Taber等[6]对100名不同种族接受CRC筛查者的调查结果显示,与结肠镜检查、乙状结肠镜检查和FIT相比,91%的受检者倾向于接受血浆SEPT9甲基化检测,因为该项检测无需肠道准备、禁食,也不受所服用药物的影响,血液标本采集方便,故受检者依从性较好。SEPT9甲基化检测对CRC早期筛查和诊断的优势较为明显,本文综述SEPT9甲基化检测筛查和早期诊断CRC的现状和研究进展。
CRC的发生、发展通常伴随许多表观遗传学改变,其中包括某些基因启动子区域DNA的长期高甲基化[7]。研究[8]发现,外周血细胞游离DNA(circulating cell-free DNA, ccfDNA)中有很多甲基化分子标记物,其中与CRC相关并得到最深入研究的是SEPT9基因甲基化。SEPT9基因位于染色体17q25.3,起抑癌作用,其V2转录本启动子gamma1区域的甲基化已被证实与CRC的发生密切相关,甲基化导致基因转录受到抑制,从而影响基因的正常表达,并使其抑癌功能丧失,影响囊泡运输、丝状结构形成、细胞分裂和凋亡等功能。这是由于SEPT9基因相应表达SEPT9蛋白,SEPT9蛋白在细胞分裂过程中提供结构支持,特别是在细胞分裂末段起重要作用。SEPT9蛋白是septin八聚体中处于两末段的蛋白,如果表达异常,将严重影响胞质分裂。大量临床研究证实,不同于正常结直肠组织,CRC组织中可检出明显异常的SEPT9基因甲基化,SEPT9基因甲基化是CRC早期发生、发展过程中的特异性分子标记物,因甲基化后的SEPT9基因可被癌组织释放入外周血,故可通过早期检测血浆中的SEPT9 V2转录本启动子gammal区域的甲基化程度实现CRC的筛查[9]。Grutzmann等[10]的研究显示,乳腺癌、卵巢癌、血液系统恶性肿瘤等肿瘤中的SEPT9基因异常甲基化检出率远低于CRC,CRC患者、其他癌症患者、正常人血浆SEPT9甲基化检出率分别为72.0%(90/125)、11.5%(11/96)和10.4%(19/183),可能与现行血浆SEPT9甲基化试剂盒检测的主要靶片段为SEPT9_v2区域,而某些乳腺肿瘤的恶性表型与SEPT9_v1区域的高表达有关,SEPT9_v1和v4区域的mRNA水平改变在一定程度上反映了交界性卵巢肿瘤的发生、发展过程[11]。此外,国内有部分小样本研究[12-13]观察到胃癌组织中也有SEPT9基因甲基化异常改变,但研究结果暂无相关基础研究的理论依据支持,利用SEPT9甲基化筛查胃癌的有效性还需进一步研究证实。
第一代血浆SEPT9甲基化检测试剂盒(Epi proColon)已于3年前开始在部分西方国家应用,目前有涉及5 000多人次的多个独立临床研究评价了血浆SEPT9 DNA甲基化检测对CRC的诊断价值。其中,比较CRC患者与健康对照者的回顾性研究结果参差不齐,早期研究结果显示,血浆SEPT9 DNA甲基化检测对CRC的敏感性只有50.9%~72.2%,特异性波动于85.8%~98.7%[10,14-18]。最近,Church等[19]的大型前瞻性研究显示,第一代SEPT9 DNA甲基化检测试剂盒检出Ⅰ~Ⅳ期CRC的敏感性分别为35%、63%、46%和77.4%,特异性为91.4%(表1)。
第二代血浆SEPT9甲基化检测试剂盒(Epi proColon 2.0)在DNA提取和PCR重复实验技术方面较第一代有所提高,检测敏感性稳定提升。Toth等[20]的临床研究发现,第二代血浆SEPT9甲基化检测试剂盒检出CRC的敏感性波动于79.3%(2/3算法)~95.6%(1/3算法),特异性为84.8%(1/3算法)~99%(2/3算法),算法的选择基于诊断或筛查的特定要求,1/3算法保证了检测方法的高敏感性,但会相应出现一定程度的低特异性(假阳性率高),而2/3算法在确保较高特异性(真阴性率高)的同时敏感性相对较低[21]。该研究同期比较了CEA等检测方法,结果提示SEPT9甲基化检测对CRC具有高敏感性和高特异性,对于结肠镜诊断有难度的右半结肠CRC,检出率优于gFOBT和CEA(表2)。Church等[19]的研究显示,第二代血浆SEPT9甲基化检测试剂盒检出CRC的敏感性为63.9%。而Potter等[22]的最新前瞻性研究结果表明,血浆SEPT9甲基化检测对CRC的敏感性为68%。最近Jin等[23]首次对476名中国受检者以第二代血浆SEPT9甲基化试剂盒进行检测,检出CRC的敏感性和特异性分别为74.8%和87.4%(表3),而同期FIT检出CRC的敏感性和特异性相对较低,分别为58%和82.4%,与既往研究结果相符[19-20,24]。不同于gFOBT的是,SEPT9甲基化检测对不同年龄、性别、位于左半结肠/右半结肠的CRC诊断价值差异无统计学意义。Johnson等[27]的研究指出,SEPT9甲基化检测检出CRC的敏感性略高于FIT(73.3%对68.0%),但差异并无统计学意义。目前,国内已有BioChain公司授权代理第二代SEPT9基因甲基化CRC检测试剂盒(Epi proColon 2.0),并实现了国产化,降低了成本,4批产品已通过CFDA注册检验,初步临床试验结果显示检出CRC的总体特异性高达87.4%,敏感性为74.8%[23],而同期使用FIT检出CRC的总体特异性和敏感性分别为82.4%和58.0%,展现了血浆SEPT9甲基化检测筛查CRC有着很好的应用前景。
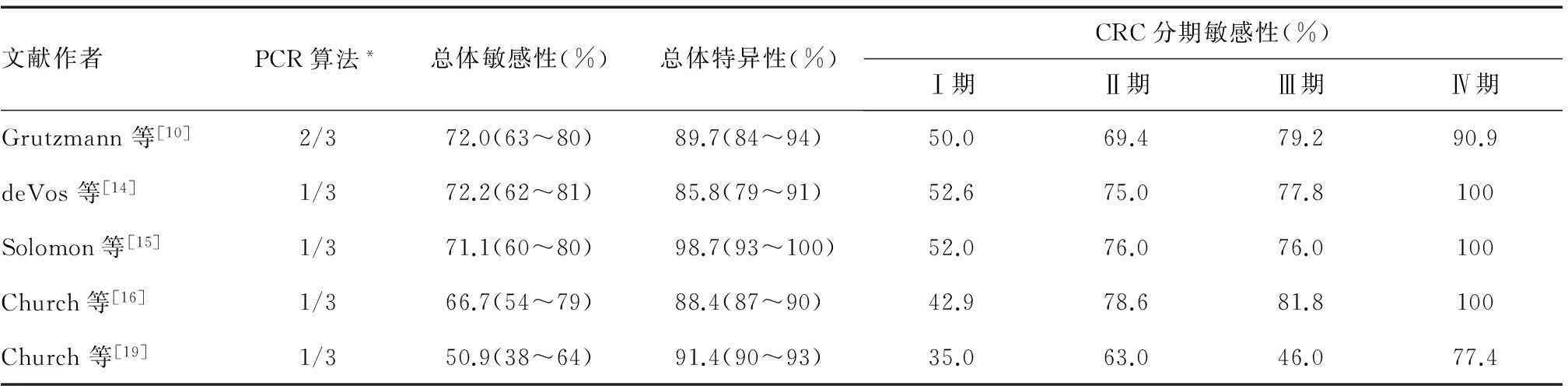
表1 第一代血浆SEPT9基因甲基化检测试剂盒检出CRC结果
PCR算法:2/3算法为3次PCR重复实验中出现≥2次阳性,判断样品为阳性;1/3算法为3次PCR重复实验中出现1次阳性,判断样品为阳性

表2 不同CRC检测方法比较
IVD:体外诊断产品;LDT:实验室成熟的检测方法;CE:欧洲统一安全认证;FDA:美国食品药品监督管理局认证;CFDA:中国食品药物监督管理局认证
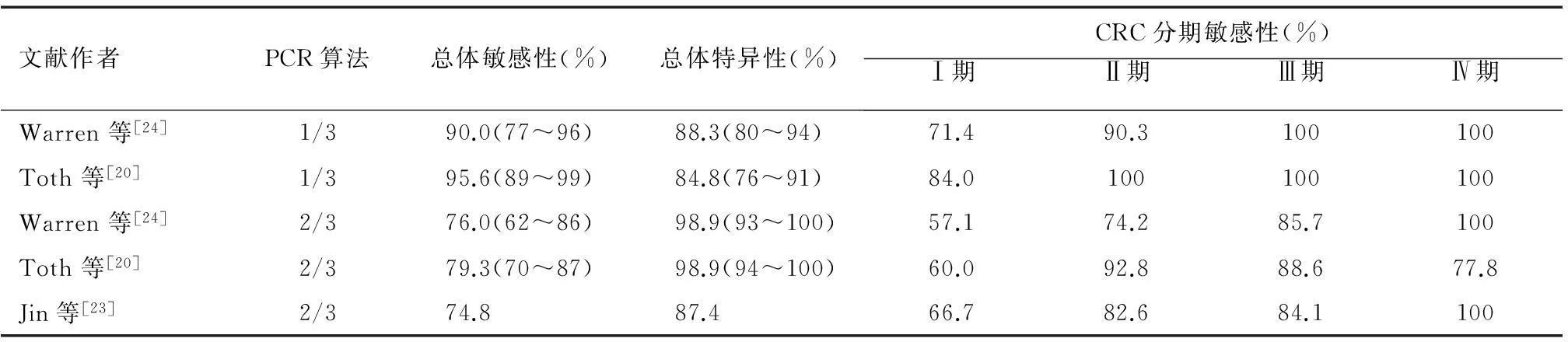
表3 第二代血浆SEPT9基因甲基化检测试剂盒检出CRC结果
目前诸多文献支持腺瘤样息肉-癌的CRC演变途径,故是否能有效检出结直肠进展期腺瘤是CRC早期筛查的关键。两项早期病例对照研究[10,18]显示,SEPT9甲基化检测检出结直肠进展期腺瘤的敏感性仅为16.7%(3/18)和17.6%(3/17)。Church等[19]的研究采用第一代SEPT9甲基化检测试剂盒,检出结直肠进展期腺瘤的敏感性也较低(11.2%),而Jin等[23]采用第二代SEPT9甲基化检测试剂盒,检出腺瘤的敏感性提高至27.4%,与同期进行的FIT检出结果类似。尽管SEPT9基因甲基化在结直肠进展期腺瘤组织中也广泛存在[17],以该法检测结直肠腺瘤的检出率仍较低,可能与腺瘤组织内的甲基化SEPT9基因释放入血的时间和量与CRC组织不一致,以及晚期CRC才导致血管侵袭等因素有关。此外,该研究还进一步指出,血浆SEPT9甲基化检测的阳性率在CRC发展过程(即低度异型增生、高度异型增生、CRCⅠ~Ⅳ期)中呈逐渐升高趋势。
综上所述,已有诸多基础实验和临床试验数据支持血浆SEPT9基因甲基化检测在CRC筛查和诊断中的作用。该法属新型无创伤性检测,并具有采样安全方便、相对其他非创伤性检查敏感性和特异性高、左右半结肠无差异、受检者依从性好等特点,有望作为CRC有效的早期筛查工具,填补我国早期诊断CRC的特异性血液分子标记物的空白。血浆SEPT9基因甲基化检测与结肠镜检查相辅相成,可提高受检人群的CRC检出率,进而降低CRC相关发病率和死亡率,但其在检出CRC的总体敏感性、检出CRC癌前病变(进展期腺瘤等)的敏感性方面表现稍差,确切诊断价值尚有待更多大型随机对照试验验证。
参考文献
1 Siegel R, Desantis C, Jemal A. Colorectal cancer statistics, 2014[J]. CA Cancer J Clin, 2014, 64 (2): 104-117.
2 Smith RA, Manassaram-Baptiste D, Brooks D, et al. Cancer screening in the United States, 2014: a review of current American Cancer Society guidelines and current issues in cancer screening[J]. CA Cancer J Clin, 2014, 64 (1): 30-51.
3 Willyard C. To foster screening, new colon cancer tests emphasize convenience[J]. Nat Med, 2014, 20 (4): 322-323.
4 上海市卫生局. 上海:结直肠癌发病率年均增速超4%[N]. 健康报, 2012-04-13.
5 Allison JE, Sakoda LC, Levin TR, et al. Screening for colorectal neoplasms with new fecal occult blood tests: update on performance characteristics[J]. J Natl Cancer Inst, 2007, 99 (19): 1462-1470.
6 Taber JM, Aspinwall LG, Heichman KA, et al. Preferences for blood-based colon cancer screening differ by race/ethnicity[J]. Am J Health Behav, 2014, 38 (3): 351-361.
7 Timp W, Feinberg AP. Cancer as a dysregulated epigenome allowing cellular growth advantage at the expense of the host[J]. Nat Rev Cancer, 2013, 13 (7): 497-510.
8 Oh T, Kim N, Moon Y, et al. Genome-wide identification and validation of a novel methylation biomarker, SDC2, for blood-based detection of colorectal cancer[J]. J Mol Diagn, 2013, 15 (4): 498-507.
9 Ahmed D, Danielsen SA, Aagesen TH, et al. A tissue-based comparative effectiveness analysis of biomarkers for early detection of colorectal tumors[J]. Clin Transl Gastroenterol, 2012, 3: e27.
10Grutzmann R, Molnar B, Pilarsky C, et al. Sensitive detection of colorectal cancer in peripheral blood by septin 9 DNA methylation assay[J]. PLoS One, 2008, 3 (11): e3759.
11刘文, 狄建忠, 邹扬, 等. SEPT 9基因与恶性肿瘤关系的研究进展[J]. 肿瘤, 2010, 30 (9): 798 -801.
12李楠, 王贺玲, 梁晓平, 等. SEPTIN9在胃癌组织中的表达及临床意义[J]. 中国微创外科杂志, 2014, 14 (12): 1125-1127.
13张意琴, 胡笑蓉, 毛雄英, 等. 胃癌组织septin 9基因甲基化及其临床意义研究[J]. 中国卫生检验杂志, 2014, 24 (14): 1987-1990.
14deVos T, Tetzner R, Model F, et al. Circulating methylated SEPT9 DNA in plasma is a biomarker for colorectal cancer[J]. Clin Chem, 2009, 55 (7): 1337-1346.
15Solomon N, Szostak M, Mak W, et al. The principal and performance characteristics of the Abbott RealTime mS9 colorectal cancer assay [C]. ASCO 2010 Molecular Markers Meeting (abstract #112), 2010. http://meetinglibrary.asco.org/content/60888-101.
16Church TR, Wandell M, Lofton-Day C, et al. Prospective clinical validation of an assay for methylated SEPT9 DNA in human plasma as a colorectal cancer screening tool in average risk men and women 50 years and older[C]. Digestive Disease Week, New Orleans, LA, 2010.
17Lofton-Day C, Model F, Devos T, et al. DNA methylation biomarkers for blood-based colorectal cancer screening[J]. Clin Chem, 2008, 54 (2): 414-423.
18Tanzer M, Balluff B, Distler J, et al. Performance of epigenetic markers SEPT9 and ALX4 in plasma for detection of colorectal precancerous lesions[J]. PLoS One, 2010, 5 (2): e9061.
19Church TR, Wandell M, Lofton-Day C, et al. Prospective evaluation of methylated SEPT9 in plasma for detection of asymptomatic colorectal cancer[J]. Gut, 2014, 63 (2): 317-325.
20Toth K, Sipos F, Kalmar A, et al. Detection of methylated SEPT9 in plasma is a reliable screening method for both left- and right-sided colon cancers[J]. PLoS One, 2012, 7 (9): e46000.
21宋乐乐, 李月敏, 宫媛, 等. 利用SEPT9基因甲基化检测筛查结直肠癌的研究进展[J]. 中国肿瘤生物治疗杂志, 2014, 21 (5): 589-594.
22Potter NT, Hurban P, White MN, et al. Validation of a real-time PCR-based qualitative assay for the detection of methylated SEPT9 DNA in human plasma[J]. Clin Chem, 2014, 60 (9): 1183-1191.
23Jin P, Kang Q, Wang X, et al. Performance of a second generation methylated SEPT9 test in detecting colorectal neoplasm[J]. J Gastroenterol Hepatol, 2015, 305 (5): 830-833.
24Warren JD, Xiong W, Bunker AM, et al. Septin 9 methylated DNA is a sensitive and specific blood test for colorectal cancer[J]. BMC Med, 2011, 9: 133.
25Imperiale TF, Ransohoff DF, Itzkowitz SH, et al. Fecal DNA versus fecal occult blood for colorectal-cancer screening in an average-risk population[J]. N Engl J Med, 2004, 351 (26): 2704-2714.
26Lee JK, Liles EG, Bent S, et al. Accuracy of fecal immunochemical tests for colorectal cancer: systematic review and meta-analysis[J]. Ann Intern Med, 2014, 160 (3): 171.
27Johnson DA, Barclay RL, Mergener K, et al. Plasma Septin9 versus fecal immunochemical testing for colorectal cancer screening: a prospective multicenter study[J]. PLoS One, 2014, 9 (6): e98238.
(2014-12-31收稿;2015-05-04修回)
*本文通信作者,Email: zhaoshenli@hotmail.com
背景:早期筛查和诊断可有效降低结直肠癌(CRC)相关死亡率,并可提高患者总体生存率。目前的CRC早期筛查方法主要包括粪便隐血试验和结肠镜检查。粪便隐血试验敏感性低,假阳性较多,而金标准结肠镜检查为有创性检查,患者依从性较低。因此,目前临床亟需寻找有效且简便的CRC早期筛查和诊断方法。血浆SEPT9基因甲基化检测是近年来国外已开始应用的新型非创伤性CRC早期筛查和诊断方法之一,此法较为准确、简便,适合大规模筛查和早期诊断。本文就血浆SEPT9基因甲基化检测对CRC的诊断价值以及相关研究进展进行概述。
关键词结直肠肿瘤;癌基因;DNA甲基化;肿瘤标记,生物学;早期诊断
Progress in Study on Diagnostic Value of Plasma SEPT9 Gene Methylation for Colorectal CancerZHUANGLu1,2,LIZhaoshen1,2.1DepartmentofGastroenterology,ChanghaiHospital,theSecondMilitaryMedicalUniversity,Shanghai(200433);2CenterforClinicalEpidemiologyandEvidence-BasedMedicine,theSecondMilitaryMedicalUniversity,Shanghai
Correspondence to: LI Zhaoshen, Email: zhaoshenli@hotmail.com
AbstractScreening and diagnosis of early colorectal cancer (CRC) can reduce CRC mortality and improve overall survival. Currently, the major screening methods for early CRC include fecal occult blood test (FOBT) and colonoscopy. FOBT exhibits low sensitivity with high false positive rate, while the gold standard -- colonoscopy is invasive and with low compliance. Therefore, a convenient and effective screening and diagnostic method for early CRC is urgently needed. Plasma SEPT9 gene methylation assay is a new non-invasive screening and diagnostic method for early CRC used clinically in recent years, it exhibits high accuracy, and is convenient for mass screening and diagnosis of early CRC. This article reviewed the research progress and diagnostic value of plasma SEPT9 gene methylation assay for CRC.
Key wordsColorectal Neoplasms;Oncogenes;DNA Methylation;Tumor Markers, Biological;
DOI:10.3969/j.issn.1008-7125.2015.09.011

