祛风宣痹方对哮喘大鼠气道炎症及MEK/ERK信号通路的影响
王博寒,杨颖,史锁芳,刘丽,汤玲玲,孙宪泓
南京中医药大学附属医院,江苏 南京 210029
支气管哮喘是由多种细胞、细胞组分参与的慢性气道炎症性疾病,临床主要表现为发作性气喘、胸闷、呼吸不畅、咳嗽,常在夜间或凌晨加重。虽然其发病机制尚不十分明确,但普遍认为与气道炎症[1]、气道高反应性[2]及气道重塑[3]等因素相关。持续存在的气道慢性炎症是哮喘反复发作、迁延难愈的重要原因,有效控制气道炎症是其治疗的重点。祛风宣痹方由史锁芳教授以祛风宣痹、化痰通阳、肃肺平喘为法创制而成,为南京中医药大学附属医院院内制剂,能有效缓解哮喘发作且远期疗效显著[4]。前期研究表明,祛风宣痹方能抑制哮喘模型肺组织核因子-κB、p38丝裂原活化蛋白激酶表达,调节Th1/Th2平衡,减少嗜酸性粒细胞浸润[5-7]。本研究以卵清蛋白(OVA)诱导大鼠哮喘模型和脂多糖(LPS)诱导小鼠巨噬细胞RAW264.7炎症模型为研究对象,观察祛风宣痹方对气道炎症相关因子及MEK/ERK信号通路的影响,探究其改善气道炎症的可能机制。
1 实验材料
1.1 动物与细胞
清洁级雄性SD大鼠18只,体质量180~220 g,购于上海斯莱克实验动物有限公司,动物许可证号SYXK(苏)2017-0069,饲养于南京中医药大学附属医院动物实验室。小鼠巨噬细胞RAW264.7,购于中国科学院细胞资源中心。
1.2 药物及制备
祛风宣痹方(射干10 g,炙麻黄6 g,制僵蚕10 g,瓜蒌10 g,薤白10 g,海风藤20 g,白芍15 g,炙甘草5 g,葶苈子10 g,蛤壳20 g,桃仁10 g,苦杏仁10 g,地龙10 g,黄芩10 g,蛇床子10 g),饮片购于南京中医药大学附属医院。所有饮片混合,第1次加1 000 mL水煎煮45 min,第2次加500 mL水煎煮45 min,收集2次煎煮液,过滤,加热浓缩至原药材浓度为1.66 g/mL煎剂,4 ℃保存备用。另由上海中医药大学中药现代制剂技术教育部工程研究中心制作祛风宣痹方冻干粉,每克冻干粉相当于原药材5.32 g,使用时以DMEM培养基稀释至相应浓度用于细胞实验。
1.3 主要试剂与仪器
MEK通路抑制剂U0126,上海Selleck公司,批号S110206;OVA,美国Sigma公司,批号SLCD9424;LPS,美国Sigma公司,批号SLCD9424;胎牛血清,以色列Biological Industries公司,批号2128196;细胞外调节蛋白激酶(ERK)1/2抗体,美国CST公司,批号4695;p-ERK1/2抗体,美国CST公司,批号4370;羊抗兔IgG,美国CST公司,批号7074;MEK1/2抗体,美国Affinity公司,批号AF6385;p-MEK1/2抗体,美国Affinity公司,批号AF8035;β-actin抗体,美国Affinity公司,批号T0022;BCA蛋白定量试剂盒,上海碧云天生物,批号P0012;一抗稀释液,上海碧云天生物,批号P0023A;ECL发光液,安徽Biosharp公司,批号70100030。
Mini Trans-Blot Cell转印槽、Mini PROTEAN 3Cell型垂直电泳槽、CHEMIDOC XRS+型伯乐凝胶成像仪,美国Bio-Rad公司;Fresco21型台式高速冷冻离心机,德国Eppendorf公司;ELX-800型酶标仪,美国BioTek公司;SIM-F140AY65-PC制冰机,日本Panasonic公司;85-2型恒温磁力搅拌器,常州国华电器有限公司。
2 实验方法
2.1 分组、造模及干预
18只大鼠随机分为对照组、哮喘组和祛风宣痹方组,每组6只。哮喘组和祛风宣痹方组造模第1日用10% OVA和氢氧化铝混合物1 mL腹腔注射致敏,造模第7日再致敏1次;造模第15日,使用超声雾化器以400 mm Hg(1mm Hg=0.133 kPa)恒压喷入1% OVA溶液激发哮喘,每次30 min,隔日1次,共7次。对照组用生理盐水代替OVA。大鼠在雾化前呼吸平稳,雾化过程中出现挠鼻、咳嗽、烦躁、呼吸加快等表现,激发后2 min内咳嗽次数增多表明造模成功。祛风宣痹方组第15日开始于雾化前1 h予祛风宣痹方煎剂20.7 g/(kg·d)灌胃,对照组和哮喘组予等量生理盐水灌胃,每日2次,连续14 d。
2.2 标本采集
干预结束后,称量大鼠体质量,麻醉,将大鼠固定,腹主动脉取血,4 ℃、3 000 r/min离心10 min,取血清,-20 ℃保存备用。分离气管,剪开胸腔,结扎左侧支气管,用生理盐水灌洗右肺肺泡,每次注入生理盐水约0.6 mL,缓慢注入后缓慢回抽,重复灌洗3次,收集肺泡灌洗液,4 ℃、1 500 r/min离心10 min,上清液于-20 ℃保存备用。留取部分左肺组织进行HE染色,剩余肺组织液氮中快速冷冻,用于Western blot检测。
2.3 细胞培养及干预
RAW264.7细胞用含10%胎牛血清及1%青-链霉素的DMEM完全培养基,置于37 ℃、5%CO2培养箱中培养,待细胞融合达70%~80%时进行实验。
将RAW264.7细胞以1×104个/孔接种于96孔板,将细胞分为对照组和不同浓度(5、10、20、40、80、160、320 μg/mL)祛风宣痹方组,每组6个复孔,分别处理24 h,加入5 mg/mL MTT溶液15 μL,培养箱孵育4 h,弃去培养液,每孔加入DMSO 150 μL,避光低速振荡10 min,酶标仪波长490 nm检测光密度(OD值),计算细胞活力[(实验组OD值-对照组OD值)÷对照组OD值×100%],筛选祛风宣痹方最佳作用浓度。
将RAW264.7细胞以3×105个/孔接种于6孔板,将细胞分为对照组、LPS组(1 μg/mL LPS)、祛风宣痹方组(1 μg/mL LPS+40 μg/mL祛风宣痹方)和U0126组(1 μg/mL LPS+10 μmol/L U0126),每组3个复孔,分别处理24 h,收集细胞和培养液进行后续检测。
2.4 指标检测
2.4.1 肺组织HE染色
肺组织经甲醛固定、石蜡包埋后切片,常规二甲苯脱蜡,梯度酒精脱水,苏木素染色5 min,清水冲洗,1%盐酸酒精脱色2~3 s,清水返蓝5 min,伊红染色3 min,清水冲洗,依次放入70%、80%、90%酒精中2~3 s,无水酒精浸泡5 min,依次放入二甲苯Ⅰ、Ⅱ、Ⅲ中浸泡5 min,自然风干,中性树胶封片,光学显微镜下观察肺组织病理改变。
2.4.2 ELISA检测
取外周血和肺泡灌洗液,参照试剂盒说明书步骤,酶标仪波长450 nm测量OD值,根据回归方程计算血清IgE、白细胞介素(IL)-6及肺泡灌洗液IL-6含量。收集细胞培养液,参照试剂盒说明书检测IL-6含量。
2.4.3 Western blot检测
加入裂解液提取肺组织、RAW264.7细胞总蛋白,采用BCA法测定蛋白浓度,加入6×上样缓冲液,99 ℃加热10 min使蛋白变性;制备10%分离胶和5%浓缩胶,取20 μg蛋白进行电泳(80 V、30 min,120 V、90 min),250 mA转膜90 min,用5%脱脂奶粉封闭1 h,加入MEK1/2一抗(1∶1 000)、p-MEK1/2一抗(1∶1 000)、ERK1/2一抗(1∶1 000)、p-ERK1/2一抗(1∶1 000)、β-actin一抗(1∶3 000),4 ℃孵育过夜,TBST洗涤4次,加入羊抗兔IgG二抗,室温孵育1 h,TBST洗涤4次,加ECL发光液显影。采用Image Lab软件对条带进行灰度分析。
3 统计学方法
4 结果
4.1 祛风宣痹方对模型大鼠肺组织病理形态的影响
对照组大鼠气道黏膜上皮及肺泡结构相对完整,未见明显炎症反应。与对照组比较,哮喘组大鼠气道壁增厚,支气管周围炎性细胞增多;与哮喘组比较,祛风宣痹方组大鼠气道黏膜水肿和炎症细胞浸润有所减轻。见图1。
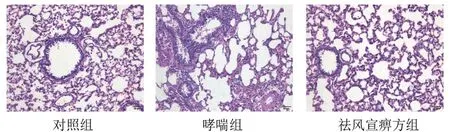
图1 各组大鼠肺组织形态(HE染色,×40)
4.2 祛风宣痹方对模型大鼠血清和肺泡灌洗液IgE、白细胞介素-6含量的影响
与对照组比较,哮喘组大鼠血清IgE、IL-6和肺泡灌洗液IL-6含量显著增加(P<0.01);与哮喘组比较,祛风宣痹方组大鼠血清IgE、IL-6和肺泡灌洗液IL-6含量显著减少(P<0.01)。见表1。
表1 各组大鼠血清和肺泡灌洗液IgE、IL-6含量比较(±s)
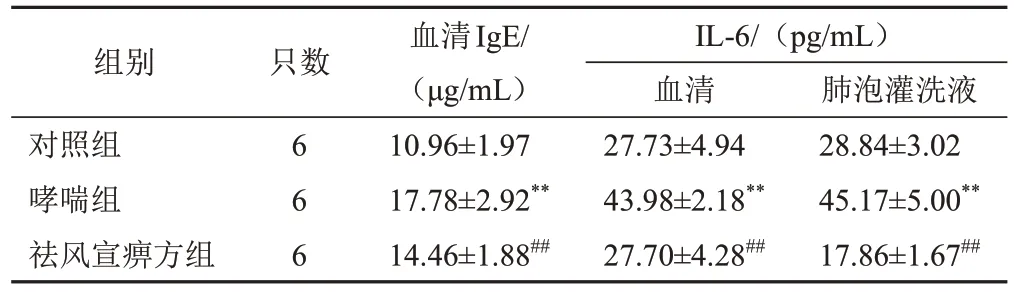
表1 各组大鼠血清和肺泡灌洗液IgE、IL-6含量比较(±s)
注:与对照组比较,**P<0.01;与哮喘组比较,##P<0.01
组别对照组哮喘组祛风宣痹方组只数6 6 6血清IgE/(μg/mL)10.96±1.97 17.78±2.92**14.46±1.88##IL-6/(pg/mL)血清27.73±4.94 43.98±2.18**27.70±4.28##肺泡灌洗液28.84±3.02 45.17±5.00**17.86±1.67##
4.3 祛风宣痹方对模型大鼠肺组织MEK/ERK通路相关蛋白表达的影响
与对照组比较,哮喘组大鼠肺组织p-MEK1/2、p-ERK1/2蛋白表达显著升高(P<0.05);与哮喘组比较,祛风宣痹方组大鼠肺组织p-MEK1/2、p-ERK1/2蛋白表达显著降低(P<0.05)。见图2、表2。
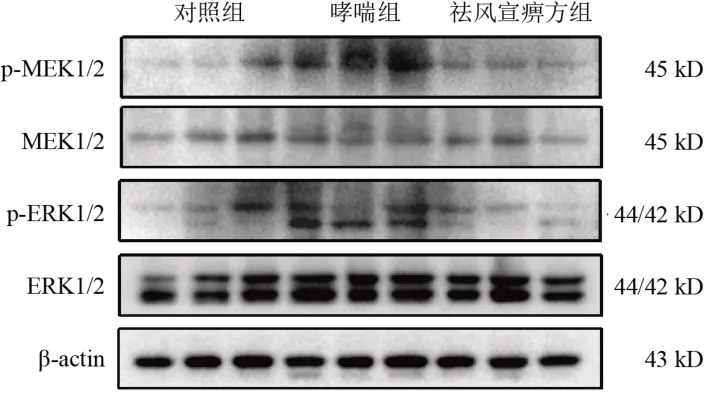
图2 各组大鼠肺组织MEK/ERK通路相关蛋白免疫印迹
表2 各组大鼠肺组织p-MEK1/2、p-ERK1/2蛋白表达比较(±s)
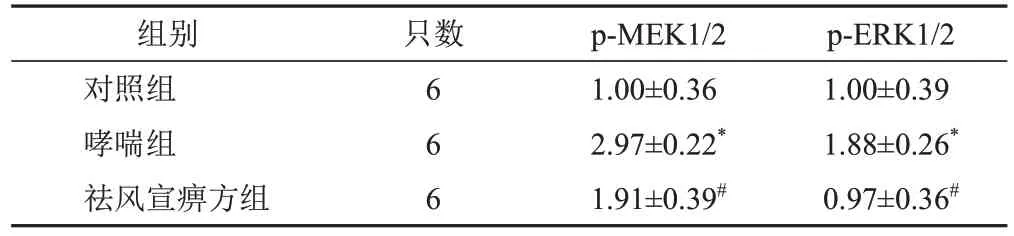
表2 各组大鼠肺组织p-MEK1/2、p-ERK1/2蛋白表达比较(±s)
注:与对照组比较,*P<0.05;与哮喘组比较,#P<0.05
组别对照组哮喘组祛风宣痹方组只数6 6 6 p-MEK1/2 1.00±0.36 2.97±0.22*1.91±0.39#p-ERK1/2 1.00±0.39 1.88±0.26*0.97±0.36#
4.4 祛风宣痹方对RAW264.7细胞活力的影响
不同浓度祛风宣痹方(0~320 μg/mL)作用RAW264.7细胞24 h后,与对照组比较,5~40 μg/mL祛风宣痹方对细胞活力无显著影响(P>0.05),80~320 μg/mL祛风宣痹方能显著降低RAW264.7细胞活力(P<0.05),因此选择40 μg/mL祛风宣痹方用于后续实验。见表3。
表3 不同浓度祛风宣痹方对RAW264.7细胞活力的影响(±s,%)
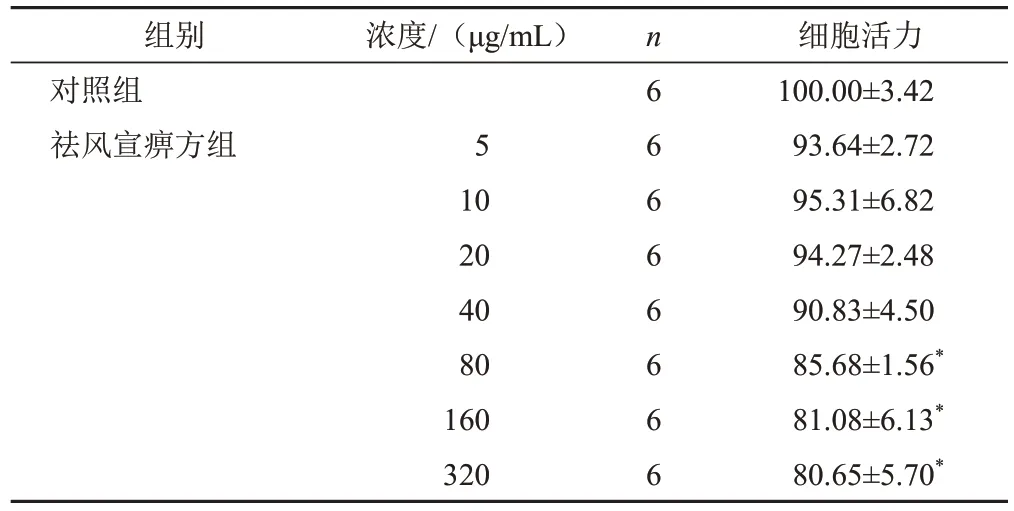
表3 不同浓度祛风宣痹方对RAW264.7细胞活力的影响(±s,%)
注:与对照组比较,*P<0.05
组别对照组祛风宣痹方组浓度/(μg/mL)5 10 20 40 80 160 320 n6 6 6 6 6 6 6 6细胞活力100.00±3.42 93.64±2.72 95.31±6.82 94.27±2.48 90.83±4.50 85.68±1.56*81.08±6.13*80.65±5.70*
4.5 祛风宣痹方对细胞培养液白细胞介素-6含量的影响
与对照组比较,LPS组细胞培养液IL-6含量显著增加(P<0.01);与LPS组比较,祛风宣痹方组和U0126组细胞培养液IL-6含量显著减少(P<0.05)。见表4。
表4 各组RAW264.7细胞培养液IL-6含量比较(±s,pg/mL)
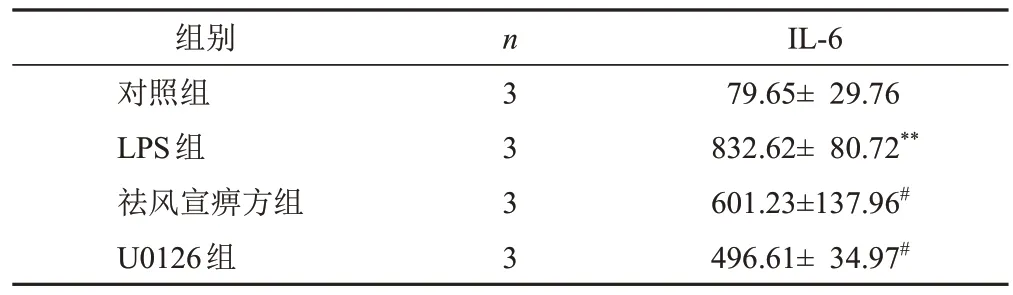
表4 各组RAW264.7细胞培养液IL-6含量比较(±s,pg/mL)
注:与对照组比较,**P<0.01;与LPS组比较,#P<0.05
组别对照组LPS组祛风宣痹方组U0126组n 3 3 3 3 IL-6 79.65± 29.76 832.62± 80.72**601.23±137.96#496.61± 34.97#
4.6 祛风宣痹方对RAW 264.7细胞MEK/ERK信号通路相关蛋白表达的影响
与对照组比较,LPS组细胞p-MEK1/2、p-ERK1/2蛋白表达显著升高(P<0.01);与LPS组比较,祛风宣痹方组和U0126组细胞p-MEK1/2、p-ERK1/2蛋白表达显著降低(P<0.01)。见图3、表5。
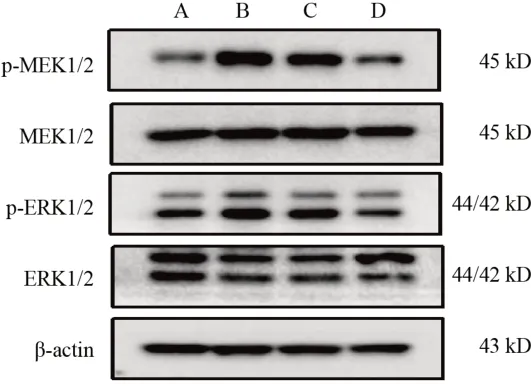
图3 各组RAW264.7细胞MEK/ERK信号通路相关蛋白免疫印迹
表5 各组RAW264.7细胞p-MEK1/2、p-ERK1/2蛋白表达比较(±s)
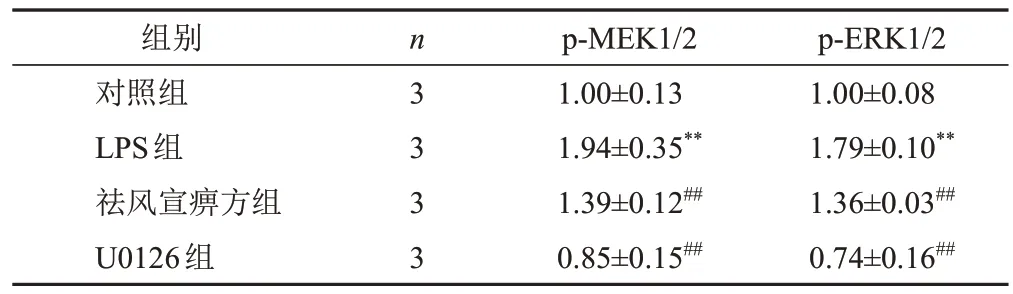
表5 各组RAW264.7细胞p-MEK1/2、p-ERK1/2蛋白表达比较(±s)
注:与对照组比较,**P<0.01;与LPS组比较,##P<0.01
组别对照组LPS组祛风宣痹方组U0126组n 3 3 3 3 p-MEK1/2 1.00±0.13 1.94±0.35**1.39±0.12##0.85±0.15##p-ERK1/2 1.00±0.08 1.79±0.10**1.36±0.03##0.74±0.16##
5 讨论
目前哮喘全球患病人数约4亿,我国哮喘患者已超过4 500万人,且每年因哮喘死亡者高达20万人[8]。哮喘发作与中医学“风痰”密切相关。课题组前期研究发现,风痰阻肺是哮喘患者最常见的中医证型之一,其关键病机为风痰阻肺、肺失宣肃、胸阳痹阻。祛风宣痹方中炙麻黄祛风平喘,薤白通阳宣痹,制僵蚕熄风止痉,共为君药;射干祛痰利咽,瓜蒌泄浊宽胸,地龙祛风通络,葶苈子泻肺化痰,苦杏仁肃肺降气,白芍、炙甘草柔肝缓急、止痉平喘,共为臣药;海风藤祛风除湿,黄芩清肺热,桃仁化瘀血,蛤壳软坚化痰,蛇床子祛风燥湿、温肾助阳。诸药合用,共奏祛风宣痹、化痰通阳、肃肺平喘之效。
IgE是一种免疫球蛋白,其在哮喘发病过程中的多效性作用是通过激活免疫炎症细胞和气道结构细胞表达的特异性IgE受体介导的。此外,相关临床研究发现,哮喘患者病情与IgE水平呈正相关,抑制IgE水平有益于哮喘治疗[9]。IL-6作为重要的促炎因子,能够促进炎症急性反应期蛋白合成,是诱导哮喘气道炎症发生的关键因素之一[10]。此外,有研究表明,哮喘患者IL-6水平可以反映肺功能损伤程度[11]。在前期研究基础上,本研究体内实验以OVA腹腔注射致敏再雾化激发的方法制备哮喘大鼠模型,体外实验以LPS诱导RAW264.7细胞炎症反应,均予祛风宣痹方干预,从肺组织病理改变,血清、肺泡灌洗液及细胞培养液IgE、IL-6水平考察祛风宣痹方的干预效果。结果显示,模型大鼠肺组织炎症细胞浸润、水肿明显,血清和肺泡灌洗液IgE、IL-6含量增加,而祛风宣痹方能抑制模型大鼠病理改变,改善气道炎症。此外,LPS诱导后,RAW264.7细胞培养液IL-6含量增加,祛风宣痹方能逆转这一变化,表明祛风宣痹方可以抑制RAW264.7细胞炎症反应。
MEK和ERK是丝裂原活化蛋白激酶三级酶促级联反应的重要组成部分。上游激活蛋白RAS与RAF蛋白结合后,形成具有激活RAF激酶活性的二聚体,使RAF激酶磷酸化,进一步激活MEK激酶,磷酸化ERK激酶,这一过程可以促进炎症因子的生成和释放,使机体产生炎症反应[12-13]。研究表明,MEK/ERK信号通路能调节IL-6表达,抑制ERK激活不仅能下调IL-6表达,还能阻断IL-6受体表达[14-15]。本实验中,模型大鼠肺组织和LPS诱导的RAW264.7细胞p-MEK1/2和p-ERK1/2蛋白表达均显著升高,表明MEK/ERK信号通路激活与哮喘发生密切相关。而祛风宣痹方可减少模型大鼠血清、肺泡灌洗液及细胞培养液IL-6分泌,抑制MEK1/2、ERK1/2蛋白磷酸化,其作用与MEK通路抑制剂U0126相当,提示祛风宣痹方能通过MEK/ERK信号通路发挥改善气道炎症作用。
综上所述,祛风宣痹方能通过抑制MEK/ERK信号通路改善气道炎症,从而治疗哮喘。今后本课题组将继续深入研究祛风宣痹方改善气道炎症的其他作用机制,为其临床应用提供实验依据。

