藏药多刺绿绒蒿MYB转录因子家族的鉴定与分析
郭佳妮,向妮艳,张文才,陈忠海,刘 星,3*,丁亚丽
1.西藏大学理学院 青藏高原生态与环境研究中心极端环境生物适应与进化实验室,西藏 拉萨 850000
2.西藏大学医学院,西藏 拉萨 850000
3.武汉大学生命科学学院,湖北 武汉 430072
转录因子是一类重要的基因表达调控因子,通常具有DNA 结合结构域、反转录激活结构域、核定位信号和寡聚位点,能够调控特定基因的转录与表达。在转录因子家族中,MYB 转录因子数量众多、功能多样,是植物中最重要的转录因子家族之一[1],MYB 转录因子家族具有高度保守的DNA 结合结构域,该保守结构域由1~4 个串联且不完全重复的R 基序组成,每一个R 基序编码50~53 个氨基酸残基,经过折叠形成HTH 的螺旋-转角-螺旋结构[2]。MYB 转录因子依据其N 端含有的特有保守基序的数量划分为 1R-MYB(MYB-related)、
2R-MYB(R2R3-MYB)、3R-MYB(R1R2R3-MYB)和4R-MYB 4 个亚家族[3],其中2R-MYB 是植物中最常见和目前功能研究最多的亚家族[4-5]。MYB转录因子作为调控生长发育、次级代谢物和胁迫响应的关键调控因子[6],在植物应对高盐、干旱、极端温度和营养缺乏等非生物胁迫方面具有重要意义[7-8]。目前,MYB 转录因子在植物中得到了广泛研究,Cao 等[9]过表达苹果MdoMYB121 基因显著增强了转基因番茄和苹果植株对高盐、干旱和低温胁迫的耐受性;Cao 等[10]通过外源过表达杨梅MrMYB12 基因增加了烟草中黄酮醇的积累,从而减少了花青素的合成,产生淡粉色和纯白色的花;Zhang 等[11]发现在胁迫环境下,拟南芥AtMYB49基因可以调节叶片角质层的沉积,从而调控植株的耐盐性;Vannini 等[12]将水稻OsMYB4 基因在拟南芥中过表达显著的提高了转基因植株的耐寒性和抗冻性;Feng 等[13]发现拟南芥AtMYB68 基因在根中柱鞘细胞中的特异表达能参与调节木质素的生成,影响植株根系发育。
多刺绿绒蒿Meconopsis horridulaHook.f.et Thoms.为罂粟科绿绒蒿属一年生草本植物,叶全部基生,叶片披针形,花芽近球形,主根肥厚而延长,生长于海拔3600~5100 m 以上的草甸、高山和流石滩地带,在中国主要分布于西藏、甘肃西部、青海东部至南部和四川西部等高原地区。多刺绿绒蒿作为传统藏药,具有清热止痛、活血化瘀等功效,被藏医广泛用于治疗头伤、骨折和跌打损伤等疾病[14]。现代药理学研究表明,多刺绿绒蒿在抗病毒、抗肿瘤及心肌保护方面也有重要疗效[15-16]。李长山等[17]对多刺绿绒蒿乙醇提取物进行抗病毒活性测试,结果显示其提取物可以抑制甲型流感病毒。郭志琴[18]发现多刺绿绒蒿乙醇提取物对心肌缺血导致的血脂紊乱和心功能下降具有一定改善作用。多刺绿绒蒿具有丰富的次级代谢产物,目前从多刺绿绒蒿中分离得到黄酮类、萜类、生物碱类等化合物,其中黄酮类物质作为重要的药效物质,其含量与生长环境密切相关[19-22],在高原环境下黄酮类物质的积累,有助于植物抵御强辐射所造成的氧化损伤[23-24]。近年来多刺绿绒蒿的研究大多集中在化学成分鉴定及临床医药方面,对其如何应对高原极端环境的适应性进化及次级代谢物的调控机制却鲜有报道[25]。
本研究基于转录组数据鉴定了多刺绿绒蒿MYB转录因子家族成员,对其理化性质、二级结构、保守基序、系统进化关系和表达模式进行分析,并预测了部分多刺绿绒蒿MYB转录因子的功能,筛选出可能参与黄酮类代谢及非生物胁迫等方面的MYB 转录因子,为进一步揭示和深入研究MYB 转录因子在多刺绿绒蒿的生长发育、次生代谢及胁迫响应机制等方面提供理论依据和基础数据,为藏药多刺绿绒蒿的可持续开发利用、生物多样性保护及环境适应性机制的研究提供科学依据和数据支撑。
1 材料
多刺绿绒蒿实验材料采集于西藏自治区拉萨市达琼村(89°19ʹ57″E,30°42ʹ97″N,4925 m)、东德措(92°94ʹ52″E,30°99ʹ18″N,4872 m)和夺底沟(91°11'16″E,29°43'33″N,3980 m)3 个不同海拔地点,每个地点3 个生物学重复,共采集9 份叶片组织样品,液氮速冻后,存放于超低温冰箱(-80 ℃);进行转录组测序,共获得60.15 Gb 转录组数据。样品由武汉大学生命科学学院刘星教授鉴定多刺绿绒蒿M.horridulaHook.f.et Thoms.植株,标本现保存于西藏大学青藏高原生态与环境研究中心极端环境生物适应与进化实验室。
2 方法
2.1 多刺绿绒蒿MYB 家族鉴定及理化性质分析
在Pfam(http://pfam.xfam.org)网站中下载MYB转录因子的隐马尔可夫模型(PF00249),利用HMMER3.0 软件中hmmsearch 程序进行鉴定;下载拟南芥已发表MYB 转录因子家族成员作为种子文件,利用Blast 软件进行blastp 比对;将hmmsearch与blastp 2 种鉴定结果进行合并取交集作为候选基因提交至SMART(https://smart.embl.de/)、NCBI-CDD(https://www.ncbi.nlm.nih.gov/)、Pfam.search(http://pfam.xfam.org/) 和 PROSITE (https://prosite.expasy.org/)数据库进行保守结构域的验证。
通过ExPASy(https://web.expasy.org/)网站对MYB 转录因子的基本理化性质进行预测;利用CELLO[CELLO:Subcellular Localization Predictive System]网站(nctu.edu.tw)进行亚细胞定位分析;利用 SOPMA[NPS@:SOPMA secondary structure prediction]网站(ibcp.fr)对蛋白质进行二级结构预测。
2.2 多刺绿绒蒿MYB转录因子基因本体(gene ontology,GO)GO 功能注释
利用 Blast2GO (Basic 6.0 https://www.blast2go.com/)软件对多刺绿绒蒿MYB转录因子进行功能预测,利用软件的Blast 工具将多刺绿绒蒿MYB转录因子蛋白序列与非冗余(nr)蛋白数据库进行比对,并对每个MYB 转录因子进行GO 注释,使用R 软件(version 4.2.1)绘制GO 注释分类图。
2.3 多刺绿绒蒿MYB转录因子保守基序分析
利用MEME(MEME,V.5.4.1,http://memesuite.org/tools/meme)在线分析网站,对多刺绿绒蒿MYB转录因子家族成员进行保守基序的鉴定,并使用TBtools 软件(version 1.09876)对保守基序分析结果进行可视化。
2.4 多刺绿绒蒿MYB转录因子系统发育分析
利用MEGA 软件(version 11)内置的Clustal W程序,将多刺绿绒蒿106 个MYB 转录因子和拟南芥195 个MYB 转录因子蛋白序列以及52 个R2R3-MYB 和拟南芥126 个R2R3-MYB 转录因子蛋白质序列分别进行序列比对,选用邻接(neighborjoining,NJ)法构建系统发育树,Bootstrap method参数取值1000,其余参数选择默认值,并使用iTOL网站(https://itol.embl.de/)进行进化树美化。
2.5 多刺绿绒蒿R2R3-MYB 蛋白特征结构域分析
利用DNAMAN(version 9.0)软件对多刺绿绒蒿R2R3-MYB 转录因子蛋白序列进行多序列比对,提取其R2 和R3 保守结构域中相应的氨基酸残基分布,利用WebLogo 3 网站(http://weblogo.Threeplusone.com/)绘制特征结构域的序列标识。
3 结果与分析
3.1 多刺绿绒蒿MYB转录因子鉴定与理化性质分析
通过Hmmsearch 和blastp 比对在多刺绿绒蒿中共得到187 个MYB 转录因子,利用SMART、PROSITE、NCBI-CDD 和Pfam 数据库筛选,去掉保守结构域不完整的和重复的序列,最终鉴定到106 个MYB 转录因子,其中1RMYB 类49 个、R2R3-MYB 类52 个、3R-MYB 类5 个,命名为MhMYB1~106(表1)。
对106 个多刺绿绒蒿MYB转录因子进行蛋白长度、相对分子质量、等电点和酸碱性等基本性质预测(表 1),结果显示其蛋白序列长度为 77(MhMYB101)~976(MhMYB50)个氨基酸残基;蛋白相对分子质量为8750(MhMYB101)~110 680(MhMYB50);等电点为4.720(MhMYB78)~10.452(MhMYB101),其中53 个转录因子蛋白等电点小于7,偏酸性,其中53 个转录因子等电点大于7,偏碱性;蛋白疏水性为-1.12(MhMYB37)~-0.31(MhMYB17),表明多刺绿绒蒿MYB转录因子均为亲水性蛋白质;不稳定系数为28.348(MhMYB29)~71.011(MhMYB9),其中MhMYB77、MhMYB47、MhMYB44、MhMYB25、MhMYB30、MhMYB94 和MhMYB29 的不稳定系数系小于40 为稳定蛋白,其余蛋白序列不稳定系数均大于40,表明多刺绿绒蒿MYB转录因子以不稳定蛋白为主。亚细胞定位预测结果显示106个MYB 转录因子有97个预测到细胞核(nuclear)中,8 个预测到线粒体(mitochondrial)中,1 个预测到细胞质(cytoplasmic)中,表明MYB 转录因子蛋白主要在细胞核中发挥作用。
为明确多刺绿绒蒿MYB转录因子的蛋白质结构组成,对MhMYBs 蛋白序列进行了二级结构预测(表1),结果显示多刺绿绒蒿MYB转录因子家族二级结构主要由4 种类型组成,其中无规则卷曲(random coil)占比为29.07%~73.45%;α-螺旋结构(alpha helix)占比为11.43%~60.47%;β-转角(beta turn)占比为1.02%~14.61%;延伸链(extend strand)占比为0~20.45%。
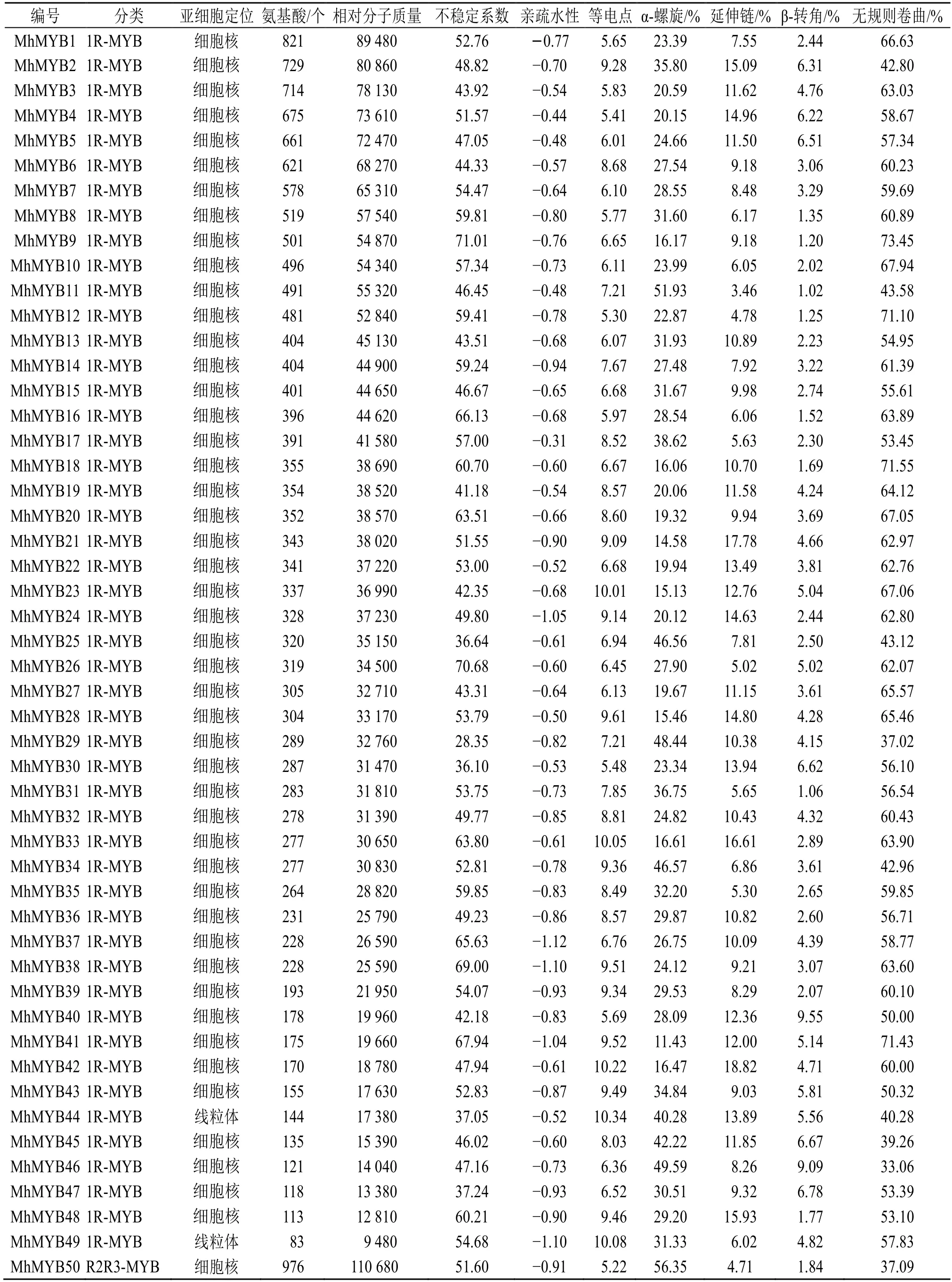
表1 多刺绿绒蒿MYB 蛋白基本信息及理化性质预测Table 1 Basic information and physicochemical properties prediction of MYB protein of M.horridula
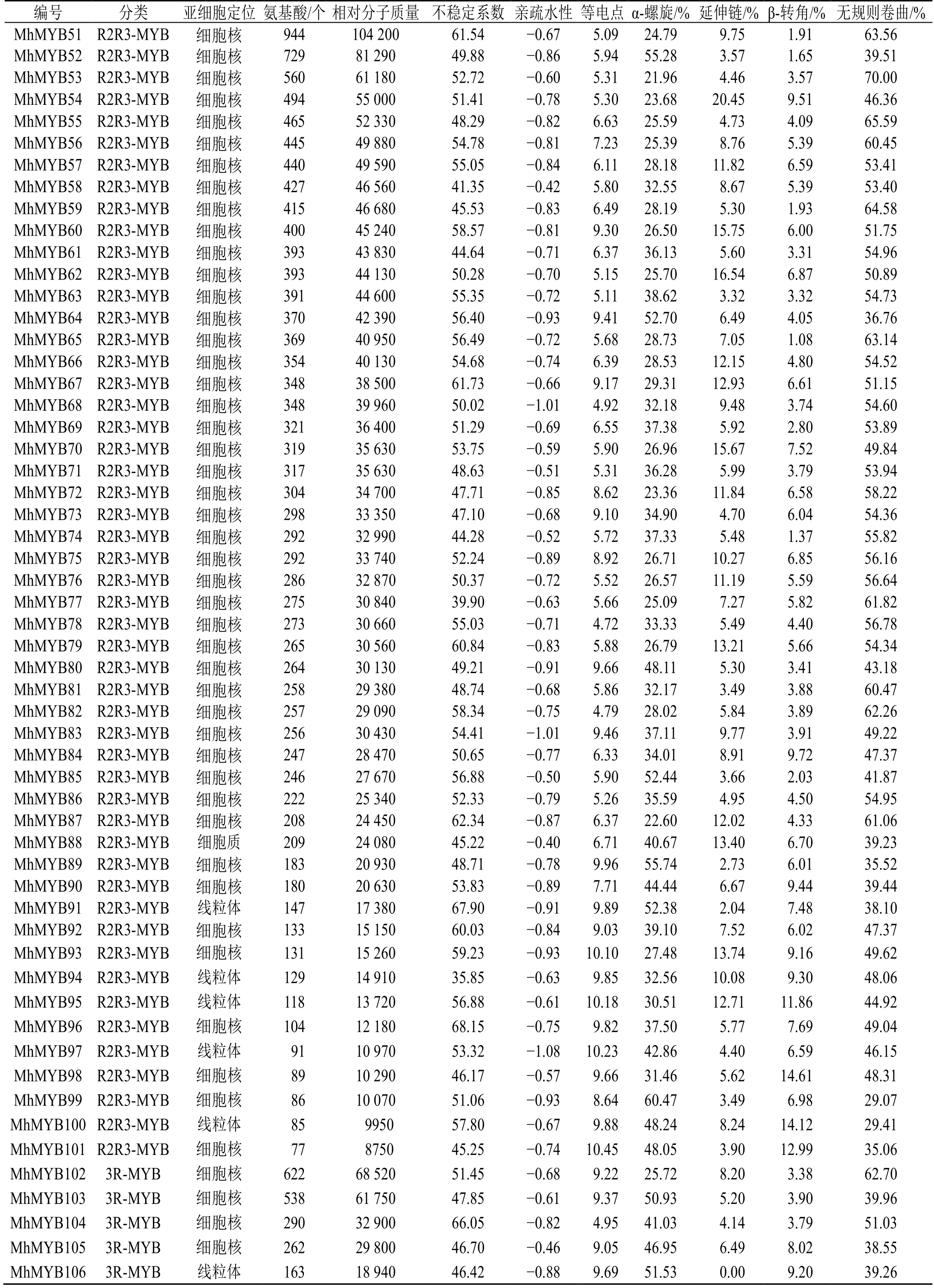
续表1
3.2 多刺绿绒蒿MYB转录因子GO 功能注释
多刺绿绒蒿MYB转录因子GO 功能预测结果显示(图1),多刺绿绒蒿MYB转录因子蛋白主要注释在细胞成分(cellular component,CC)、生物过程(biological process,BP)、和分子功能(molecular function,MF)3 大类。GO 富集分析结显示,MYB转录因子蛋白功能在细胞成分(cellular component,CC)方面主要富集在细胞核(GO:0005634)、细胞上细胞器(GO:0043229)和核糖体(GO:0000786)等细胞成分;生物过程(biological process,BP)中主要富集在细胞发育过程(GO:0048869)、细胞分化(GO:0030154)和生物合成调节(GO:0048583)等方面;分子功能(molecular function,MF)方面主要富集在转录调节活性(GO:0140110)、DNA结合(GO:0003677)和有机环化合物结合(GO:0097159)等方面。

图1 多刺绿绒蒿MYB转录因子家族GO 注释Fig.1 GO annotation of MYB transcription factor family in M.horridula
3.3 多刺绿绒蒿MYB转录因子保守基序分析
为进一步说明多刺绿绒蒿MYB转录因子的多样性和进化关系,利用MEME 网站进行保守基序分析,并结合系统发育树进行可视化(图2)。结果显示,多刺绿绒蒿MYB转录因子家族共鉴定到10 个保守基序,其中motif3(89.62%)、motif1(51.89%)和motif7(46.23%)三者出现的频率较高。其中2R-MhMYBs 亚家族基序保守性强,大多都包含了motif2、motif3、motif5、motif1 和motif7,且都位于蛋白序列N 端。1R-MhMYBs 保守基序的数量较少且位置变化较大,大多都包含了motif3 和motif4。结合系统进化分析发现,同一亚家族具有相似的motif 的种类与分布,不同亚家族在种类与分布上具有较大差异,且处于邻近分支的MYB 转录因子的保守基序的位置结构与类型更相近。

图2 多刺绿绒蒿MYB转录因子蛋白保守motifFig.2 Motif analysis of MYB transcription factors in M.horridula
3.4 多刺绿绒蒿MYB转录因子家族系统进化分析
对106 个多刺绿绒蒿MYB转录因子与拟南芥195 个MYB 转录因子的蛋白序列进行多序列比对及系统进化分析(图3)。结果显示,多刺绿绒蒿MYB转录因子不同亚家族成员均能与拟南芥相应类型的转录因子聚类到一起,该结果与结构域鉴定分类结果基本一致,说明MhMYBs 的鉴定及分类结果可靠,表明多刺绿绒蒿和拟南芥的MYB 转录因子家族具有相似的进化过程,具有比较高的保守性。
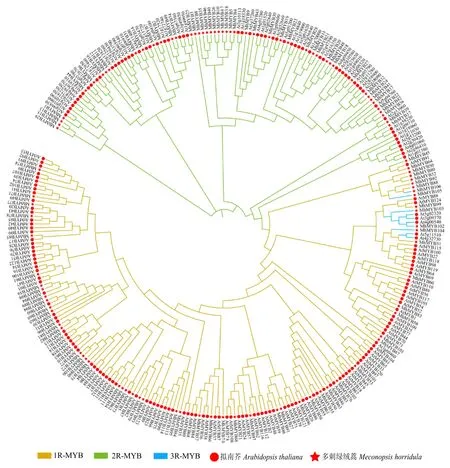
图3 多刺绿绒蒿和拟南芥MYB 转录因子家族系统进化树Fig.3 Phylogenetic tree of MYB transcription factors in M.horridula and A.thaliana
为研究多刺绿绒蒿R2R3-MhMYB 的系统进化关系,对多刺绿绒蒿与拟南芥R2R3-MYB 转录因子构建系统发育树(图 4),并结合拟南芥R2R3-MYB 蛋白亚组的分类依据[3],将多刺绿绒蒿R2R3-MYB 转录因子分为了24 个亚组(C1~C24),其中有18 个亚组能与拟南芥已分类亚组聚为一支,包括C1(S4)、C6(S1)和C10(S6)等,C3、C12 和C14 等6 个多刺绿绒蒿亚组包含拟南芥未分类的转录因子,有S3、S10、S12、S15和S16 这5 个拟南芥亚组未能与多刺绿绒蒿MYB转录因子聚类。多刺绿绒蒿与拟南芥R2R3-MYB转录因子的聚类结果表明,聚类在一起的转录因子具有较高的同源性与序列相似性,并可能具有类似的功能,多刺绿绒蒿与拟南芥物种后期朝不同的进化方向发展,也导致了部分R2R3-MYB 转录因子的特异性分化。
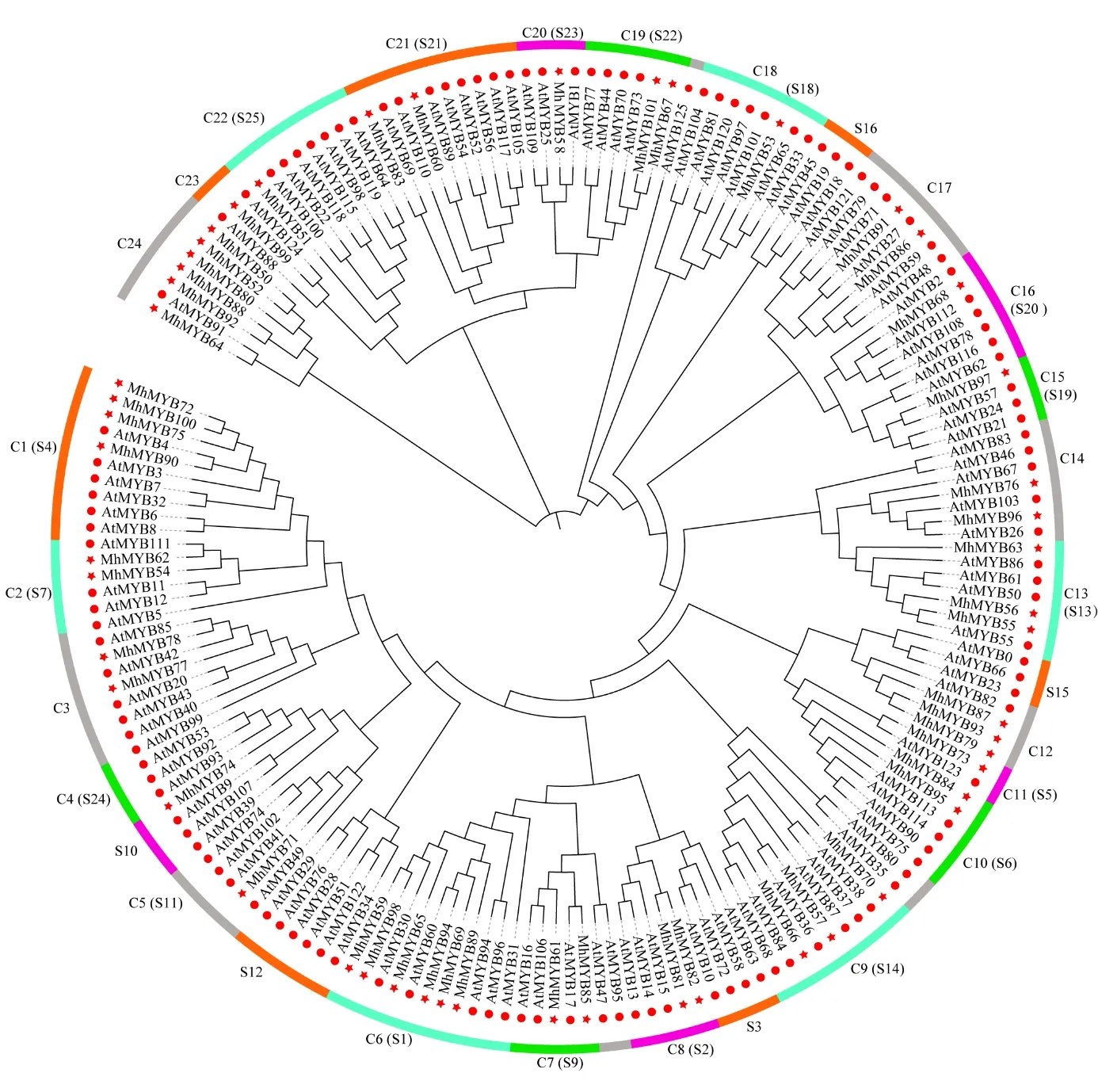
图4 多刺绿绒蒿与拟南芥R2R3-MYB 系统进化树Fig.4 Phylogenetic tree of R2R3-MYB of M.horridula and A.thaliana
3.5 多刺绿绒蒿R2R3-MYB 转录因子特征结构域分析
为研究多刺绿绒蒿R2R3-MYB 转录因子的结构域同源性特征,进一步展示在特定位置的保守性,分别对多刺绿绒蒿和拟南芥R2R3-MYB 蛋白序列进行多序列比对分析,并对R2 和R3 保守结构域特征进行可视化(图5)。结果显示多刺绿绒蒿R2R3-MYB 蛋白与拟南芥R2R3-MYB 蛋白相似,在R2 和R3 重复序列中存在多个保守的氨基酸,尤其是特征色氨酸(W),且都具有[-W-(X19)-W-(X19)-W-]和[-F-(X18)-W-(X18)-W-]结构域;其中R2 结构包括3 个极度保守的色氨酸(W),每2 个色氨酸残基间隔19 个氨基酸残基;R3 结构包括2 个极度保守的色氨酸(W),第1 个色氨酸被苯丙氨酸(F)、异亮氨酸(I)及亮氨酸(L)取代,第2 个色氨酸和第3 个色氨酸残基间隔18 个氨基酸残基;除高度保守的色氨酸(W)外,R2 和R3 结构中也存如赖氨酸(K)、苏氨酸(T)、精氨酸(R)、天冬酰胺(N)、甘氨酸(G)和谷氨酸(E)等保守氨基酸残基,这类保守氨基酸残基通常出现在各重复区的后半部分,即第2 和第3 个的保守色氨酸之间的区域,且在每个重复区中与前2 个螺旋区域相比第3 个螺旋区保守性更高,表明这类保守氨基酸残基具有维持MYB 结构域的HTH 结构的作用。

图5 多刺绿绒蒿和拟南芥R2R3-MYB 转录因子特征结构域序列标识Fig.5 Conserved domain logos of R2R3-MYB transcription factors in M.horridula and A.thaliana
3.6 多刺绿绒蒿MYB转录因子表达分析
MYB 转录因子在非生物胁迫及植物黄酮类代谢方面具有重要调节作用,多刺绿绒蒿生长于青藏高原高海拔地区,生长环境恶劣多变,为探究多刺绿绒蒿MYB转录因子在不同海拔间的潜在关系,研究多刺绿绒蒿R2R3-MYB 转录因子与黄酮类合成途径和非生物胁迫相关基因在不同海拔的表达特异性,对多刺绿绒蒿MYB转录因子进行表达模式分析(图6)。结果显示,106 个MYB 转录因子中,有28 个转录因子的表达量随海拔升高而升高,11 个转录因子表达量随海拔升高而降低。52 个R2R3-MYB 转录因子中,14个转录因子的表达量变化与海拔变化一致,5 个转录因子表达量与海拔变化相反。其中MhMYB90、MhMYB84和MhMYB62分别聚类到拟南芥黄酮类代谢物相关的S4、S6、S7 亚组,表达量均与海拔呈正相关;MhMYB 81、MhMYB 82,MhMYB63、MhMYB56、MhMYB55,MhMYB83,MhMYB101,MhMYB 58分别聚类到拟南芥非生物胁迫相关的S2、S13、S21、S22、S23 亚组,其中MhMYB81,MhMYB63、MhMYB56、MhMYB55,MhMYB83,MhMYB101,MhMYB58 表达量变化与海拔变化一致,MhMYB82 表达量变化与海拔变化相反。
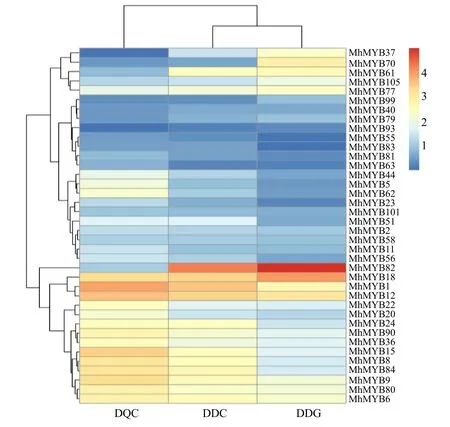
图6 不同海拔梯度下多刺绿绒蒿MYB转录因子的表达量分析Fig.6 Expression profiles of MYB transcription factors of M.horridula in different altitude gradients
4 讨论
MYB 转录因子具有特有的MYB DNA 结合域,能够特异结合基因启动子区域的作用元件,根据植物生长发育及环境变化调控相关的基因的转录表达,是植物生长过程中的重要调节因子[26],对植物生长发育具有重要意义。目前已在拟南芥、小麦、大豆、刺梨、柑橘和杨梅等多个物种中被鉴定[27-30]。本研究基于多刺绿绒蒿转录组数据鉴定获得了106个MYB 转录因子,其中包含49 个1R-MYB、52个R2R3-MYB 和5 个3R-MYB,通过对多刺绿绒蒿MYB转录因子理化性质预测显示,多刺绿绒蒿MYB转录因子均为亲水性蛋白质,53 个蛋白偏酸性,53 个蛋白偏碱性。不稳定系数显示多刺绿绒蒿MYB转录因子中除了7 个为稳定蛋白,其余99 个都为不稳定蛋白,这与王静文等[31]对细叶百合的研究结果相类似。在亚细胞定位中预测到细胞核、线粒体和细胞质3 种类型,且主要在细胞核中发挥作用,这与Cao 等[32]分析MYB 转录因子在中国梨的细胞核中发挥重要作用相似。二级结构预测表明多刺绿绒蒿MYB转录因子家族成员存在4 种二级结构,其中α-螺旋结构和无规则卷曲占比较高,蛋白质的二级结构与蛋白质的功能息息相关,表明这2种结构更有助于MYB 蛋白质的结构形成,这与张耐等[33]对甘草MYB 的研究及李明明等[34]对谷子MYB-CC 研究结果相一致。
多刺绿绒蒿保守基序分析表明,各亚家族motif组成相对保守,聚类到同一分支的MYB 因子具有更为相似的motif 组成和分布类型,而不同分支间则有所差异,这与谷佳等[35]对三色堇MYB 转录因子的研究相一致。保守基序分析能够展现该家族进化过程中的结构特点,为其功能研究提供理论基础,相似的保守基序组成和分布表明其可能在多刺绿绒蒿的生长发育过程中具有相似的功能作用,而距离较远的分支其保守基序的位置与结构的出现差异可能是造成转录因子功能分化的重要因素[36]。对多刺绿绒蒿R2R3-MYB 特征结构域分析表明,该亚家族转录因子均含有[-W-(X19)-W-(X19)-W-]和[-F-(X18)-W-(X18)-W-]的2 个相邻的典型结构域,这与Liu 等[37]对籼稻R2R3-MYB 的研究结果一致,表明多刺绿绒蒿R2R3-MYB转录因子在DNA结合结构域上具有较高的保守性,且在序列比对中发现在重复序列的第一个螺旋区及其临近区域的保守性相对较低,常会发生氨基酸插入和缺失情况,推测该区域可能是该基因家族进化和功能分化的活跃区域,而色氨酸与其余保守度较高的氨基酸残基对共同维持HTH 结构具有重要意义。
在植物中MYB 家族有选择性地扩张,其中R2R3-MYB 是植物中存在最广泛的一类MYB 转录因子,该亚家族成员因在植物生命活动中发挥的重要作用而被广泛研究[38]。在多刺绿绒蒿中R2R3-MYB 转录因子可划分为24 个亚组,其中有18 个亚组中含有不同数量已分类亚组的AtMYB 和MhMYB 蛋白,说明MYB 转录因子进化过程相对保守[8]。拟南芥作为模式物种,MYB 转录因子的功能研究较多,以拟南芥AtMYBs 的功能作为参考,结合系统发育关系和表达分析,为探讨多刺绿绒蒿MYB转录因子的功能探究提供重要参考。聚类结果表明,MhMYB61 与拟南芥S9 的AtMYB16 聚类在一支,拟南芥AtMYB16 有助于花瓣表皮细胞的形成的功能[39];MhMYB77 与AtMYB20 聚类到一支,拟南芥AtMYB20 参与调控拟南芥次生细胞壁形成过程中木脂素和苯丙氨酸的生物合成[40]。在多刺绿绒蒿中有4 个(MhMYB72、MhMYB100、MhMYB75、MhMYB90)、2 个(MhMYB84、MhMYB95)和2 个(MhMYB62、MhMYBS54)转录因子分别与拟南芥中黄酮类化合物的调控机制以及花青素积累相关的S4、S6 和S7 亚组聚类为一支[41-43],推测此类多刺绿绒蒿转录因子也具有相似功能,表达量分析显示其中MhMYB72、MhMYB75、MhMYB90、MhMYB84 和MhMYB62 这5 个转录因子在两个高海拔居群中的表达量均高于低海拔居群,这可能与高海拔居群植株会生成黄酮类物质应对强光辐射以及干旱环境相关。拟南芥S4 亚组中的AtMYB4、AtMYB32 和AtMYB7 调控和表达能够增强植物应对强紫外线胁迫的能力[44],聚类到同支的多刺绿绒蒿转录因子在高海拔居群中的上调表达可能也在多刺绿绒蒿应对紫外线胁迫中发挥重要作用。拟南芥S1、S11、S13、S21、S22、S23 亚组主要与抗旱抗寒等非生物胁迫相关[45-48],在多刺绿绒蒿的聚类和表达分析显示共有15 个转录因子分别聚类在S1、S11、S13、S21、S22 和S23 这类亚组当中,其中有10 个转录因子在高海拔地区表达量上调,说明多刺绿绒蒿在应对更高海拔恶劣环境时会通过抗逆相关的转录因子的表达来调控次级代谢通路以应对胁迫环境,维持自身正常的生命活动。
目前,多刺绿绒蒿MYB转录因子的相关研究还非常欠缺,MYB 转录因子在多刺绿绒蒿生长发育调控及非生物胁迫的响应机制还不清楚,本研究通过生物信息学方法,鉴定了多刺绿绒蒿的MYB 转录因子,并系统地对该家族成员进行了基本理化性质、系统进化关系和表达模式等分析。为今后深入研究MYB 转录因子在多刺绿绒蒿生长发育中的作用和应对高原极端环境的调控机制提供了参考基础。
利益冲突所有作者均声明不存在利益冲突

