升麻药材化学成分及药理作用研究进展
陈李乙,李佳欣,张美晴,姚 铁,丁丽琴,邱 峰,张德芹*
1.天津中医药大学 组分中药国家重点实验室,天津 301617
2.天津中医药大学中药学院,天津 301617
升麻Cimicifugae Rhizoma入药首载于《神农本草经》,在我国有着悠久的药用历史。升麻属植物资源分布广且品种繁多,国内外学者针对升麻属植物黑升麻Cimicifuga racemose(Linne)Nuttall.、单穗升麻C.simplexWormskarl.、小升麻C.acerina(Sieb.et Zucc.)Tanaka.、云南升麻C.yunnanensisHsiao.等多种升麻基原品种的化学成分及药理作用开展了广泛而深入的研究[1]。其中来源于毛茛科植物大三叶升麻C.heracleifoliaKom.、兴安升麻C.dahurica(Turcz.)Maxim.或升麻C.foetidaL.的干燥根茎为《中国药典》2020年版(以下简称《中国药典》)收载的升麻药用正品[2],是目前中医临床药用升麻的主要药材基原。大三叶升麻,习称为关升麻,主产于辽宁、吉林、黑龙江;兴安升麻,习称为北升麻,主产于山西、河北和内蒙古;升麻,习称为西升麻、绿升麻,主产于四川、云南、甘肃等地[3]。
升降浮沉是中药药性理论的重要组成部分。但因其概念的多歧义性以及研究思路的局限性,导致对升降浮沉药性科学内涵尚不明确。中医学认为,升麻是一味既具有升浮药性,又具有沉降药性的代表药物,味辛,微甘,性微寒,归肺、脾、胃、大肠经。具有发表透疹、清热解毒、升举阳气功效,为中医临床治疗风热感冒、发热头痛、麻疹不透、齿痛、口疮、咽喉肿痛、阳毒发斑、气虚下陷、胃下垂、久泻脱肛、子宫脱垂、肾下垂、崩漏下血的常用药物。为深入开展升麻升降浮沉药性物质基础及作用机制研究,本文根据中医临床用药传统,以《中国药典》收载的升麻基原品种为研究对象,分别以“升麻”“Cimicifuga heracleifolia”“Cimicifuga dahurica”“Cimicifuga foetida”为检索词,检索1990—2021年在中国知网、PubMed 数据库中的相关研究文献,共检索到国内外文献1075 篇,筛除非药典基原品种研究文献后,纳入有效文献156 篇,对近30年来药典基原品种升麻的化学成分及药理作用研究进展进行总结和归纳,为进一步阐明升麻升降浮沉药性的科学内涵提供文献依据。
1 化学成分
与升麻属植物相同,大三叶升麻、兴安升麻以及升麻中含有丰富的化学物质,除含有升麻属植物的特征性成分三萜及其苷类化合物外,尚含有酚酸类、色酮类及木脂素、吲哚酮、生物碱、酰胺、甾醇、糖、挥发油等其他类化合物。近30年从《中国药典》收载的升麻基原品种中分离化合物总计542 种,其中三萜及其苷类380 种,酚酸类77 种,色酮类12 种,其他类化合物73种,化合物比例分布见图1。
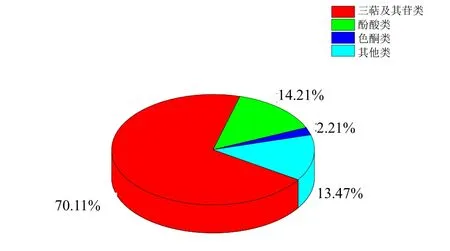
图1 1990—2021年从《中国药典》收载升麻中发现的化合物分布情况Fig.1 Proportional distribution of compounds found in Cimicifugae Rhizoma from Chinese Pharmacopoeia in 1990—2021
1.1 三萜及其苷类
1990—2021年从大三叶升麻、兴安升麻以及升麻中分离得到的三萜及其苷类成分有380 种,占总化合物数量的70.11%。其化合物名称、分子式、植物来源见表1。

表1 1990—2021 从《中国药典》收载升麻中发现的三萜及其苷类化合物Table 1 Structures of triterpenoids and their glycosides found in Cimicifugae Rhizoma from Chinese Pharmacopoeia in 1990—2021

续表1

续表1

续表1

续表1

续表1

续表1
1.2 酚酸类
1990—2021年从大三叶升麻、兴安升麻以及升麻中分离得到的酚酸类成分有77 种,占总化合物数量的14.21%。其化合物名称、分子式、植物来源见表2。

表2 1990—2021年从《中国药典》升麻中发现的酚酸类化合物Table 2 Structures of phenolic acids found in Cimicifugae Rhizoma from Chinese Pharmacopoeia in 1990—2021

续表2
1.3 色酮类
1990—2021年从大三叶升麻、兴安升麻以及升麻中分离得到的色酮类成分有12 种,占总化合物数量的2.21%。其化合物名称、分子式、植物来源见表3。

表3 1990—2021年从《中国药典》升麻中发现的色酮类化合物Table 3 Structures of chromones found in Cimicifugae Rhizoma from Chinese Pharmacopoeia in 1990—2021
1.4 其他类
1990—2021年从大三叶升麻、兴安升麻以及升麻中分离得到的木脂素、吲哚酮、生物碱、酰胺、甾醇、糖、挥发油等其他类成分有73 种,占总化合物数量的13.47%。其化合物名称、分子式、植物来源见表4。

表4 1990—2021年从《中国药典》升麻中发现的其他类化合物Table 4 Structures of other compounds found in Cimicifugae Rhizoma from Chinese Pharmacopoeia in 1990—2021
续表4
2 升麻的药理研究
近30年来,国内外学者对大三叶升麻、兴安升麻以及升麻进行了大量的体内、外药理活性筛选研究,结果显示,升麻具有抗肿瘤、抗炎、抗病毒、抗骨质疏松、降糖调脂、抗氧化、调节胃肠、神经保护、兴奋平滑肌、抗补体活性、抗突变、抗缺氧、抗抑郁、抗色素沉着、免疫抑制、抗更年期综合征、抗胆碱酯酶等多方面的药理活性,通过构建升麻药材有效组分-药理作用-传统中医功效主治-升降浮沉药性网络分析框架,可以清晰地揭示升麻升降浮沉药性物质基础及作用机制之间的内在联系。研究文献比例分布见图2。升麻药材升降浮沉药性物质及作用机制示意图见图3。
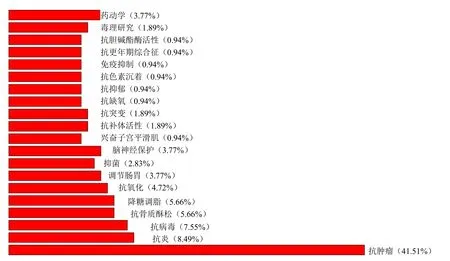
图2 1990—2021年《中国药典》收载升麻药理研究文献比例分布情况Fig.2 Proportional distribution of Cimicifugae Rhizoma pharmacology literature from Chinese Pharmacopoeia in 1990—2021
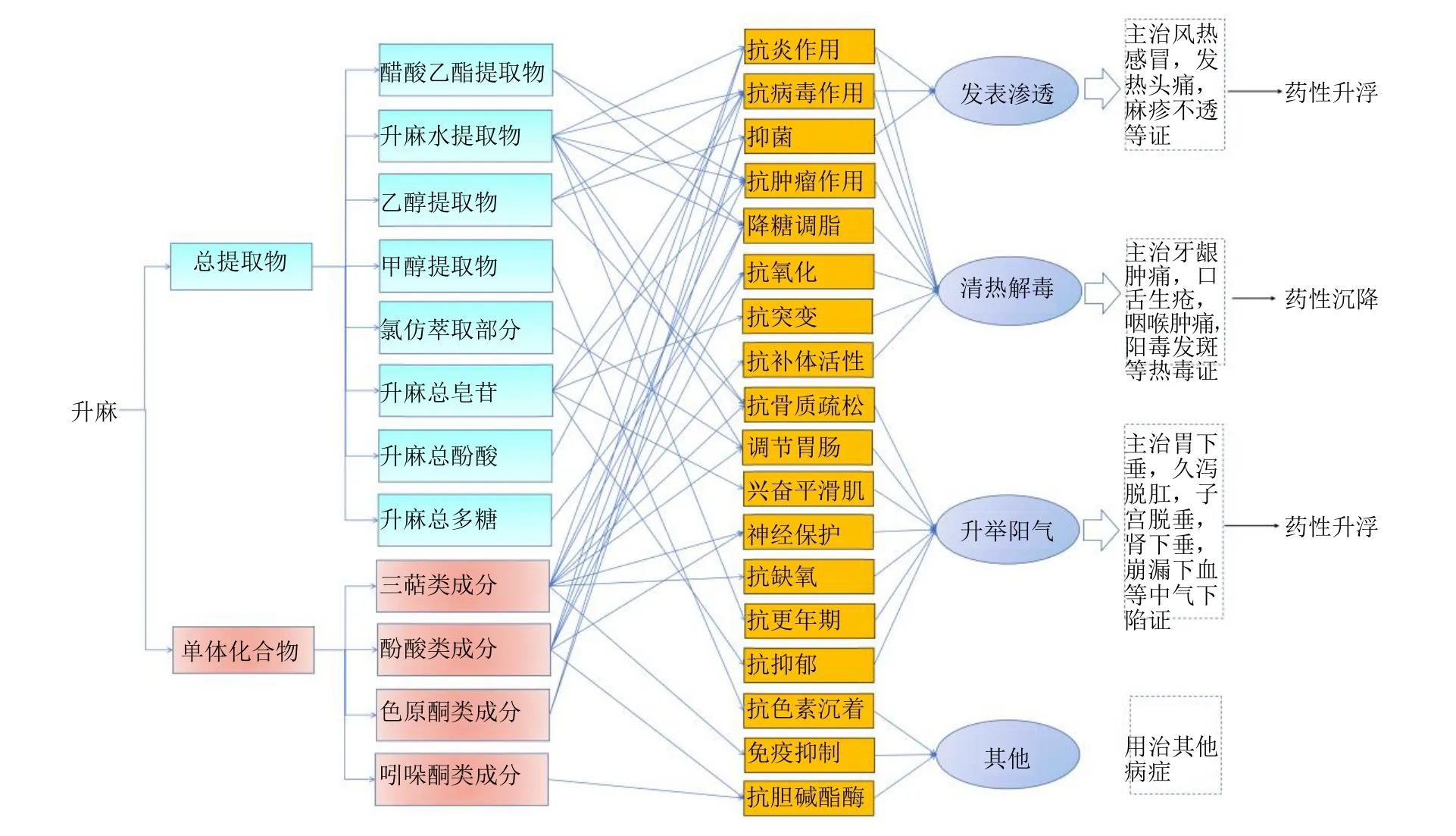
图3 升麻药材升降浮沉药性物质及作用机制示意图Fig.3 Schematic diagram of ascending and descending medicinal substances and their mechanism of action of Cimicifugae Rhizoma
2.1 抗肿瘤
研究表明,升麻醋酸乙酯提取物、水提物、三萜总皂苷、三萜及其苷类单体化合物是升麻抗肿瘤作用的主要活性组分,具有广谱和有效的细胞毒活性,与《神农本草经》记载的升麻“主解百毒”功效相符合。药效机制主要与抗癌细胞增殖,诱导癌细胞周期阻滞及细胞凋亡,调节癌症相关信号通路等有关。离体研究发现,升麻提取物及三萜类单体成分对多种肿瘤细胞系具有细胞毒活性。cimigenol型糖苷对人急性早幼粒白血病HL-60 细胞、肝癌CMCC-7721 细胞、直肠癌SW-480 细胞等具有广谱和中等细胞毒性,半数抑制浓度(IC50)值为4.2~14.5 μmol/L。cimigenol 型苷元表现出广谱和弱细胞毒性,IC50值约为20 μmol/L[59]。升麻三萜色原酮B、D、I,对紫杉醇耐药的肺癌A-549 细胞系呈现出一定的细胞毒活性,其IC50值范围为15.73~27.14 μmol/L,与阳性对照药顺铂相当[68,74]。
升麻环氧醇苷对乳腺癌细胞系具有细胞毒活性,可呈浓度相关性地抑制MCF-7 和MDA-MB-231细胞的增殖。其通过γ-分泌酶/Notc 轴介导线粒体凋亡和上皮间质转化从而抑制乳腺癌细胞增殖和迁移,作用机制包括抑制γ-分泌酶催化亚基PSEN-1 的激活,介导PSEN-1 参与Notch 蛋白剪切[76]。升麻提取物醋酸乙酯及正丁醇萃取部分可抑制人乳腺癌细胞系的增殖、迁移和侵袭;醋酸乙酯部分较正丁醇部分效果显著;三萜皂苷是醋酸乙酯部分中的抗肿瘤活性成分。通过上调Bcl-2 相关X 蛋白基因(Bcl-2 associated X protein,Bax)、Caspase-9/3和细胞色素C 蛋白表达,下调B 淋巴细胞瘤2(Bcell lymphoma 2,Bcl-2)蛋白表达促进人乳腺癌细胞的凋亡[95]。三萜类化合物阿克特素对多种肿瘤细胞均有抑制作用,可通过激活p53/Caspase-3 信号通路促进TRAIL 诱导的胃癌细胞凋亡[96];抑制口腔鳞状细胞癌细胞的增值,诱导G1 期细胞阻滞,诱导细胞凋亡,通过激活Akt/FoxO1 信号通路拮抗口腔鳞状细胞癌细胞的增殖[97];通过下调肌苷-5-单磷酸脱氢酶2 水平拮抗PI3K/Akt 信号通路抑制人结肠癌细胞的增殖[98]。
2.2 抗炎
研究表明,升麻水提物、酚酸类、三萜及其苷类化合物是升麻抗炎作用的主要活性组分。尤其是阿魏酸和异阿魏酸等酚酸类化合物具有很强的抗炎活性,是升麻发挥清热解毒功效的主要有效物质。药效机制主要与抑制炎性介质释放、调节炎症相关蛋白表达、调控中性粒细胞数量和功能等有关。三萜类化合物cimigenoside可抑制CXCL2 和CXCL10的产生以及P-选择素、血管细胞黏附分子 1 的表达而防止肺部中性粒细胞浸润。抑制poly(I∶C)诱导的人气道上皮细胞系BEAS-2B 细胞产生炎性细胞因子和趋化因子[12]。酚酸类化合物升麻酸E、反式-N-阿魏酰酪胺、升麻酸 D 等可抑制脂多糖(Lipopolysaccharide,LPS)刺激的RAW 264.7 巨噬细胞中的前列腺素E2生成,下调COX-2 表达从而发挥抗炎活性[88-89]。色原酮类化合物升麻苷通过抑制炎症因子白细胞介素-6(interleukin-6,IL-6)、肿瘤坏死因子-α(tumornecrosisfactor,TNF-α)表达,增加三磷酸腺苷结合盒转运体A1 蛋白表达,促进胆固醇外排而发挥抗炎及抑制动脉粥样硬化作用[99]。
2.3 抗病毒
研究表明,升麻水提物、醇提物、总皂苷、总酚酸、及酚酸类、色酮类单体化合物是升麻抗病毒作用的主要活性组分。药效机制主要与抑制病毒产量及活性、刺激上皮细胞分泌干扰素-β等有关。升麻水提物、升麻素可剂量依赖性地抑制人呼吸道合胞病毒(HRSV)诱导的人喉癌上皮HEp2 细胞和人肺腺癌A549 细胞斑块的形成,刺激上皮细胞分泌干扰素β 抵抗病毒感染,且抑制病毒吸附及增强肝素对病毒吸附的作用[100-101]。体外研究发现升麻75%乙醇提取物、总皂苷、总酚酸均具有明显抗肝炎病毒活性,半数有毒浓度(TC50)值分别为0.503 g/mL、0.455 g/g、0.315 g/g,通过抑制HBsAg分泌发挥抗病毒作用;体内研究发现各组升麻提取物可显著降低肝炎病毒转基因小鼠血清中HBeAg、HBsAg、HBV-DNA 含量,具有明显抗肝炎病毒活性及肝保护作用[102-103]。升麻水提物对人类肠道病毒A71(EV-A71)具有较强的抑制活性和较低的细胞毒性。半数有效浓度(EC50)和EC90分别为1.6 μg/mL 和5.7 μg/mL[104]。
2.4 抗骨质疏松
研究表明,升麻水提物、升麻乙醇提物、升麻三萜类单体化合物及其混合物是升麻抗骨质疏松作用的主要活性组分。药效机制主要与抑制破骨细胞吸收,促进成骨细胞增殖,增加骨密度等有关。大三叶升麻、升麻醋酸乙酯部分、三萜类化合物单体及其混合物可剂量相关性抑制低钙饮食大鼠血清中Ca2+水平增加,抑制骨吸收。增加去卵巢大鼠骨密度。三萜类化合物混合物在降低血清Ca2+水平方面比单一化合物更有效[105]。50 mg/kg 升麻水提物采用腹腔注射给药6 周,可防止去卵巢诱导的小鼠体重增加,降低血清碱性磷酸酶水平,抑制破骨细胞吸收。显著保留胫骨近端干骺端或股骨远端干骺端的骨量、骨小梁数量、骨小梁厚度、结构模型指数和骨密度。防止去卵巢诱导的小鼠骨丢失[106]。大三叶升麻和黑升麻乙醇提取物均表现出对更年期综合征的抗骨质疏松和抗高脂血症作用。大三叶升麻在缓解更年期症状方面与黑升麻作用相似,可作为黑升麻的替代品[107]。
三萜类化合物升麻醇-3-O-β-D-木糖苷、升麻酮醇-3-O-β-D-木糖苷、阿科特醇-3-O-β-D-木糖苷对卵巢切除小鼠破骨细胞的骨吸收有抑制作用,并对骨密度具有明显保护作用,且化合物之间存在协同作用。各化合物及其混合物可在不影响子宫重量的情况下防止卵巢切除小鼠的骨丢失,且单次口服后均可在小鼠血清中检测到[108]。
2.5 降糖调脂
研究表明,升麻提取物、升麻三萜类、酚酸类单体化合物是升麻降糖调脂作用的主要活性组分。药效机制主要与调节胰岛素及瘦素释放,抗高密度脂蛋白糖化、促进脂肪脂解等有关。升麻及醋酸乙酯萃取物可促进高脂饮食小鼠脂肪组织脂解,提高脂质利用率,并通过促进白色脂肪组织棕脂化增加能量消耗而改善小鼠高脂饮食诱导的肥胖及代谢紊乱。三萜类化合物升麻苷 H-2、升麻苷 H3、(16S,20S,24R)-12β-乙酰氧基-16,23-环氧-24,25-二羟基-3β-(β-D-吡喃木糖)-9,19-环阿屯醇-22(23)-烯和23-表-26-脱氧阿科特素在10 μmol/L 浓度下可显著降低3T3-L1 脂肪细胞中的脂肪蓄积,表现出强烈的降脂作用,抑制率为8.35%~12.07%[75]。升麻亭通 过 抑 制 IRS1/FOXO1、JAK2/STAT3 和Akt/GSK3β 通路,调节胰岛素和瘦素抵抗改善高脂饮食诱导小鼠非酒精性脂肪肝小鼠的肝脂肪变性和纤维化,有望开发为对抗非酒精性脂肪肝的有效药物[109];阿科特素、23-表-26-脱氧阿科特素显著抑制3T3-L1 前脂肪细胞脂肪化的活性,可激活脂肪组织中AMPK 和SIRT1-FOXO1 信号通路,促进高脂饮食小鼠的脂肪组织脂解[110]。
升麻提取物对培养的大鼠胰岛细胞中谷氨酸的形成和谷氨酸脱氢酶活性具有抑制作用,通过抑制谷氨酸脱氢酶活性,调节胰岛素释放从而发挥抗血糖的作用[111];异阿魏酸能显著降低自发性糖尿病大鼠的血糖[112];异阿魏酸可预防醛类物质与人血浆高密度脂蛋白上的游离氨基的结合,抑制高密度脂蛋白在糖化过程中产生的自由基诱导的氧化作用。浓度相关性地预防高密度脂蛋白糖化导致结构和功能属性的改变而发挥抗糖化作用[113]。
2.6 抗氧化
研究表明,升麻多糖、升麻酚酸类单体化合物是升麻抗氧化作用的主要活性组分。药效机制主要与清除自由基等有关。从升麻中分离到的2-阿魏酰基可以清除1,1-二苯基-2-三硝基苯肼(DPPH)自由基,IC50值为9.33 μmol/Lol/L,呈现出显著的抗氧化活性[85]。ABTS 法检测升麻多糖的抗氧化能力,当质量浓度为1.66 mg/mL 时,其总抗氧化能力为 0.64 mmol/L,对 DPPH 自由基清除率为67.94%[114];此外,升麻多糖对羟基自由基有明显的清除作用,最大清除率超过90%,清除能力与多糖浓度有明显的量效关系,具有良好抗氧化活性[115]。异阿魏酸和毛蕊花素以1∶1 的剂量比组合在清除DPPH 自由基测定中具有显著协同作用,说明黄芪和升麻组合使用比单独使用具有更好的抗氧化作用[116];异阿魏酸可抑制甲基乙二醛和赖氨酸反应过程中的羟基和超氧阴离子自由基的产生,通过自由基清除防止MG 诱导的蛋白质糖基化和DNA 损伤[117],从而发挥抗氧化作用。
2.7 调节胃肠
研究表明,升麻水提物和氯仿萃取部分、升麻皂苷类单体化合物是升麻调节胃肠作用的主要活性组分。药效机制主要与调节胃肠运动,调节胃肠激素紊乱等有关。升麻生品、蜜升麻、蜜麸升麻水提物均能显著降低脾虚小鼠胃残留率,增加肠推进率,促进胃肠功能的恢复。显著升高脾虚大鼠血清胃泌素、血浆胃动素含量,调节胃肠激素紊乱[118]。升麻水提物和氯仿萃取部分对大鼠离体小肠平滑肌有显著降低基线和幅值的作用,提示升麻水提物具有抑制小肠运动的作用[119];此外,升麻水提物及其氯仿萃取部分可抑制番泻叶引起腹泻小鼠模型的总排便数、稀便数、稀便率和腹泻指数。对正常小鼠胃排空和小肠推进率无影响。提示升麻水提物能够减轻番泻叶引起的小鼠腹泻程度[120]。
2.8 抑菌
研究表明,升麻乙醇提取物、升麻色酮类、酚酸类单体化合物是升麻抑菌作用的主要活性组分。乙醇提取物、阿魏酸、咖啡酸能有效抑制幽门螺杆菌的繁殖,保护胃损伤,阿魏酸和咖啡酸具有较强的DPPH 自由基清除活性,IC50值分别为5.68、2.63 μmol/L[102]。升麻乙醇提取物对牙菌斑主要组成变异链球菌、血链球菌、唾液链球菌、乙型溶血性链球菌4 种链球菌均有抑菌作用,其最小抑菌浓度为0.21~1.67 mg/mL[121]。升麻素对白色念珠菌、石膏样毛癣菌等11 种真菌有抑制作用,最小抑菌浓度除铁锈小茅孢菌为300 μg/mL 外,其他7种真菌均为100 μg/mL,与克霉唑相当。对以石膏毛癣菌感染的豚鼠体癣有较好的治疗作用,对大鼠完整皮肤和破损皮肤无刺激性[122]。
2.9 脑神经保护
研究表明,升麻酚酸类、皂苷类单体化合物是升麻脑神经保护作用的主要活性成分。番石榴酸-4-乙酯、番石榴酸-1-乙酯等酚酸类化合物对H2O2诱导神经毒性PC12 细胞模型具有明显的神经保护作用[54];不仅如此,4ʹ-甲氧基-3ʹ-羟基-羧基苯甲酰异阿魏酸酸酐对H2O2诱导神经毒性PC12 细胞模型亦具有明显的神经保护活性,在10 μmol/L 浓度下细胞存活率87.65%[85]。升麻苷H-1 可抑制局灶脑缺血模型大鼠脑缺血时兴奋性氨基酸谷氨酸、天门冬氨酸过度释放,增加抑制性氨基酸甘氨酸和γ-氨基丁酸浓度。能透过血脑屏障,调节脑缺血兴奋性氨基酸神经递质的功能紊乱,对缺血脑组织神经元有一定的保护作用[123]。金电酮醇、24-表-24-O-乙酰基-7,8-二去氢升麻醇3-O-β-D-吡喃木糖苷等三萜皂苷类化合物可抑制APP-CHO细胞中β-分泌酶,有效地中断β 淀粉样蛋白的产生;后者在体内可改善东莨菪碱诱导的记忆障碍小鼠认知能力和记忆相关蛋白的表达,改善认知能力和记忆[124]。
2.10 其他
此外,升麻总皂苷、升麻水提物尚有抗补体活性[6,32]、抗缺氧[9]、抗胆碱酯酶活性[15]、免疫抑制[45]、兴奋子宫平滑肌[125]、抗突变[126-127]、抗色素沉着[128]、抗抑郁[129]、抗更年期综合征[130]等其他药理作用活性。在药动学方面,有研究报道了大鼠po 或单次iv 4 种升麻苷[131]、比格犬po 5种升麻苷[132],以及升麻素[133]、咖啡酸、异阿魏酸和阿魏酸[134]在大鼠体内药动学研究进展。
3 结语
升麻属药用植物资源丰富,升麻属植物的化学成分和药理作用研究一直是国内外学者的研究热点。结合升麻在传统中医药领域中的应用,目前升麻研究尚存在以下几个方面的问题:(1)在药物基原方面:对黑升麻总状升麻,单穗升麻,小升麻、云南升麻等非《中国药典》基原升麻属植物研究较多,而对《中国药典》收载的大三叶升麻、兴安升麻或升麻研究报道还不充分。其他基原升麻是否能替代《中国药典》基原升麻应用于传统中药药性理论研究及中医药临床研究,其药效和安全性有待进一步研究和考证。传统中药升麻的升降浮沉药性研究应在中医药理论指导下,选用《中国药典》收载的升麻基原品种,紧密结合升麻的传统中医功效主治进行药性物质基础及作用机制研究。(2)在化学成分方面:对升麻三萜及皂苷类成分研究报道较多,而对升麻酚酸类、色酮类、挥发油、生物碱及多糖类等成分的研究报道较少。(3)在药理研究方面:针对升麻抗肿瘤方面研究较多,而对于与升麻功效及主治病证密切相关的抗炎、抑菌、抗病毒、抗氧化、调节胃肠功能等方面药理作用研究报道较少。且多采用体外活性筛选实验,体内研究文献相对较少,与升麻传统中医功能主治相结合的药理研究资料匮乏。因此针对《中国药典》2020年版收载的3 个升麻基原品种,结合升麻发表透疹、清热解毒、升举阳气,主治风热感冒、发热头痛、麻疹不透、齿痛、口疮、咽喉肿痛、阳毒发斑、气虚下陷、脏器脱垂等传统中医功效主治进行系统、深入的药性物质基础及作用机制研究,对于弘扬中医药特色,进一步揭示升麻升降浮沉药性的科学内涵具有重要的价值。
利益冲突所有作者均声明不存在利益冲突

