酒精性肝病相关慢加急性肝衰竭短期预后的影响因素分析
姚秋艳,吴泽生,施荣杰,杨理伟*
(1.大理大学临床医学院,云南大理 671000;2.大理大学第一附属医院消化内科,云南大理 671000)
慢加急性肝衰竭(acute-on-chronic liver failure,ACLF)是指慢性肝病患者发生肝功能急性恶化,主要临床表现为黄疸、凝血功能障碍、腹水和肝性脑病,常伴有多器官功能衰竭,短期病死率高。在我国,乙型肝炎病毒(hepatitis B virus,HBV)感染约占ACLF 病因的70%〔1〕,目前国内研究多针对HBV-ACLF 展开。然而区域性流行病学研究〔2〕显示,我国饮酒人群数量逐年上升,由此导致的酒精性肝病(alcoholic liver disease,ALD)也有较高的发病率,ALD 已成为我国约25%ACLF 患者的病因,但国内关于ALD-ACLF 预后因素的研究相对较少。本研究通过对2013 年1 月至2021 年7 月就诊于大理大学第一附属医院消化内科的96 例ALD-ACLF患者进行回顾性分析,探寻影响ALD-ACLF 患者90 d 预后的因素,建立预后评估模型,旨在指导临床对ALD-ACLF 患者制定合理诊疗方案。
1 对象与方法
1.1 研究对象回顾性分析2013 年1 月至2021年7 月于大理大学第一附属医院消化内科住院诊疗的ALD-ACLF 患者96 例的临床资料,其中,男性88 例,女性8 例;平均年龄(49.72±10.38)岁;少数民族53 例,汉族43 例;肝病基础为肝硬化者73 例,非肝硬化者23 例。所有患者入院后均给予内科综合治疗,如利尿、消肿、保肝、退黄、人工肝支持等,同时根据合并症给予相关治疗,如合并感染者给予敏感抗生素治疗等。纳入标准:所有患者均符合《酒精性肝病基层诊疗指南(2019 年)》〔3〕中ALD 诊断标准,同时符合《肝衰竭诊治指南(2018 年版)》〔4〕中ACLF 诊断标准。排除标准:①年龄小于14 岁者;②孕产妇;③患者合并其他导致肝损害的病因,如病毒性肝炎等;④合并肝癌者;⑤罹患如心力衰竭、肺心病、慢性肾功能衰竭等重要脏器疾病者;⑥肝移植者。
1.2 转归情况从患者首次住院诊断为ALDACLF 当天开始随访3 个月,随访方式为电话随访及门诊随诊,按照患者90 d 预后情况,分为存活组及死亡组。
1.3 研究方法收集所有病例首次诊断为ALDACLF 时的基线资料,包括年龄、性别、民族、肝病基础、实验室指标、伴随并发症情况等。实验室指标包括总胆红素(total bilirubin,TBIL)、白细胞(white blood cell,WBC)、红细胞(red blood cell,RBC)、血小板(platelet,PLT)、中性粒细胞(neutrophil,NEUT)、淋巴细胞(lymphocyte,LYMP)、单核细胞(monocyte,MONO)、国际标准化比值(international normalized ratio,INR)、中性粒细胞-淋巴细胞比值(neutrophil-lymphocyte ratio,NLR)、甲胎蛋白(alpha fetoprotein,AFP)、丙氨酸转氨酶(alanine aminotransferase,ALT)、天冬氨酸转氨酶(aspartate aminotransferase,AST)、白蛋白(albumin,ALB)、凝血酶原时间(prothrombin time,PT)、纤维蛋白原(fibrinogen,FIB)、血肌酐(serum creatinine,SCr)、血尿素氮(blood urea nitrogen,BUN)等。运用上述临床资料计算所有患者的终末期肝病模型(model for end-stage liver disease,MELD)评分以及Maddrey判别函数(Maddrey's discriminant function,MDF)分值,用以评价新建的预后评估模型,其中,MELD 评分=9.6×ln[SCr(mg/dL)]+3.8×ln[TBIL(mg/dL)]+11.2×ln(INR)+6.4×病因(病因:胆汁性或酒精性=0,其他=1),MDF 分值=4.6×(患者PT-对照PT)+TBIL(mg/dL)。比较2 组患者的基线临床资料,通过Logistic回归分析结果建立预后评估模型,绘制受试者操作特征曲线(receiver operator characteristic curve,ROC 曲线),比较新建立模型与MDF 分值、MELD评分的曲线下面积(area under the curve,AUC),确定新建立模型的最佳截断点、敏感度、特异度和预测效能。
1.4 统计分析运用SPSS 22.0 软件和Med Calc 19.0.4 软件进行数据分析,符合正态分布的计量数据用()表示,组间比较采用t 检验;偏态分布的计量资料用[M(P25~P75)]表示,组间比较采用非参数秩和检验;计数资料用[n(%)]表示,组间比较采用χ2检验。通过单因素、多因素Logistic 回归分析结果建立预后评估模型;以ROC 曲线评价预后模型的诊断效能,P<0.05 为差异有统计学意义。
2 结果
2.1 2组患者一般资料和实验室指标比较
2.1.1 一般资料 96 例患者中,90 d 内存活49 例,死亡47 例,病死率为48.96%。2 组患者的性别、民族、年龄、肝病基础、腹水发生率、消化道出血发生率、肝性脑病发生率差异均无统计学意义(P>0.05),但死亡组患者的感染发生率显著高于存活组,差异有统计学意义(P<0.05)。见表1。

表1 存活组和死亡组患者一般资料比较
2.1.2 实验室指标 死亡组患者的TBIL、PT、INR、WBC、NEUT、NLR 水平显著高于存活组,RBC、AFP水平显著低于存活组,差异有统计学意义(P<0.05);2 组患者的ALT、AST、FIB、ALB、SCr、BUN、K、Na、LYMP、MONO、PLT 水平差异无统计学意义(P>0.05)。见表2。
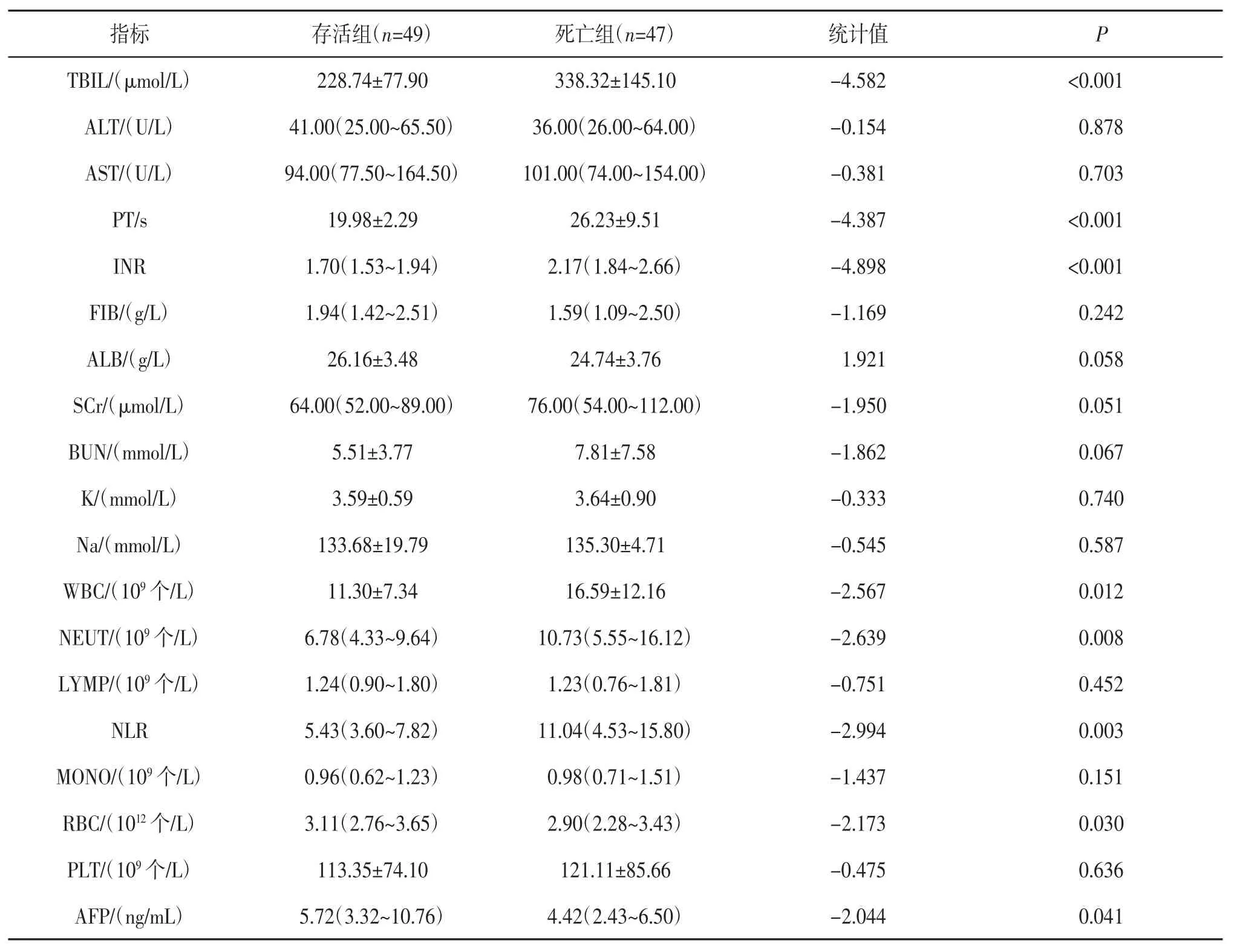
表2 存活组和死亡组患者实验室指标比较
2.1.3 评分比较 死亡组患者MELD 评分为(23.30±6.75)分,高于存活组患者的(17.88±3.13)分,二者比较差异有统计学意义(P<0.05);死亡组患者MDF 分值为72.68(53.76~91.85)分,存活组患者MDF 分值为44.00(35.54~52.67)分,二者比较差异有统计学意义(P<0.05)。
2.2 Logistic 回归分析单因素Logistic 回归分析结果显示:TBIL、PT、INR、AFP、WBC、NEUT、NLR、RBC、合并感染对ALD-ACLF 患者90 d 预后有影响(P<0.05),将上述指标纳入多因素Logistic 回归分析,结果显示:TBIL、PT、NLR、合并感染是ALDACLF 患者90 d 预后的独立影响因素。见表3。

表3 ALD-ACLF 患者90 d 预后的Logistic 回归分析
2.3 建立ALD-ACLF 患者短期预后评估模型绘制TBIL、PT、NLR、合并感染4 个指标的ROC 曲线,按多因素Logistic 回归分析结果建立ALD-ACLF 患者90 d 预后评估模型。由于合并感染属于计数资料,列入方程需按感染类别进行赋值,遂未纳入预后评估模型。预后评估模型=0.013×CTBIL+0.085×CNLR+0.575×CPT,该模型的最佳截断点为16.34,特异度为77.55%,敏感度为87.23%,AUC 为0.913(95%CI 为0.856~0.969),高于MELD 评分,差异有统计学意义(P <0.05)。见表4 和图1。预后评估模型的Nagelkerke R2为0.646,Hosmer-Lemeshow 检验结果显示模型预测效能为80.2%,拟合效果较好,但预后评估模型与MDF 分值的AUC 比较差异无统计学意义。
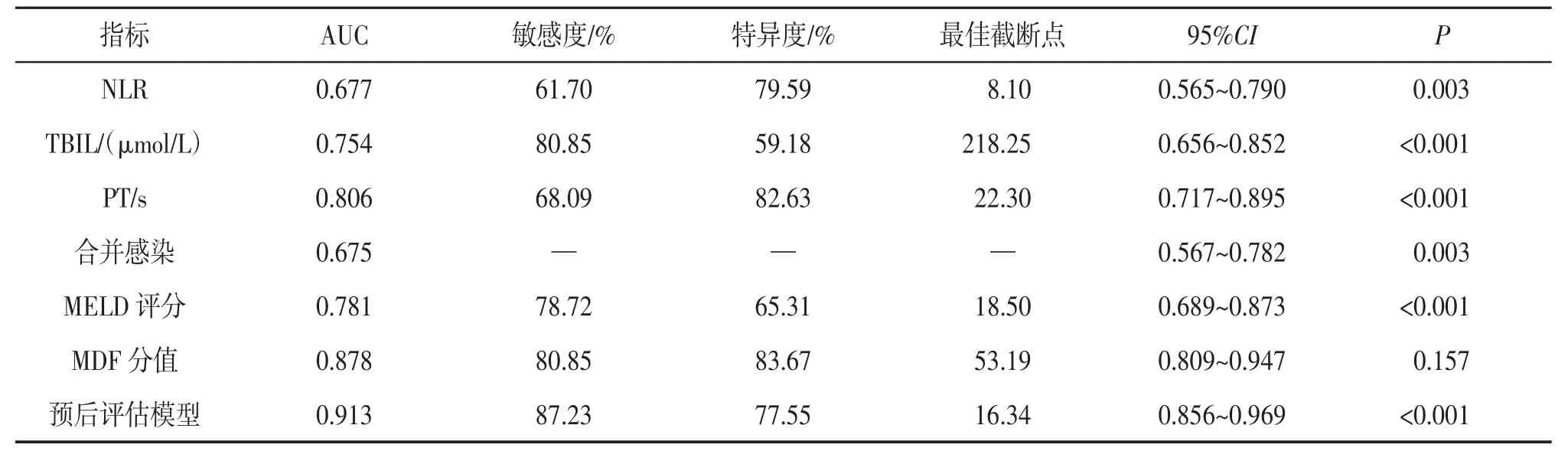
表4 ALD-ACLF 患者90 d 预后ROC 曲线分析
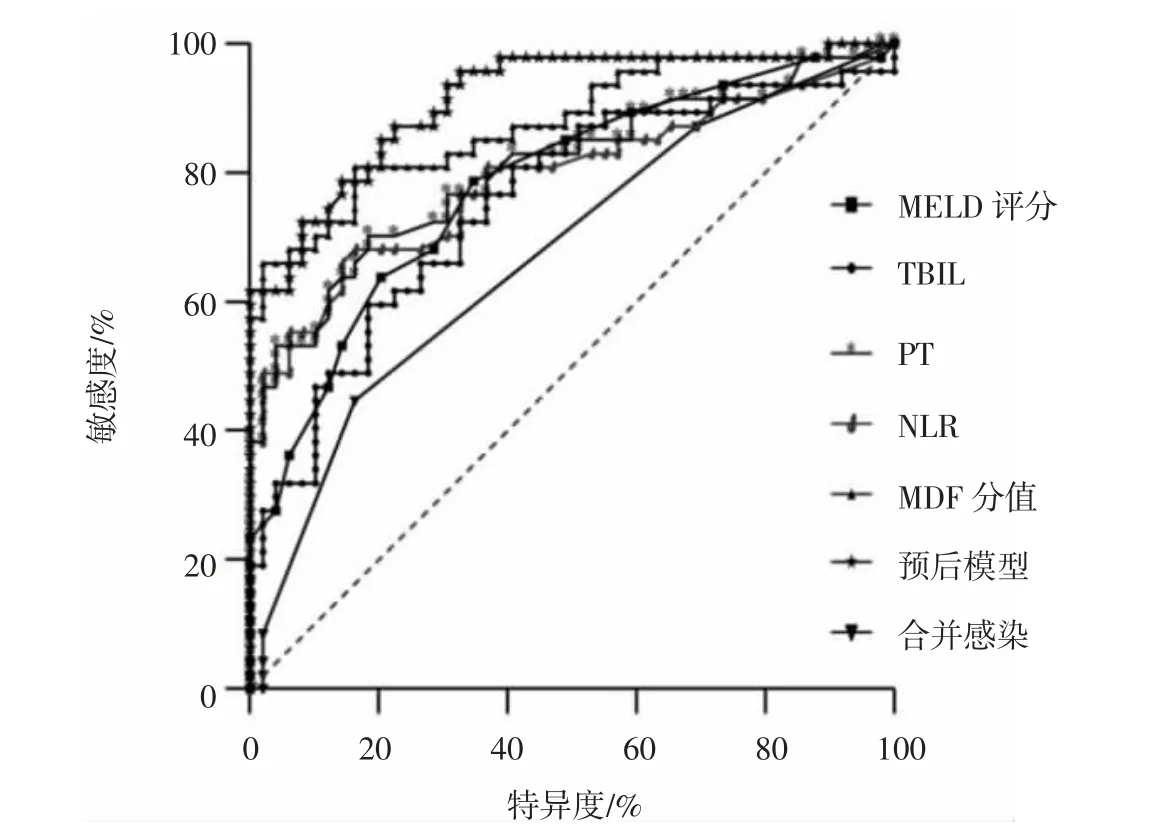
图1 ALD-ACLF 患者短期预后ROC 曲线
3 讨论
慢性饮酒是世界范围内最常见的发病和病死原因之一,有研究〔5〕发现,每10 万人中就有51.1名男性和27.1 名女性患有酒精性肝硬化。在我国,ALD 已成为除HBV 感染外ACLF 患者的第二大病因,比例约为25%〔2〕。慢性肝病一旦进展为ACLF,预示着短期病死率高,治疗效果差,预后不良。在本研究中,ALD-ACLF 患者90 d 病死率高达48.96%,因此研究分析ALD-ACLF 的短期预后影响因素对于合理制定诊疗方案、改善患者预后有着重要意义。
本研究中,ALD-ACLF 患者以男性为主,这符合男性更易酗酒的社会现状,同时少数民族患者多于汉族患者,这与该医院地处以白族、彝族、藏族、傈僳族为主的少数民族聚居的西南边陲相关,少数民族多居住于边远山区,有久远的饮酒传统,ALD发病率高。ALD-ACLF 患者的肝病基础以肝硬化为主,这与国内HBV-ACLF 研究基本一致〔6-7〕。ALD缺乏特异性治疗药物,若患者诊断为ALD 后仍长期持续饮酒,很容易导致肝硬化,最终引起ACLF。
本研究Logistic 回归分析结果显示,TBIL、PT、NLR、合并感染是ALD-ACLF 患者90 d 预后的独立影响因素。TBIL 反映了肝脏的解毒功能,是临床诊断肝衰竭的重要依据,广泛运用于各种预测评估模型中。ACLF 患者TBIL 明显升高,与肝细胞大量坏死以及各级胆管炎症导致TBIL 代谢、排泄障碍相关,其数值越高提示肝细胞坏死程度越重,预后越差〔8〕。在本研究中,TBIL 对于ALD-ACLF 患者90 d 预后的最佳截断点为218.25 μmol/L,AUC 为0.754,有一定的预测价值。ACLF 患者凝血因子合成减少,若同时合并消化道出血、严重感染等情况,会大量消耗凝血因子,当合成量少于消耗量时会导致机体凝血因子减少,PT 延长〔9〕。PT 反映肝脏合成功能的衰竭,其数值越高,预后越差。在本研究中,PT 对于ALD-ACLF 患者90 d 预后的最佳截断点为22.30 s,AUC 为0.806,有较高的短期预后预测价值。在本研究中,ALD-ACLF 患者合并感染率较高,同时合并感染是ALD-ACLF 患者90 d 预后独立影响因素,考虑其原因与以下3 方面有关:①乙醇及乙醇代谢引起的炎症联级反应:乙醇代谢过程中产生乙醛,乙醛激活肝脏中的肝巨噬细胞,释放活性氧(reactive oxygen species,ROS)和促炎因子,ROS加速脂质过氧化导致细胞死亡〔10〕,大量炎性细胞因子激活,产生全身炎症瀑布式反应,导致脓毒血症和全身多脏器损害;②免疫缺陷:长期慢性饮酒使体液模式识别受体合成、单核细胞向M1 型巨噬细胞转化、LYMP 激活等过程及作用被抑制〔11〕,乙醇和脂多糖还会损害NEUT 的杀菌和趋化活性〔12〕,机体对抗炎症反应能力减弱,从而形成炎症恶性循环损伤机体;③ALB 降低:ALB 具有免疫调节和抗炎作用,研究〔13〕发现早期低蛋白血症是肺炎、败血症和感染性并发症的独立预测因子,因此,ALDACLF 患者易合并感染,合并感染的患者具有较高的病死率。在本研究中,合并感染对ALD-ACLF 患者90 d 预后的AUC 为0.675,有一定的预测价值,但因纳入预后评估模型需按感染类别赋值,增加计算难度,遂最终未纳入预后评估模型。NLR 近年来被广泛运用于炎症研究,有研究〔14〕指出NEUT 数量的增加代表机体存在氧化应激状态,而LYMP 数量减少代表机体恶化的营养状况及免疫调节水平能力的降低,因此,NLR 可以反映出患者的炎症、免疫及营养状态,可以预测许多疾病的预后。在本研究中,NLR 为ALD-ACLF 患者90 d 预后的独立影响因素,AUC 为0.677,最佳截断点为8.10,稍高于国内其他研究〔15-17〕,可能与本研究患者的感染发生率高相关。
MELD 评分由美国学者建立,起初用于评价肝硬化患者行经颈静脉肝内门体分流术的术后生存期,纳入TBIL、INR、SCr 和肝硬化4 个变量〔18〕,从2001 年开始作为评判是否进行肝移植的标准,之后衍生出MELD-Na、iMELD 等评分模型。临床普遍认为MLED 评分对ACLF 患者预后预测价值较高,但也存在局限,如MELD 评分未能包括ACLF 患者炎症状态评估的指标,且MELD 评分计算相对复杂。MDF 分值常用于预测酒精性肝炎的严重程度,并可作为是否选择糖皮质激素治疗的标准,大于32 分即可诊断为重症酒精性肝炎,28 d 病死率为20%~30%〔19〕,但对于ALD-ACLF 患者MDF 分值预测价值尚未得到充分研究。在本研究中,MDF 分值预测ALD-ACLF 患者90 d 预后的AUC 为0.878,有一定的预测价值。本研究通过Logistic 回归分析建立了ALD-ACLF 患者90 d 预后评估模型,模型纳入指标TBIL、PT、NLR 均为临床简单易得指标,即使是基层医疗机构亦能通过简单计算获得。同时该模型具有较好的拟合度,其AUC 高达0.913,相较于MELD评分和MDF 分值具有更高的预测价值。
综上所述,本研究显示TBIL、PT、NLR、合并感染是ALD-ACLF 患者90 d 预后的独立影响因素,并建立了ALD-ACLF 患者的短期预后评估模型,进一步证实了该模型有一定的短期预后预测价值。但由于本研究为回顾性、单中心分析,病例数相对较少,存在一定的局限性,未来需进行多中心、前瞻性的研究来证实该预后评估模型的预测价值。

