三七总皂苷对ox-LDL 诱导血小板凋亡的保护作用及机制研究
马永洁,李玮琪,伍春婷,黄新惠,周昕榆,牙甫礼,2*
(1.大理大学公共卫生学院,云南大理 671000;2.大理大学代谢性疾病转化医学研究院,云南大理 671000)
心血管疾病(cardiovascular diseases,CVDs)的发病率和病死率逐年上升,严重威胁人类健康〔1〕。高脂血症是心血管疾病的重要危险因素之一,可引起血栓形成等并发症〔2〕。血小板作为一种无核血细胞,对高脂血症中血栓形成和发展起重要作用〔3〕。凋亡作为程序性死亡,不仅发生在有核细胞中,也存在于无核的血小板中〔4〕。血小板凋亡可由各种刺激引起,包括化学因素(如凝血酶、胶原、过氧化氢、花生四烯酸、肾上腺素等)、机体高水平的氧化应激状态(如高脂血症、2 型糖尿病等)和物理因素(如高温、高剪切力等)等〔3〕。研究证实,高脂血症患者循环血液中的氧化型低密度脂蛋白(oxidized lowdensity lipoprotein,ox-LDL)可诱导血小板凋亡,进而参与血栓形成〔5〕。血小板凋亡主要依赖Bcl-2 家族的抗凋亡蛋白和促凋亡蛋白调控的内源性途径〔3,6〕。血小板受到凋亡刺激后,会发生一系列的凋亡事件,包括线粒体膜电位(mitochondrial membrane protential,Δψm)发生去极化,线粒体通透性转换孔形成以及Bcl-2 家族中的促凋亡蛋白发生表达活化并移位到线粒体,最后细胞色素c 从线粒体的膜间隙释放到胞浆中,进而激活半胱氨酸蛋白酶Caspase-3 和Caspase-9,引起血小板磷脂酰丝氨酸(phosphatidylserine,PS)的暴露,最终导致血小板凋亡〔7〕。其中Δψm的去极化在内源性凋亡途径中发挥重要作用〔8〕。研究〔5〕证实,高脂血症中ox-LDL 诱导血小板发生凋亡的机制主要是激活Src/Syk/ROS 信号通路。越来越多的研究证明,血小板凋亡在心血管疾病的进展中起着重要作用,抑制血小板凋亡已经成为改善高脂血症中血栓形成的重要措施之一〔9〕。
三七是五加科人参属中的一种多年直立草本植物。三七总皂苷(Panax notoginseng saponins,PNS)是从三七根中提取出来的最主要的药用成分,具有诸多药理作用,如抗氧化、抗动脉粥样硬化、抗肿瘤等生物学活性〔10〕。其在临床上已得到广泛应用,例如以PNS 作为主要成分的血栓通注射液常用来治疗血栓性疾病〔11〕。研究〔12-13〕表明,PNS 在体外可抑制生理性激动剂如凝血酶等诱导的血小板聚集和活化,但是PNS 调控ox-LDL 诱导血小板凋亡的作用尚未见报道,本研究旨在探讨PNS 是否可以抑制ox-LDL 诱导血小板凋亡及其潜在的分子机制。
1 材料与方法
1.1 材料与试剂活性氧(reactive oxygen species,ROS)检测试剂盒(英国Abcam 公司);JC-1(美国Enzo Life Sciences 公司);乳酸脱氢酶(lactate dehydrogenase,LDH)细胞毒性检测试剂盒(上海碧云天生物技术有限公司);PE-Annexin V 检测试剂盒(美国eBioscience 公司);PNS 粉末(纯度>98%,北京索莱宝科技公司);ox-LDL(广州奕源生物科技有限公司);一抗phospho-Src(Tyr416,武汉爱博泰克(Abclonal)生物科技有限公司);一抗phospho-Syk(Tyr323,美国Affinity Bioscience 公司);一抗cleaved Caspase-3、cleaved Casase-9、β-actin、GAPDH 以及二抗羊抗兔(美国Bioworld Technology 公司);二甲基亚砜(dimethyl sulfoxide,DMSO)、十二烷基硫酸钠(sodium dodecyl sulphate,SDS)(德国Biofroxx 公司)。
1.2 主要仪器CytoFlex 流式细胞仪(美国Beckman Coulter 公司);低温高速离心机(湖南湘立科学仪器有限公司);低温冰箱(中国青岛海尔有限公司);多功能荧光酶标仪(上海闪谱生物科技有限公司);多色荧光化学发光凝胶成像分析系统(上海培清科技有限公司);漩涡混合器(上海驰康电子有限公司);小型垂直电泳槽(美国Bio-Rad 公司);电泳仪电源(上海嘉鹏科技有限公司)。
1.3 方法
1.3.1 研究对象的招募 招募20 名研究对象,年龄25~40 岁。排除标准:①目前或曾经患有CVDs 或由免疫功能缺陷引起的疾病者;②有超过半年以上的吸烟史和饮酒史者;③曾经于2 周内服用过的药物能够显著影响血小板功能者。所有志愿者均遵循自愿原则,并签署书面知情同意书。本研究完全按照《赫尔辛基宣言》相关准则进行,并已通过大理大学伦理委员会的批准。
1.3.2 健康人血液的采集及纯化血小板的制备抽取肘静脉全血20 mL 注入含有枸橼酸钠的真空抗凝管中,然后在离心力150 g 和22 ℃的条件下离心20 min,小心吸取上清液中上层3/4 的液体即可得到富血小板血浆。富血小板血浆在离心力800 g和22 ℃的条件下离心10 min,吸弃上清液后用缓冲液(12 mmol/L 碳酸氢钠、137 mmol/L 氯化钠、0.34 mmol/L 磷酸氢二钠、1 mmol/L 氯化镁、2 mmol/L 氯化钾、5.5 mmol/L 葡萄糖、5 mmol/L 乙磺酸,pH 7.4)重悬血小板,可得到纯化血小板(血小板纯度>98%),置于37 ℃恒温箱中保存备用〔14-15〕。
1.3.3 检测PNS 对血小板细胞毒性的影响 将健康人纯化血小板分别与10%SDS(阳性对照组)、0.05%DMSO(溶剂对照组)以及1、10、50、100、150、200、250、300 μg/mL 的PNS(PNS 组)共同孵育40 min 后,离心(12 000 g,22 ℃,5 min)。当血小板发生凋亡或由各种刺激造成的血小板膜结构破坏会引起胞浆内LDH 释放到上清液里,通过检测胞浆释放到上清液中的LDH 含量(即血小板LDH 漏出量),评价细胞毒性。使用酶标仪在波长490 nm 处测定其吸光度值,作为评价血小板释放的LDH 含量。用10%SDS 刺激血小板释放全部LDH(即血小板释放的LDH 总量)。血小板LDH 漏出率(%)=(血小板LDH 漏出量/血小板释放的LDH 总量)×100%〔16〕。
1.3.4 后续实验分组 后续实验分组包括静息组:对血小板不作任何干预处理;对照组:加入溶剂对照(0.05%DMSO);PNS 低剂量组:含1 μg/mL PNS;PNS 中剂量组:含10 μg/mL PNS;PNS 高剂量组:含100 μg/mL PNS。其中对照组、PNS 各剂量组的血小板均经ox-LDL 处理。
1.3.5 流式细胞术检测血小板Δψm将纯化血小板分别与不同浓度的PNS(1、10、100 μg/mL)共同孵育40 min 后,用50 μg/mL ox-LDL 刺激血小板60 min,同时加入1 mmol/L 的CaCl2溶液,然后向每管血小板悬浊液中加入终浓度为1 μg/mL 的JC-1 染色工作液,并在37 ℃避光孵育20 min 后,加入500 μL的JC-1 染色缓冲液,立即上机检测。根据JC-1 单体及复合物浓度变化,使用常规的观察红色荧光(FL-3)和绿色荧光(FL-1)的通道分别检测血小板线粒体JC-1 聚合物和JC-1 单体的百分比,从而确定血小板Δψm的变化〔14-15,17〕。
1.3.6 流式细胞术检测血小板表面PS 暴露水平用PNS(1、10、100 μg/mL)、ox-LDL(50 μg/mL)处理纯化血小板后,避光加入终浓度为1 mmol/L 的CaCl2溶液以及Annexin V 抗体,迅速弹匀后在室温下避光孵育15 min,加入200 μL 磷酸盐缓冲液(phosphate buffer saline,PBS),立即使用CytoFlex 流式细胞仪检测血小板表面PS 的暴露水平〔14-15,17〕。
1.3.7 血小板总ROS 水平和超氧化物水平的测定将纯化血小板分别与不同浓度的PNS(1、10、100 μg/mL)共同孵育40 min 后,离心(12 000 g,5 min,4 ℃),弃除上清液,重悬血小板,与50 μg/mL ox-LDL 共同孵育60 min,然后加入20 μmol/L 的氧化应激检测液和20 μmol/L 的超氧化物检测试剂液,避光孵育,离心(12 000 g,5 min,4 ℃),弃除上清液后再次重悬血小板,用PBS(pH 7.0)对血小板进行洗涤。最后在Ex/Em=490 nm/525 nm 和Ex/Em=550 nm/620 nm 条件下测定荧光强度,检测细胞内总ROS 水平和超氧化物水平〔16〕。
1.3.8 蛋白质印迹法检测蛋白表达 将纯化血小板分别与不同浓度的PNS(1、10、100 μg/mL)共同孵育40 min 后,用50 μg/mL ox-LDL 刺激血小板60 min,然后离心(12 000 g,5 min,4 ℃),弃除上清液,在冰上将血小板裂解30 min 后,离心(12 000 g,10 min,4 ℃),上清液即所需的血小板蛋白,将蛋白进行SDS-聚丙烯酰胺凝胶电泳,最后曝光检测血小板Syk、Src 蛋白磷酸化表达水平以及Caspase-3 和Caspase-9 活化水平〔13〕。
1.3.9 统计分析 使用SPSS 20.0 软件进行统计分析,数据以()表示,多组间比较采用单因素方差分析,多组间两两比较采用Tukey 法,P<0.05 为差异有统计学意义。
2 结果与分析
2.1 PNS 对血小板细胞毒性的影响如图1 所示,溶剂对照组和PNS 组中血小板LDH 漏出率均显著低于阳性对照组(P<0.01)。1~250 μg/m LPNS 组中血小板LDH 漏出率与溶剂对照组相比,差异无统计学意义(P>0.05)。因此可以认为,PNS 在1~250 μg/mL 浓度范围内对健康人纯化血小板无明显的细胞毒性作用。但是与溶剂对照组相比,300 μg/mL PNS 能增加血小板LDH 漏出率(P<0.05),表现出明显的细胞毒性作用。此外,结合其他文献报道中所用PNS 浓度〔17-18〕,最终选择1、10、100 μg/mL 进行后续实验。

图1 PNS 对血小板细胞毒性的影响
2.2 PNS 对ox-LDL 诱导的血小板Δψm 的影响与静息组相比,对照组血小板中JC-1 单体的含量显著升高(P<0.01),说明ox-LDL 可以促进血小板发生Δψm去极化,引起血小板凋亡。与对照组相比,PNS 各剂量组可显著抑制ox-LDL 诱导的血小板Δψm去极化(P<0.01);PNS 各剂量组间比较差异无统计学意义(P>0.05)。见图2。
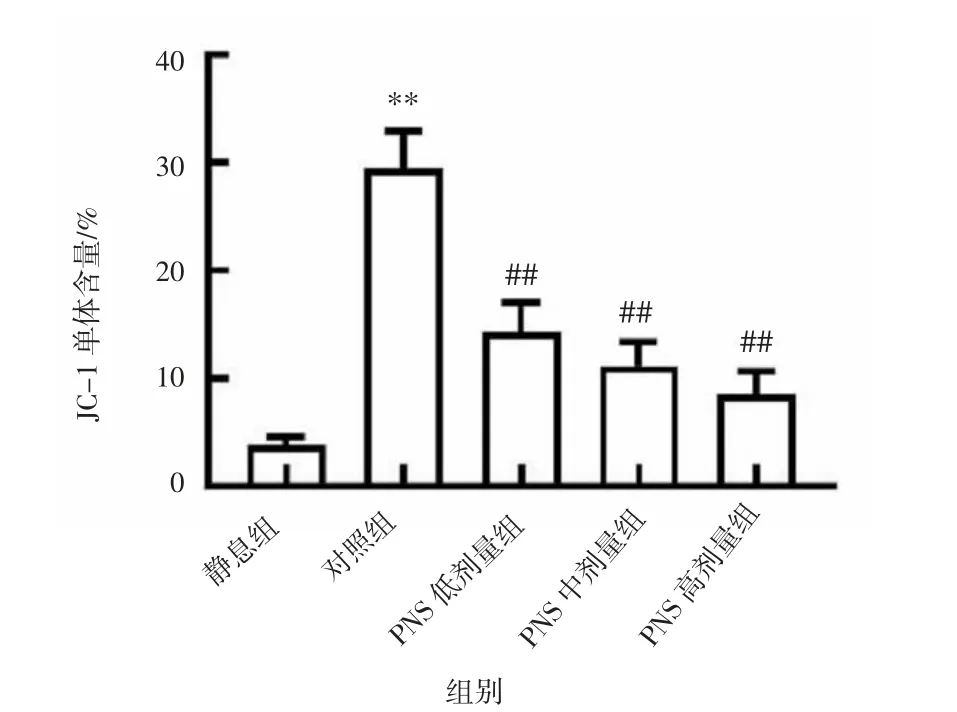
图2 PNS 对ox-LDL 诱导的血小板Δψm 的影响
2.3 PNS 对ox-LDL 诱导的血小板表面PS 暴露水平的影响ox-LDL 刺激血小板后,与静息组相比,对照组、PNS 低剂量组血小板表面PS 暴露率显著升高(P<0.01)。与对照组相比,PNS 中、高剂量组均可抑制ox-LDL 诱导的血小板表面PS 的暴露水平(P<0.05)。与PNS 低剂量组相比,PNS 高剂量组血小板表面PS 暴露率下降(P<0.05)。见图3。
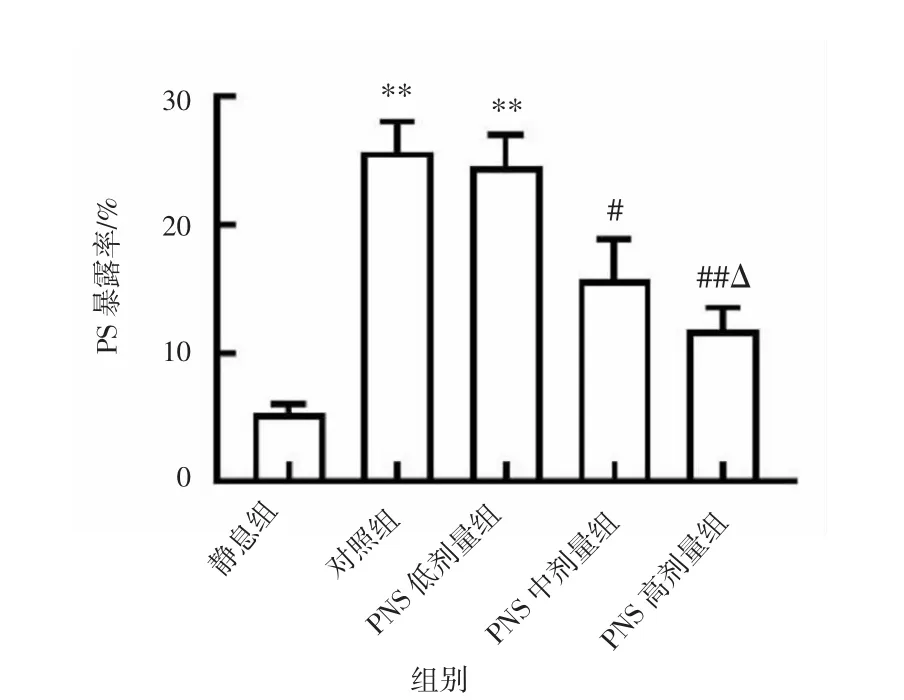
图3 PNS 对ox-LDL 诱导的血小板表面PS 暴露水平的影响
2.4 PNS 对ox-LDL 诱导的血小板氧化应激水平的影响ox-LDL 刺激血小板后,与静息组相比,对照组和PNS 低剂量组血小板总ROS 水平和超氧化物水平显著升高(P<0.01),PNS 中、高剂量组血小板总ROS 水平升高(P<0.05)。与对照组相比,PNS 中、高剂量组血小板总ROS 水平和超氧化物水平下降(P<0.05)。与PNS 低剂量组相比,PNS 中、高剂量组血小板总ROS 水平和超氧化物水平下降(P<0.05)。见图4。以上结果表明,PNS 可显著抑制ox-LDL 诱导的血小板氧化应激水平。

图4 PNS 对ox-LDL 诱导的血小板总ROS 水平和超氧化物水平的影响
2.5 PNS 对ox-LDL 诱导的血小板Caspase-3 和Caspase-9 活化水平的影响ox-LDL 刺激血小板后,与静息组相比,对照组血小板Caspase-3 和Caspase-9 的活化水平显著升高(P<0.01),PNS 低剂量组血小板Caspase-3 活化水平升高(P<0.05)。与对照组相比,PNS 中、高剂量组均可抑制ox-LDL 诱导的血小板Caspase-3 和Caspase-9 的活化水平(P<0.05)。与PNS 低剂量组相比,PNS 中、高剂量组血小板Caspase-3 活化水平降低(P<0.05)。见图5。
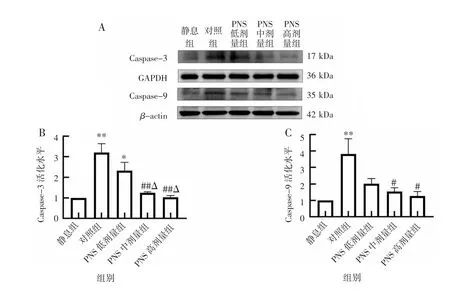
图5 PNS 对ox-LDL 诱导的血小板Caspase-3 和Caspase-9 活化水平的影响
2.6 PNS 对ox-LDL 诱导的血小板Src、Syk 蛋白的磷酸化水平的影响ox-LDL 刺激血小板后,与静息组相比,对照组、PNS 低剂量组血小板Src、Syk 蛋白的磷酸化水平升高(P<0.05)。与对照组相比,PNS中、高剂量组可抑制ox-LDL 诱导的血小板Src、Syk蛋白的磷酸化水平(P<0.05)。与PNS 低剂量组相比,PNS 高剂量组血小板Src 蛋白的磷酸化水平降低(P<0.05)。见图6。
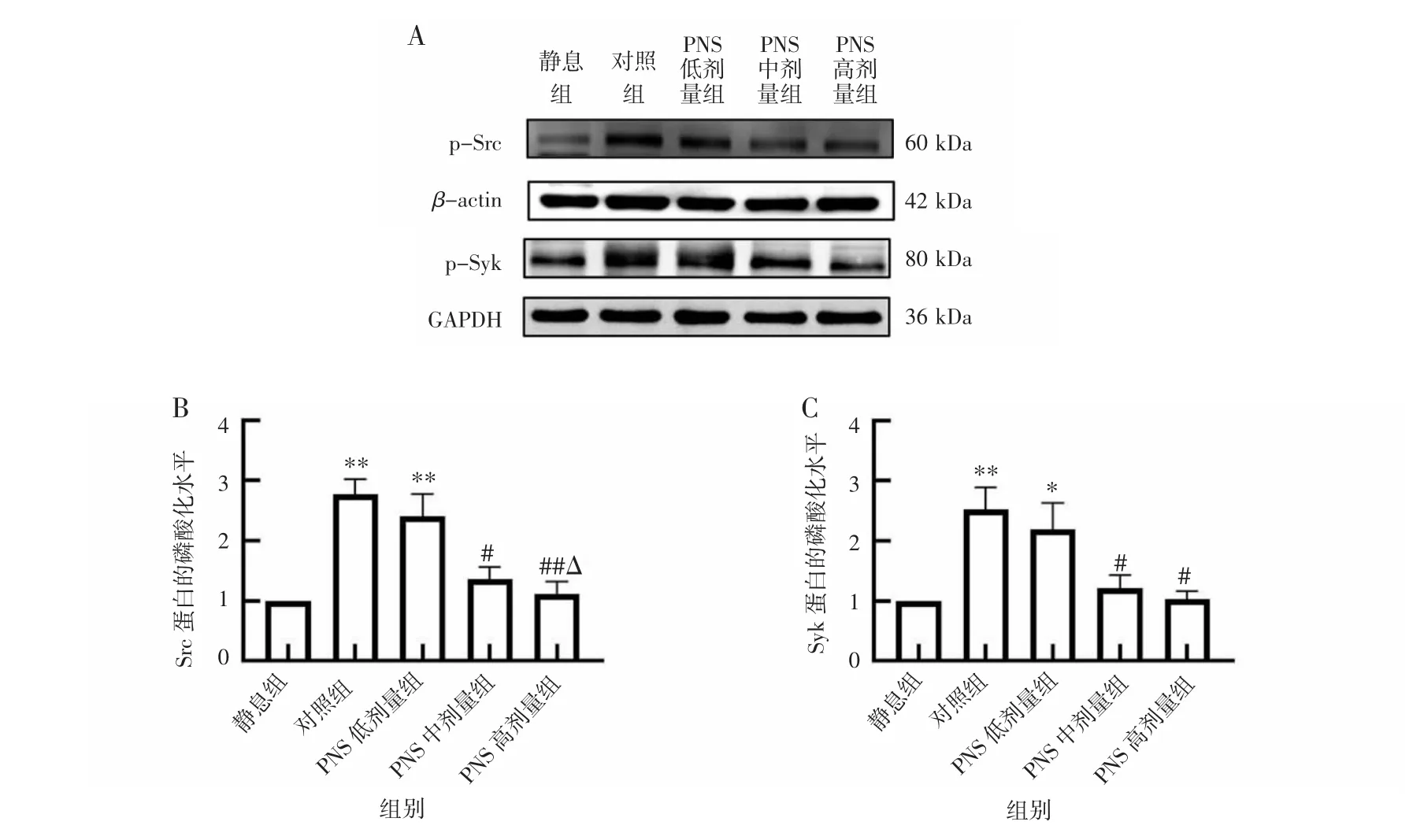
图6 PNS 对ox-LDL 诱导的Src、Syk 蛋白的磷酸化水平的影响
3 讨论
血小板凋亡在CVDs 的发生、发展过程中发挥重要作用。在冠心病、高脂血症等CVDs 中,血小板的凋亡率显著增加〔9,18-19〕。以往的研究〔12〕已经证实,PNS 可通过抑制血小板和内皮细胞的黏附和聚集来发挥防治CVDs 作用。本研究证明PNS 可抑制ox-LDL 诱导的血小板凋亡,提示PNS 在抗血小板凋亡方面具有重要的研究价值,为PNS 防治高脂血症等慢性CVDs 提供重要的实验依据。
动脉粥样硬化血栓形成是导致CVDs 患者死亡的主要原因,高脂血症是诱发CVDs 的重要危险因素之一,循环血液中ox-LDL 通过激活白细胞、内皮细胞和血小板参与高脂血症中动脉粥样硬化血栓形成〔2〕。高脂血症患者循环血液中ox-LDL 可识别并与血小板表面CD36 清道夫受体结合,进而介导胞内多种信号通路发挥提高血小板高反应性的作用,其中Src 家族蛋白激酶、PLCγ2、PKC 以及ERK5在其中起着关键作用〔20〕。研究证实,ox-LDL 与CD36 结合后可激活血小板内Src、Syk、PLCγ2、PKC蛋白,使其发生磷酸化,进一步使NOX2 激活。NOX2 是血小板内介导ROS 生成的关键蛋白,其活化可促进胞内产生大量的ROS,进而使下游的ERK5 发生磷酸化,促使血小板发生凋亡〔5,21〕。本研究证明,PNS 可以抑制ox-LDL 诱导的血小板凋亡以及抑制Src、Syk 蛋白的磷酸化和氧化应激水平,但是PNS 通过Src/Syk/ROS 信号通路抑制血小板凋亡的具体机制以及CD36 在其中的作用尚不明确,仍需进一步深入研究。此外,PNS 调控血小板凋亡是否参与其防治高脂血症中血栓形成也有待在动物模型中进一步验证。
三七中的成分包括皂苷类、黄酮类、固醇类、多炔类、氨基酸类等,其中研究最多的是皂苷类〔10〕。PNS 作为三七的主要药用成分,口服生物利用度低,疗效差,临床上常采用静脉滴注的方式进行给药〔22〕。目前研究证实,PNS 可通过纳米粒子或者与脂质结合提高其在体内的生物利用度〔23〕,在今后的研究中应加强对提高PNS 生物利用度的研究。有研究表明,PNS(1 500 mg/kg)口服后,仅有0.71%的药物进入体循环,药物在体内的峰浓度为19.09 μg/mL。对大鼠进行尾静脉注射50 mg/kg PNS(在体内相当于100 μg/mL),其生物利用度为100%〔22〕。在临床上,采用每天静脉滴注血栓通注射液(主要成分是PNS)500 mg 治疗血栓性疾病,注射后血液中PNS 的最高浓度可达130 μg/mL〔24〕。本体外实验使用的PNS 浓度范围在1~100 μg/mL 之间,而且对ox-LDL 诱导血小板凋亡产生抑制作用的剂量主要是10 μg/mL 和100 μg/mL,该浓度在生理剂量范围之内。总之,本研究为PNS 防治血栓形成,改善高脂血症及其相关慢性代谢性疾病的生理活性提供新的思路,也将进一步牢固确定传统中药在防治CVDs 治疗中的作用和优势。

