高糖上调肺泡上皮细胞大麻素受体1表达加重结核分枝杆菌感染引起的细胞损伤
马庭喜 唐朦
(西安市胸科医院结核合并证科,陕西 西安 710061)
肺结核是由结核分枝杆菌(M.tb)引起的一种慢性消耗性人畜共患传染病,发病后会产生结核结节、钙化灶或者干酪样结节等病理性特征〔1〕。结核病早已成为全世界的公共卫生问题,严重影响并威胁人类身体健康〔2〕。近年来,糖尿病并发肺结核患者数量增长引发学者们探究两者之间的关系。世界卫生组织(WHO)已经确定,糖尿病是肺结核重要且容易被忽视的危险因素〔3〕。大麻素受体(CB)1广泛分布于人体各个系统。CB1在人体很多病理生理调节中发挥重要作用〔4〕。CB1拮抗剂能够降低胰岛素耐受,对糖尿病患者有很好的治疗效果〔5〕。有研究表明,CB1拮抗剂能够通过调节细胞内质网应激减轻高糖诱导的大鼠肾脏系膜细胞损伤〔6〕,在糖尿病肾病中发挥重要作用。但其是否参与糖尿病合并肺结核的病理进程,并没有相关报道。本文通过构建高糖环境下M.tb感染的肺泡上皮细胞损伤模型,探讨CB1对损伤模型细胞生物学的调节作用。
1 材料和方法
1.1材料 人肺泡上皮细胞株A549购自中国科学院上海细胞所。M.tb菌株H37Rv为本实验保存。利莫那班(WIN55212-2)购自英国Tocris公司;DMEM培养基购自美国Hyclone公司;胎牛血清、双抗、胰蛋白酶购自美国Gibco公司;Trizol试剂购自美国Invitrogen公司;反转录试剂盒、SYBR Premix Ex mixture购自日本TaKaRa公司;二喹啉甲酸(BCA)蛋白定量试剂盒购自上海生工生物工程有限公司;兔多克隆抗CB1抗体、鼠单克隆TLR4抗体和兔多克隆MyD88抗体购自美国Abcam公司;电化学发光(ECL)显色剂购自北京中杉金桥生物技术有限公司;肿瘤坏死因子(TNF)-α、白细胞介素(IL)-6、IL-8酶联免疫吸附试验(ELISA)试剂盒,CCK-8检测试剂盒,乳酸脱氢酶(LDH)检测试剂盒均购自江苏凯基生物技术股份有限公司;活性氧(ROS)检测试剂盒购自上海前尘生物科技有限公司。
1.2方法
1.2.1细胞培养和处理 肺泡上皮细胞A549使用含有10%的胎牛血清,100 U/ml青霉素,100 μg/ml链霉素的DMEM完全培养液,于37℃,5%CO2的恒温培养箱中常规培养。2~3 d更换1次新鲜培养基,融合度达到80%~90%时传代培养。取对数生长期A549细胞,按照葡萄糖浓度分为0、5、10、25、50 mmol/L组,按分组处理细胞,置于37℃,5%CO2培养箱中培养24 h后,分别收集细胞培养上清和细胞总蛋白,检测细胞中CB1蛋白表达;另外收集细胞,进行细胞内ROS检测。为了构建高糖环境下M.tb感染的细胞模型,用含有25 mmol/L葡萄糖的DMEM培养基培养细胞24 h后,加入感染复数(MOI)为10的M.tb菌株H37Rv,再置于37 ℃,5%CO2培养箱中孵育12 h,收集细胞,进行后续实验。将A549细胞随机分为高糖(HG)组,高糖M.tb(HG+M.tb)组,CB1激动剂(WIN55212-2)处理(HG+M.tb+WIN)组和拮抗剂(利莫那班)处理(HG+M.tb+LM)组,按分组处理细胞24 h。收集细胞上清、蛋白等进行后续实验。
1.2.2体外细胞菌落形成单位(CFU)检测 高糖作用24 h后,加入M.tb感染12 h,然后收集细胞,检测细菌载量变化,具体方法如下:磷酸盐缓冲液(PBS)清洗细胞2遍,每孔加入0.1 % Triton-x-100水溶液裂解20 min。取裂解液稀释不同浓度进行涂板,检测CFU。3~4 d后观察菌落生长状况并计数。CFU计算方法:CFU/ml=C×10n×20(C:3个培养皿的菌落数均数,n为所计数的培养皿的稀释倍数)。
1.2.3细胞内ROS检测 按照试剂盒说明书,用无血清培养基以1∶1 000稀释DCFH-DA,使其终浓度为10 μmol/L。以H2O2处理组的细胞为阳性对照。按照1∶1 000用无血清培养液稀释DCFH-DA,终浓度为10 μmol/L。去除各组细胞培养液,加入适当体积稀释好的2,7-二氯荧光素二乙酸酯(DCFH-DA),充分盖住细胞,置于37℃,5%CO2培养箱中孵育20 min。用无血清培养液洗涤细胞3次,以充分去除未进入细胞内的DCFH-DA。于激光共聚焦显微镜下观察细胞内绿色荧光情况。
1.2.4Western印迹检测蛋白表达 收集不同葡萄糖浓度处理之后的肺泡上皮A549细胞,提取细胞蛋白,BCA法测定蛋白质浓度。每孔40 μg蛋白质总量进行电泳,转膜、5%牛血清白蛋白(BSA)封闭1 h后,4℃下过夜孵育一抗稀释液。一抗稀释倍数为:CB1(1∶1 000)和β-actin(1∶10 000)。37℃条件下加入相应二抗(1∶1 000)孵育1 h,漂洗后暗室曝光,ECL显色,Quantity One软件分进行灰度值测定。按分组收集CB1激动剂和拮抗剂处理后的A549细胞,按照上述方法检测TLR4和MyD88蛋白表达。
1.2.5实时荧光定量-聚合酶链反应(RT-PCR)检测mRNA表达 将A549细胞按上述方法处理之后,Trizol法提取细胞总RNA,并检测其纯度以及完整性。反转录合成cDNA,以cDNA为模板,进行PCR扩增,2%~3%琼脂糖凝胶上电泳,依据2-ΔΔCt法计算各组mRNA的相对表达量。引物由上海生工生物工程公司合成,序列如下: MyD88正向:5′-GTG TCT GGT CTA TTG CTA GTG-3′, 反向:5′-CCT TGC TCT GCA GGT AAT C-3′。TLR4正向:5′-CCTGGACCTGAGCTTTAATC-3′,反向:5′-CTGGATTTCACACCTGGATAA-3′。
1.2.6CCK-8检测细胞活性 取对数生长期A549细胞,按照1×105个/孔接种于96孔板,各组设定3个平行孔,培养24 h之后,按照上述方法处理各组细胞,培养24 h之后加入10 μl CCK-8溶液,37℃下CO2恒温培养箱中避光孵育3 h。酶标仪检测各孔450 nm波长下的OD值,按照公式计算各孔的细胞活力:样本孔读数=实测数字-空白对照孔的读数,每孔OD值平均值/对照组OD值的比值作为结果进行分析。
1.2.7LDH检测细胞毒性 取对数生长期A549细胞,按照1×105个/孔接种于96孔板,各组设定3个平行孔,培养24 h之后,按照上述方法处理各组细胞,24 h之后将细胞培养板置于多孔板离心机中离心5 min,每孔取0.2 ml上清液进行LDH实验,0.2 ml细胞上清液加50 μl的LDH工作液,室温下避光反应30 min,在490 nm处检测OD值。
1.2.8ELISA检测炎性分子表达 收集经过处理的A549损伤细胞上清液,取出TNF-α、IL-6、IL-8 ELISA检测试剂盒平衡至室温,按照需要适当稀释样品浓度,按照试剂盒操作说明书绘制标准曲线,根据标准曲线计算TNF-α、IL-6、IL-8的最终浓度。
1.2.9流式细胞仪检测细胞凋亡 按分组收集CB1激动剂和拮抗剂处理后的A549细胞,按照膜联蛋白V-异硫氰酸荧光素(Annexin V-FITC)/碘化丙啶(PI)凋亡检测试剂盒的说明步骤进行操作检测细胞凋亡水平。胰蛋白酶加入各组细胞中进行细胞消化,经过离心,收集细胞。PBS清洗2次后重悬细胞,加入Annexin V-FITC和PI,室温避光孵育15 min之后流式细胞仪检测细胞凋亡水平。
1.2.10试剂盒检测含半胱氨酸的天冬氨酸蛋白水解酶(Caspases)水平 按分组收集CB1激动剂和拮抗剂处理后的A549细胞,用不含乙二胺四乙酸(EDTA)的胰酶消化并收集细胞,PBS洗涤细胞2次,1 000 r/min离心5 min,去除上清,加入裂解缓冲液(北京索莱宝科技有限公司)吹打均匀,在冰上裂解10 min。4℃下,10 000 r/min离心5 min收集上清液(胞质提取液)并分装转移至1.5 ml离心管中,BCA蛋白定量法检测蛋白浓度;加入含有二硫苏糖醇(DTT)的反应缓冲液,加入pNA标记的蛋白酶底物,于37℃下避光孵育3 h。酶标仪405 nm处检测吸光度值(A405),Caspase3/9活化水平以实验组A405值与对照组A405值的比值来表示。
1.3统计学方法 采用SPSS17.0软件进行单因素方差分析、SNK-q检验。
2 结 果
2.1高糖环境下肺泡上皮细胞中CB1表达 低浓度葡萄糖处理组细胞内ROS水平较低。随着葡萄糖浓度的升高,绿色荧光阳性细胞数及细胞内荧光强度均增加,说明高浓度葡萄糖处理对A549细胞的损伤加重(图1)。随着葡萄糖浓度的升高,细胞中CB1蛋白表达逐渐上升,0、5、10、25、50 nmol/L组CB1蛋白灰度值分别为(1.00±0.09、1.17±0.08、1.49±0.04、2.09±0.12、2.57±0.07)在葡萄糖浓度达到10 nmol/L起,细胞中CB1表达即与正常环境中的表达存在显著性差异(P<0.05)。见图2。提示CB1可能参与高糖环境对肺泡上皮细胞A549的损伤。

图1 不同浓度葡萄糖处理的肺泡上皮细胞系A549中ROS水平(×100)
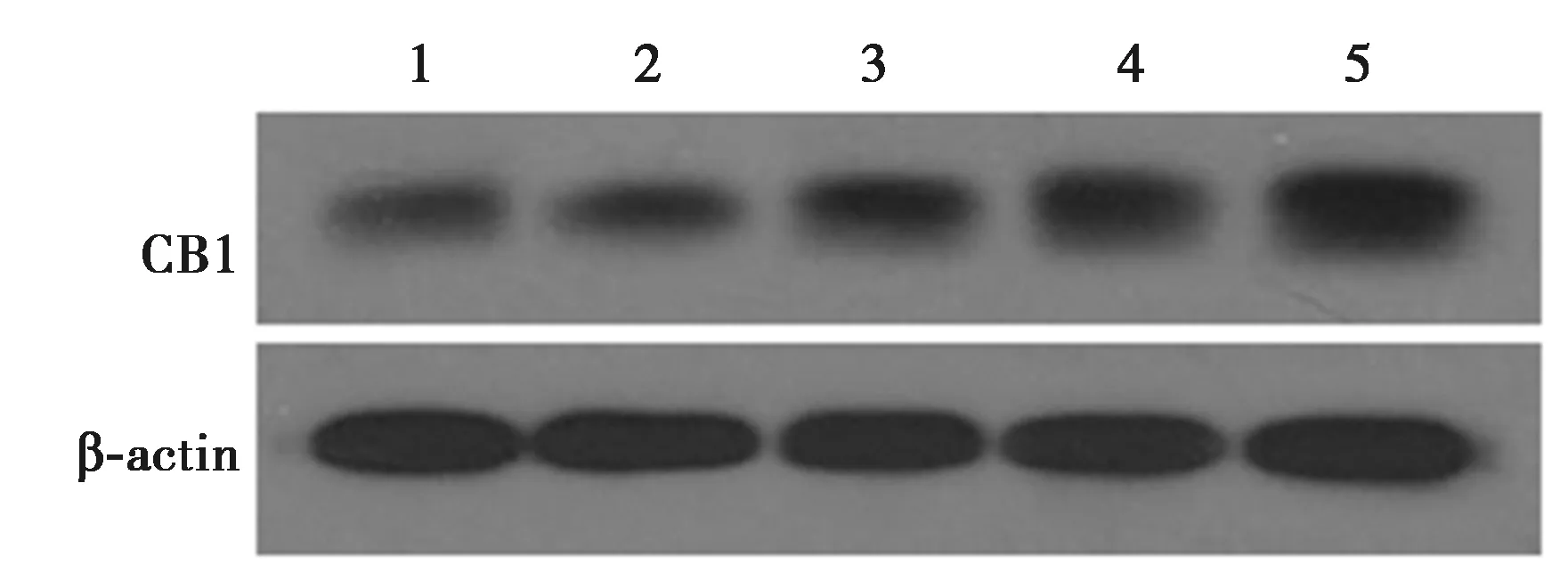
1~5:0 nmol/L组,5 nmol/L组,10 nmol/L组,25 nmol/L组,50 nmol/L组图2 Western印迹检测各组细胞中CB1蛋白表达
2.2高糖环境下M.tb感染对肺泡上皮细胞的损伤 将A549细胞在25 nmol/L葡萄糖浓度下培养,随后用M.tb感染构建高糖环境下的细胞结核分枝杆菌感染模型。感染12 h后,与M.tb组相比,HG+M.tb组细菌存活率明显降低(P<0.05)。CCK-8结果显示,与NC组相比,HG组和M.tb组细胞活性均显著降低(P<0.05);而HG+M.tb细胞活性较HG组、M.tb组显著降低(P<0.05)。与NC组相比,HG组、M.tb组、HG+M.tb组LDH释放显著增加,且HG+M.tb组LDH释放显著高于HG组及M.tb组(P<0.05)。ELISA检测结果显示,与NC相比,HG组及M.tb组细胞分泌炎性因子TNF-α、IL-6和IL-8水平均显著升高(P<0.05);与HG组及M.tb组相比,HG+M.tb组细胞炎性因子水平也显著升高(P<0.05)。提示高糖合并M.tb感染处理细胞显著降低了A549细胞活性及细菌存活率,并提高了细胞炎性因子的分泌水平。见图3、表1。
图3 高糖环境下M.tb感染后A549细胞形态观察(×100)

表1 高糖环境下M.tb感染后A549细胞活性及分泌的炎性因子水平比较
2.3高糖环境下CB1对M.tb感染的肺泡上皮细胞活性和凋亡的影响 构建高糖环境下M.tb感染肺泡上皮细胞损伤的模型之后,用CB1激动剂(WIN)或拮抗剂(LM)处理细胞,CCK-8结果显示,CB1激动剂处理之后,损伤细胞活性显著降低,LDH释放量显著升高,细胞凋亡率显著升高,线粒体凋亡因子Caspase-3/9水平显著升高(P<0.05);而CB1拮抗剂处理之后,损伤细胞的细胞活性明显升高,LDH释放明显降低,细胞凋亡率显著升高,细胞凋亡率则显著降低,Caspase-3/9水平显著降低(P<0.05)。见图4、表2。提示高糖环境下造成肺泡上皮细胞的损伤,合并M.tb感染后,细胞损伤加重,细胞活力降低更为明显,细胞凋亡率更高。CB1激动剂(WIN)对高糖环境合并M.tb感染造成的细胞损伤有促进作用;而CB1拮抗剂(LM)处理能缓解高糖环境合并M.tb感染对细胞的损伤。
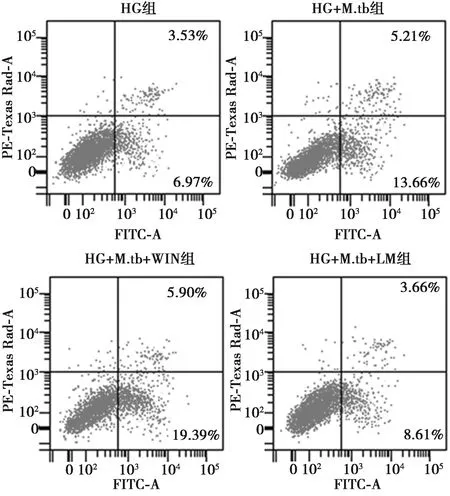
图4 CB1对高糖环境下M.tb感染之后A549细胞凋亡水平的影响

表2 CB1对高糖环境下M.tb感染之后A549细胞活性及凋亡水平的影响
2.4高糖环境下CB1对M.tb感染的肺泡上皮细胞中TLR通路及炎性分子的调节 CB1激动剂处理损伤细胞模型后,细胞中炎症反应通路TLR相关分子TLR4、髓样分化因子(MyD88)蛋白及mRNA表达显著上升,炎性因子TNF-α、IL-6和IL-8水平显著上升(P<0.05);而CB1拮抗剂处理后,细胞中TLR4和MyD88蛋白及mRNA表达明显降低,炎性因子TNF-α、IL-6和IL-8水平,明显降低(均P<0.05)。见图4、表3。提示CB1能够促进高糖环境合并M.tb感染下肺泡上皮细胞TLR炎症通路的反应及细胞炎性因子TNF-α、IL-6和IL-8水平。

1~4:HG组、HG+M.tb组、HG+M.tb+WIN组、HG+M.tb+LM组图4 CB1对高糖环境下M.tb感染之后A549细胞中TLR4通路的影响

表3 CB1对高糖环境下M.tb感染之后A549细胞TLR4通路及炎性因子水平的影响
3 讨 论
糖尿病合并肺结核患者主要由于营养代谢障碍、机体免疫力低下,容易被各种病原体感染。据报道,糖尿病患者肺结核的概率是正常人群的2~4倍,且两者之间相互影响。肺泡Ⅱ型上皮是细胞M.tb由呼吸道吸入之后最先侵染的肺部细胞。研究表明,作为肺脏细胞重要组成的肺泡Ⅱ型上皮细胞是M.tb感染的主要靶细胞,也是机体抗M.tb感染的第一道防线〔7〕。
CB包括CB1和CB2,主要分布于脑部、脊髓及外周神经系统中。其中CB1主要存在于中枢神经系统,CB2主要分布于外周组织〔8〕。研究表明,CB1在2型糖尿病小鼠体内诱导浸润胰岛的巨噬细胞的炎症反应,表明CB1信号通路发挥促进糖尿病进展的作用〔9〕。另外,足细胞中CB1受体过表达加重了糖尿病肾病的病理进程〔10〕。本研究提示CB1可能参与高糖处理对A549细胞的损伤作用。本研究成功建立了研究糖尿病合并肺结核的体外细胞模型。但与文献报道不同,本研究发现,高糖A549细胞24 h后,M.tb感染合并处理12 h,A549细胞活性即出现明显下降。而Fine-Coulson等〔7〕报道显示M.tb单独感染48 h后,细胞的线粒体组成及分布出现显著变化。处理时间的差异可能是由于高糖预处理使A549细胞对M.tb感染更敏感。研究表明,CB1拮抗剂能改善脂质代谢从而减轻肥胖〔11〕,而其在胰岛细胞中的缺乏能够保护高糖诱导的胰岛功能障碍和炎性损伤〔12〕。提示CB1在糖尿病及糖尿病并发症的过程中发挥积极的作用。将CB1激动剂或拮抗剂作用于高糖环境下结核分枝杆菌感染的A549细胞,结果表明CB1拮抗剂减轻了高糖环境下M.tb感染造成的细胞活性和凋亡的损伤。
TLRs是生物机体内一类中药的先天性模式识别受体,广泛分布于心肌细胞、脂肪细胞、血管内皮细胞、树突细胞、免疫T细胞等表面。TLRs介导的信号通路中,研究最多的是由TLR2和TLR4介导的通路,可分为MyD88依赖性和MyD88非依赖性的转导途径〔13〕。有研究发现,小鼠体内敲除TLR2之后,在感染M.tb后体内固有免疫应答和适应性免疫应答反应受损。而TLR4突变的小鼠与野生型的小鼠比较,前者更易感染M.tb,并出现炎症增强、粒细胞增多等特征〔14〕,说明TLR4在M.tb感染细胞过程中起防御作用。研究表明,对M.tb感染诱导的TLR4/Myd88通路的调控,是肺结核的临床治疗的新方向〔15,16〕。本研究结果显示,高糖环境下M.tb感染A549细胞之后,细胞中TLR4和MyD88表达及炎性因子水平显著上升,而CB1拮抗剂作用之后降低了其表达水平。TLRs作为微生物产生的信号转导器,在免疫系统中产生局部变化,参与调节细胞及组织敏感性。本研究发现CB1拮抗剂能减轻了细胞模型中的TLR4炎症通路反应,而CB1激动剂则抑制TLR4炎症通路反应。CB1可能通过调节TLR通路,进一步影响A549细胞对M.tb的敏感性。但对于CB1如何影响TLR4信号通路,目前缺乏相关报道,有待进一步研究。
综上,高糖可以促进肺泡上皮细胞表面CB1表达上调,从而增加了对M.tb感染后细胞损伤的易感性,其中与肺泡上皮细胞内TLR4介导的炎症反应通路活化相关,而使用CB1抑制剂则可以明显改善肺泡上皮细胞损伤则进一步证明了CB1信号通路活化可能是造成M.tb感染后细胞损伤的机制之一。

