高效液相色谱法同时测定天龙泉-陶藏酒中12种活性成分
张 龙,郝俊光,杨金海,万瑞杰,梁振荣,叶静萱,黎 婷,梁婷钰
(1.北部湾大学 食品工程学院 钦州市食品风味分析与调控重点实验室,广西 钦州 535011;2.广西天龙泉酒业有限公司,广西河池 546400;3.北部湾大学 食品工程学院 广西高校北部湾海产品高值化利用与预制食品重点实验室,广西 钦州 535011;4.罗城仫佬族自治县科技情报研究所,广西 河池 546400)
随着消费者健康意识的提高,饮酒观念发生了转变,传统白酒的转型迫在眉睫,营养型白酒在市场上开始兴起[1-2]。营养型白酒是在传统白酒中适量添加了富含活性成分的草本药材提取物,酒体微黄,使消费者在享受传统白酒的同时又能摄入健康因子[3-4]。市售保健酒草药味浓烈,使消费者感官体验不佳;而营养型白酒却与之不同,其风味接近于传统白酒,因此深受消费者喜爱,如劲酒集团的毛铺苦荞酒[14-16]。天龙泉-陶藏酒,是以米香型白酒为基酒,辅以添加广西富产的葛根、罗汉果、苦荞麦提取物的一款新产品,一上市就受到消费者的追捧。
葛根是传统的药食同源植物,含有葛根素、大豆苷等活性成分[5];苦荞麦和罗汉果具有较高药用价值,含有芦丁、槲皮素、表儿茶素、罗汉果苷IV、罗汉果苷V等活性成分[6-8]。不同的活性成分在人体内发挥不同的保健功效,如大豆苷能抗氧化、抗癌等[9];葛根素能降低血糖血脂等[10],芦丁具有抗癌、抗炎等功效[11];儿茶素、表儿茶素能清除自由基等[12],罗汉果苷V具有保肝、抗癌等作用[13]。目前常见测定活性成分的方法有光谱法[17],高效液相色谱(high performance liquid chromatography,HPLC)法[18]、超高效液相色谱-串联质谱(ultra-high performance liquid chromatography-tandem mass spectrometry,HPLC-MS/MS)法[19]等。光学分析法常用于测定总酚含量,无法检测单一组分含量;超高液相色谱-串联质谱法灵敏度高但仪器昂贵、运行维护成本高;高效液相色谱法测定活性成分在国内外应用较为广泛,在单独检测葛根、苦荞麦、罗汉果的组成方面已有报道,如AMAKURA Y等[20]借助HPLC准确测罗汉果提取物罗汉果苷V的含量,QU L M等[21]利用HPLC测定葛根中的葛根素等六种异黄酮,MANSUR A R等[22]通过HPLC测定苦荞麦中的黄酮类物质。高效液相色谱法能同时测定多种单体活性成分含量,具有操作简单等优点,适用于工厂自行检测,但目前尚无同时检测天龙泉-陶藏酒中葛根、苦荞麦、罗汉果提取物活性成分的方法。
本研究通过对天龙泉-陶藏酒中12种活性成分的HPLC检测条件进行优化,建立了HPLC同时测定天龙泉-陶藏酒中12种活性成分的检测方法,并将其应用于天龙泉-陶藏酒样品的检测,以期为天龙泉-陶藏酒功能成分提供有效的检测手段,为天龙泉-陶藏酒的品质控制提供技术支持。
1 材料与方法
1.1 材料与试剂
1.1.1 原料
天龙泉-陶藏酒3A酒样(酒精度为30%vol,添加了葛根、苦荞麦提取物)、天龙泉-陶藏酒4A酒样(酒精度为33%vol,添加了苦荞麦提取物)、天龙泉-陶藏酒5A酒样(酒精度为42%vol,添加了罗汉果、葛根提取物):广西天龙泉酒业有限公司。
1.1.2 试剂
乙腈、甲醇、乙醇(均为色谱纯):上海麦克林生化科技公司;槲皮素、大豆苷、山奈酚、芦丁、葛根素、异槲皮苷、儿茶素、表儿茶素、槲皮苷、山奈酚-3-O-芸香糖苷、罗汉果苷IV、罗汉果苷V标准品(纯度均>98%):四川维克奇生物科技有限公司。其他试剂均为国产分析纯。
1.2 仪器与设备
Alliance 高效液相色谱仪(配备2695分离单元、2996光电二极管阵列(photo-diode array,PDA)检测器、Empower工作站):美国Waters仪器公司;ME204E电子分析天平:梅特勒-托利多仪器(上海)有限公司;DK-98-II恒温水浴锅:天津市泰斯特仪器有限公司;Waters-AtlantisT3色谱柱(4.6 mm×250 mm,5 μm)、SLGP 033RB针头滤膜(0.22 μm):美国Millipore公司;XW-80A旋涡混合器:常州万科仪器有限公司。
1.3 方法
1.3.1 标准溶液的配制
单个标准工作溶液配制:称取适量标准品于10 mL容量瓶,用热乙醇(45 ℃)溶解芦丁、槲皮素、山奈酚后定容,得到质量浓度为100 mg/L单标溶液;用体积分数为80%甲醇溶解葛根素、大豆苷、儿茶素、表儿茶素、异槲皮苷、山奈酚-3-O-芸香糖苷、槲皮苷、罗汉果苷IV、罗汉果苷V后定容,得到质量浓度为100 mg/L单标溶液。
混合标准工作液的配制:适量称取各物质标准品用甲醇溶解后得到质量浓度范围为8 000~17 000 mg/L的单标母液,再吸取适量母液,置于10 mL容量瓶中用甲醇定容混匀,制得质量浓度为1 200 mg/L的混合标准储备液。吸取0.064 mL混合标准储备液置于10 mL容量瓶中,用体积分数为80%甲醇定容,得到质量浓度为7.68 mg/L的混合标准工作液用于色谱条件的优化。
1.3.2 高效液相色谱条件
根据保留时间进行定性,采用外标法进行定量。
1.3.3 高效液相色谱条件优化
(1)波长的确定
对各活性成分进行二级管阵列扫描(190~400 nm),得到各标准物质的光谱图,确定测定波长,于选定检测波长分离优化混合标样,以达到最佳效果。
(2)洗脱梯度的确定
本试验共进行了30余次梯度优化,仅选择4个有代表性的梯度说明优化效果,具体洗脱梯度见表1。选取各目标物完全分离、检测周期短的洗脱梯度作为最优色谱条件。通过改变洗脱条件,实现不同活性物质的有效分离,达到两种相邻的目标活性物质分离度≥1.5,分离度的计算公式见式(1)[23]。

表1 洗脱梯度的优化Table 1 Optimization of eluent gradients
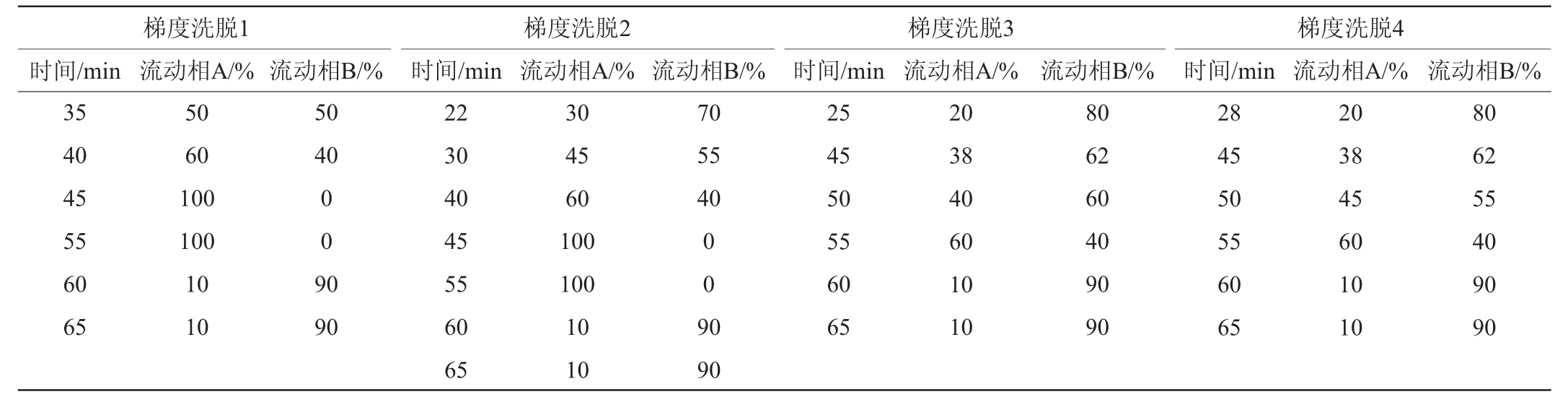
续表
式中:tR1为相邻色谱峰前-峰的保留时间;tR2为相邻色谱峰后-峰的保留时间;Y1、Y2为相邻两色谱峰的峰宽。
1.3.4 方法学考察
(1)标准曲线的建立
适量吸取1.3.1单标母液置于10 mL容量瓶中配制得到含2 500 mg/L的葛根素、大豆苷、槲皮苷、槲皮素、山奈酚,5 000 mg/L山奈酚-3-O-芸香糖苷、罗汉果苷V、罗汉果苷IV、表儿茶素、儿茶素,3 750 mg/L芦丁、异槲皮苷的混合标准储备液,分别吸取混合标准储备液0.008 mL、0.001 6 mL、0.032 mL、0.064 mL、0.128 mL、0.256 mL置于10 mL容量瓶中用80%甲醇定容,得到6个质量浓度梯度的混合标样,见表2,于优化色谱条件下按质量浓度由低到高的顺序上机检测。以混合标样各组分的质量浓度(x)为横坐标,对应峰面积(y)为纵坐标建立标准曲线。
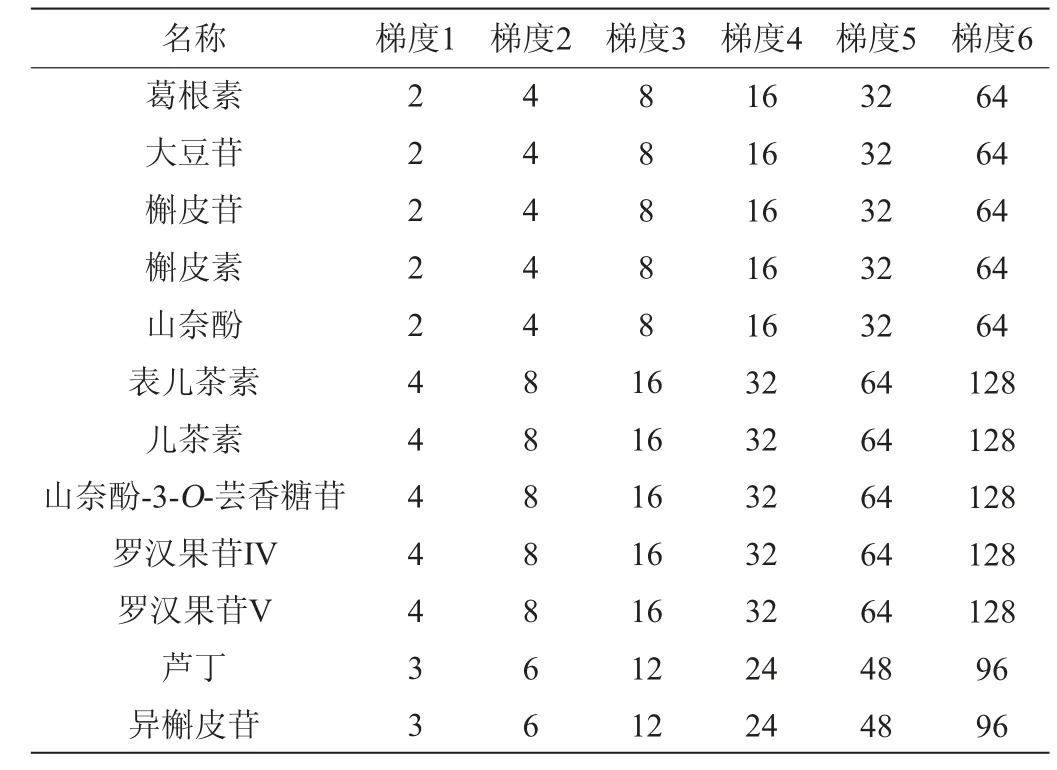
表2 混合标样质量浓度梯度Table 2 Mass concentration gradient of mixed standard solution mg/L
(2)检出限和定量限
将混合标样梯度1逐步稀释检测,把信噪比(signalnoise ratio,S/N)分别为3和10所对应分析物的质量浓度作为方法的检出限(limit of detection,LOD)和定量限(limit of quantification,LOQ)。
(3)精密度试验
精确吸取天龙泉-陶藏酒3A样品0.5 mL,加入混合标样梯度三,均匀混合后过0.22 μm针头滤膜,重复进样6次,记录峰面积,计算12种活性成分各自的质量浓度及其对应的相对标准偏差(relative standard deviation,RSD),确定方法的精密度。
(4)加标回收率试验
精确吸取3份天龙泉-陶藏酒3A样品0.5 mL,分别加入质量浓度为2 mg/L、4 mg/L、6 mg/L 的混合标样0.5 mL,均匀混合过0.22 μm针头滤膜后进样,每个浓度3个平行,计算加标回收率,确定方法的准确度。加标回收率计算公式如式(2):
1.3.5 数据处理
使用Microsoft Excel 2016软件对数据进行处理,样品数据以“平均值±标准差”表示。
2 结果与分析
2.1 高效液相色谱条件的确定
2.1.1 检测波长的确定
本试验采用PDA检测器对混合标样梯度三进行紫外二极管阵列扫描,结果见图1。

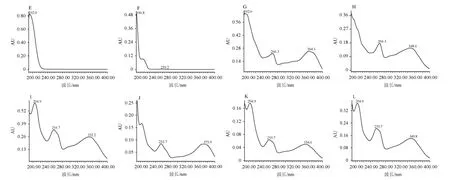
图1 12种活性成分混合标样于全波长(190~400 nm)处的HPLC光电二极管阵列光谱图Fig.1 HPLC photodiode array spectrograms of 12 active components mixed standard solution at full-wavelength (190-400 nm)
由图1可知,表儿茶素、大豆苷、儿茶素、葛根素、罗汉果苷IV、罗汉果苷V、山奈酚、山奈酚-3-O-芸香糖苷、异槲皮苷、槲皮素、芦丁及槲皮苷对应的最大吸收波长分别为203 nm、192 nm、207 nm、194 nm、192 nm、190 nm、192 nm、266 nm、204 nm、255 nm、204 nm及204 nm。为简化定量过程,在保证各组分检测灵敏的前提下,因12种活性成分在波长203 nm处均有吸收,故选择定性检测波长为203 nm。
2.1.2 洗脱梯度的确定
对混合标样进行四个典型梯度的洗脱,其洗脱效果见图2。

图2 12种活性成分混合标样于波长203 nm处的HPLC色谱图Fig.2 HPLC chromatograms of 12 active components mixed standard solution at 203 nm
由图2A可知,采用梯度一进行洗脱,各标准品出峰时间过于集中,表儿茶素(峰2)与儿茶素(峰3)未见分离,与HPLC测定葡萄酒中表儿茶素、儿茶素等9种酚类物质的结果相同[24],且该洗脱条件下异槲皮苷(峰6)与山奈酚-3-O-芸香糖苷(峰7)未完全分离;由图2B可知,采用梯度二洗脱,异槲皮苷(峰6)与山奈酚-3-O-芸香糖苷(峰7)已分离,分离度为1.54,但其他物质分离效果不理想,且芦丁(峰5)前存在杂峰(峰a);由图2C可知,采用梯度三洗脱,表儿茶素(峰2)、儿茶素(峰3)分离效果仍不理想,分离度仅为1.23,基于洗脱梯度二条件下调整后发现芦丁(峰5)与杂质(峰a)融合;经多次调整洗脱梯度,表儿茶素、儿茶素达不到有效分离,且测定目标活性成分芦丁与杂质峰融合,因此需进一步优化洗脱梯度,参考测定华佗延寿酒中表儿茶素、儿茶素素等成分的洗脱条件[25],对试验洗脱梯度进行调整,由图2D可知,采用梯度四洗脱,表儿茶素(峰2)、儿茶素(峰3)分离度达到1.56,同时该梯度条件下,芦丁(峰5)与杂质峰完全分离。通过对测定梯度的优化,采用洗脱梯度四洗脱,各活性成分峰形好、12种测定的目标成分分离度高,满足分析要求,最终确定梯度四为最优洗脱梯度,用于后续的定性定量分析。
2.2 12种活性成分的定性和定量
在上述优化条件的基础上,于203 nm波长下检测混合标准样品,其HPLC色谱图见图3,保留时间见表3。
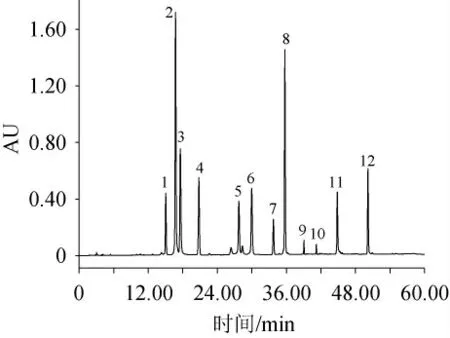
图3 12种活性成分混合标样在203 nm检测波长条件下HPLC色谱图Fig.3 HPLC chromatogram of 12 active components mixed standard under detected wavelength 203 nm condition
由图3可知,在优化后色谱条件下,各活性成分峰形好、各相邻的成分完全分离,即分离度均>1.5[23]。
2.3 方法学考察
优化色谱条件下测定混合标样,以每种物质最大吸收波长处测定得到的色谱峰面积(Y)为纵坐标,质量浓度(X)为横坐标,建立12种活性成分的标准曲线,获得12种活性成分的标准曲线回归方程,进行方法学验证。确定保留时间、线性回归方程、线性范围、相关系数、检出限及定量限,结果见表3。由表3可知,各活性成分呈现良好的线性关系,相关系数R2为0.993~0.999,方法检出限为0.018~0.210 mg/L,定量限为0.062~0.701 mg/L。
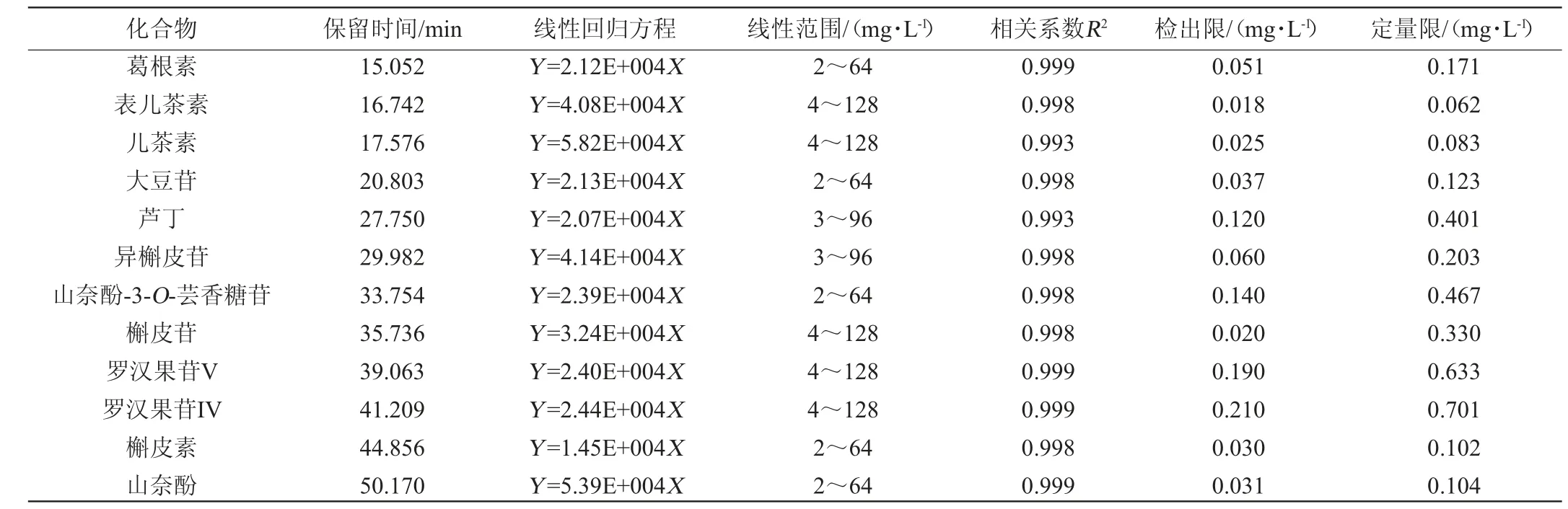
表3 12种活性成分的保留时间、线性回归方程、线性范围、相关系数、检出限及定量限Table 3 Retention time,linear regression equation,linear range,correlation coefficient,detection limit and quantification limit of 12 active components
方法精密度试验结果见表4。由表4可知,精密度试验结果相对标准偏差(RSD)为1.11%~4.28%,说明该方法的精密度较高。
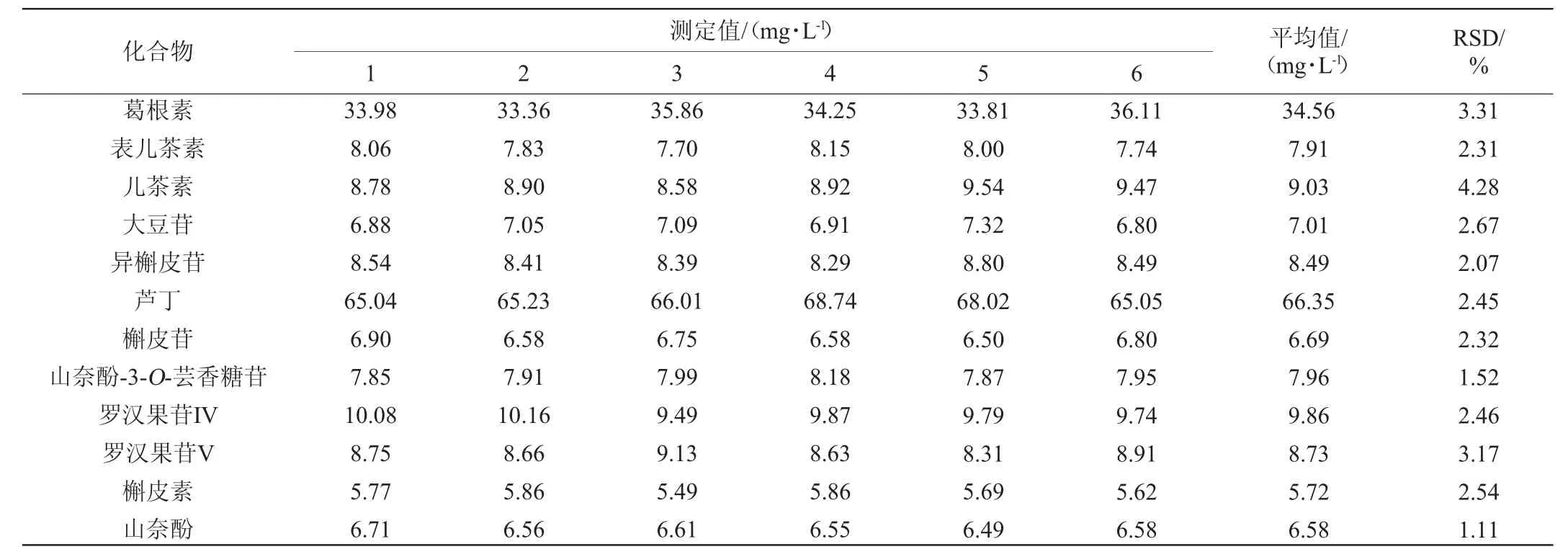
表4 精密度试验结果Table 4 Results of precision tests
方法加标回收率试验结果见表5。由表5可知,平均加标回收率为89.6%~118.1%,回收率试验结果的相对标准偏差(RSD)为1.00%~4.53%,表明该方法准确度良好,能满足分析要求。
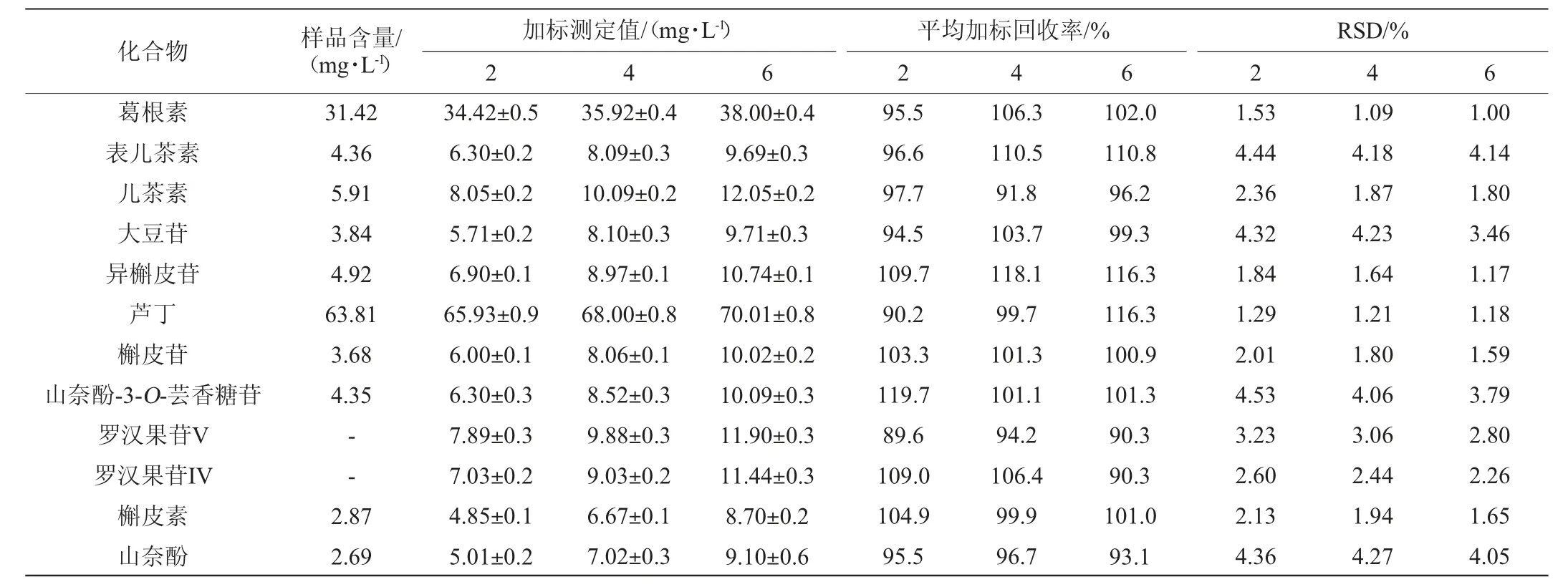
表5 加标回收率试验结果Table 5 Results of standard recovery rate tests
2.4 天龙泉-陶藏酒样品中12种活性成分的检测结果
采用上述优化色谱条件检测天龙泉-陶藏酒3款产品中12种活性成分,结果见表6。由表6可知,天龙泉-陶藏酒3A、4A芦丁含量较高,其对应的含量测定值均>30 mg/L,陶藏酒5A中含有较多的葛根素,测定值≥14 mg/L,且陶藏酒5A中特有的两种活性成分罗汉果苷IV、罗汉果苷V的含量分别约为4 mg/L、5 mg/L。实际测得的成分与产品生产中所添加的提取物情况相符,因此该方法适用于测定天龙泉-陶藏酒。

表6 天龙泉-陶藏酒样品测定结果Table 6 Determination results of Tianlongquan Taocang Baijiu sample
3 结论
本研究建立了同时测定天龙泉-陶藏酒中12种活性成分的高效液相色谱方法,通过对试验条件的优化,采用Waters AtlantisT3色谱柱(4.6 mm×25 mm,5 μm),流动相:乙腈-水溶液,梯度洗脱,流速1.0 mL/min,进样量5 μL,柱温32 ℃,检测波长203 nm,保留时间定性,外标法定量。在此优化检测条件下,其精密度试验结果相对标准偏差(RSD)为1.11%~4.28%,平均加标回收率为89.6%~119.7%,方法的检出限为0.018~0.210 mg/L,定量限为0.062~0.701 mg/L。该方法线性良好、检出限低、精密度和准确度良好,操作简单,能满足对天龙泉-陶藏酒12种活性成分含量的日常监控。

