乳酸菌发酵对枸杞果汁体外抗氧化和抗炎活性的影响
张金兰,魏 巍,杨 云,鲁 绯
(1.北京市营养源研究所有限公司,北京 100069;2.北京市科学技术研究院,北京 100089;3.中国农业大学 食品科学与营养工程学院,北京 100083)
枸杞(Lycium chinense)属于茄科植物,通常分布在亚洲,尤其是中国的西北地区。枸杞的果实,通常被称为枸杞或枸杞子。我国的商品枸杞主要产自宁夏、新疆、甘肃、青海和内蒙古,每年生产干果25 000~30 000 t[1]。枸杞具有极高的食用价值,因其抗氧化、抗衰老、抗糖尿病、抗癌、调节免疫等功能而成为超级食物[2]。枸杞被广泛用于中餐烹饪和草药茶中,并被用于生产果汁、糖果、果酒等。在各种枸杞产品中,枸杞果汁是最受欢迎的产品之一,既能保持高营养价值,又能延长保质期。枸杞果汁的部分感官特征,如糖酸比过高导致甜味不协调,降低了消费者的购买意愿[3]。有必要采用新的加工技术来优化枸杞果汁的品质,丰富其产品种类并提高健康功效[4]。
乳酸菌作为益生菌或功能发酵剂广泛应用于食品饮料行业。乳酸菌发酵可以保持和/或改善原料的营养和感官特性,并延长产品的货架期[5]。近年来,由于素食主义、乳糖不耐受、牛奶蛋白过敏和高胆固醇风险等消费者的增加,对非乳制品发酵产品的需求急剧上升[6]。水果富含糖、有机酸和酚类、纤维素等成分,是乳酸菌发酵的理想基质。研究表明,发酵果汁表现出更强的功能特性。鼠李糖乳杆菌(Lactobacillus rhamnosus)GG和植物乳杆菌(L.plantarum)-1发酵的蓝莓果渣可以提高其抗氧化活性和胆固醇清除率[7]。植物乳杆菌Lp-115TM发酵的桑椹汁可显著提高自由基清除能力,花青素和黄酮醇与2,2'-联氮双(3-乙基-苯并噻唑-6-磺酸)二铵盐(2,2'-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid)diammonium salt,ABTS)清除能力提高相关,酚酸和黄酮醇与1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)清除能力和还原力提高相关[8]。植物乳杆菌(L.plantarum)NCU116发酵胡萝卜汁具有血糖、血脂与氧化应激的调节能力,同时提高了结肠中短链脂肪酸水平,具有缓解糖尿病症状的功能[9]。ZHOU C等[10]通过植物乳杆菌(L.plantarum)C17和戊糖乳杆菌Lp-B(L.pentosus)Lp-B共发酵得到富含γ-氨基丁酸的柿子汁,具有潜在的抗宿醉和降血压功能特性。CATALDO P等[11]用短乳杆菌(L.brevis)CRL 2013作为发酵剂发酵草莓汁获得高活性的发酵果汁,在Toll样受体4(toll-like receptors 4,TLR4)激活的情况下,发酵草莓汁可调节脂多糖(lipopolysaccharide,LPS)刺激的RAW264.7巨噬细胞中环氧化酶-2(cyclooxygenase-2,Cox-2)表达,并在体内发挥显著的抗炎作用。与未发酵的石榴汁相比,AKTER R等[12]证实,来源于大胡蜂消化道的乳杆菌(L.vespulae)DCY75发酵后石榴汁剂量依赖性地减少一氧化氮(NO)生成和抑制诱导型一氧化氮合酶(inductible nitric oxide synthase,iNOS),具有更好的抗炎活性。
不同的乳酸菌菌株对不同的食物基质具有菌株特异性。本研究前期从商业直投式发酵剂中筛选得到适合枸杞果汁发酵的发酵剂-鼠李糖乳杆菌(Lactobacillus rhamnosus)LGG。在此基础上,采用DPPH·、ABTS·+和铁离子还原法(ferric ion reducing antioxidant power,FRAP)法研究枸杞果汁在发酵后的体外抗氧化活性、过氧化氢(H2O2)损伤的结肠癌细胞Caco-2评价抗氧化活性、LPS处理的巨噬细胞RAW264.7评价抗炎活性,为发酵枸杞果汁的功能特性提供基础数据,有助于枸杞在食品工业中得到更广泛的应用。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
枸杞果汁(可溶性固形物21.1%,总糖(以葡萄糖计)5.9%,总酸(以柠檬酸计)0.68%):青海康普生物科技股份有限公司。
1.1.2 菌株与细胞
鼠李糖乳杆菌(L.rhamnosus)LGG直投式发酵剂:科·汉森有限公司;巨噬细胞RAW264.7、结肠癌细胞Caco-2:中国医学科学院基础医学研究所基础医学细胞中心。
1.1.3 试剂
氢氧化钠、无水乙醇、过氧化氢、甲醇、醋酸钠、冰乙酸、盐酸、氯化铁(均为分析纯):国药集团化学试剂有限公司;DPPH、2,4,6-三(2-吡啶)-1,3,5-三嗪(2,4,6-tripyridin-2-yl-1,3,5-triazine,TPTZ)、脂多糖(LPS)(均为分析纯):上海麦克林生化科技有限公司;ABTS+自由基清除能力测定试剂盒、6-羟基-2,5,7,8-四甲基色烷-2-羧酸(6-hydroxy-2,5,7,8-tetramethylchroman-2-carboxylic acid,Trolox):美国Sigma公司;胎牛血清、胰蛋白酶、双抗:赛默飞世尔科技(中国)有限公司;磷酸盐缓冲液(phosphate buffer saline,PBS)(pH 7.2)、细胞计数试剂盒(cell counting kit 8 CCK-8)、细胞因子测定试剂盒:南京建成生物工程研究所。
1.1.4 培养基
Dulbecco改良Eagle培养基(Dulbecco's modification of Eagle's medium,DMEM)、洛斯维·帕克纪念研究所1640培养基(Roswell Park Memorial Institute medium 1640,RMPI 1640):默飞世尔科技(中国)有限公司。
1.2 仪器与设备
FE28台式pH计:梅特勒-托利多仪器(上海)有限公司;MCO-15M二氧化碳培养箱:三洋电机株式会社;iMark酶标仪:美国BIO-RAD公司;HH-2恒温水浴锅:上海力辰邦西仪器科技有限公司;E-5298A旋转蒸发仪:上海亚荣生化仪器厂;3K15冷冻离心机:美国Sigma公司;HWS-250Y电热恒温培养箱:上海精宏实验设备有限公司。
1.3 方法
1.3.1 枸杞果汁发酵
在无菌条件下,将枸杞果汁(300 mL)装入500 mL螺旋盖透明玻璃瓶中。在无菌室中进行接种试验,所用菌种是鼠李糖乳杆菌LGG直投式发酵剂,根据前期预实验感官评价结果,确定发酵条件为:接种量0.05%,发酵温度30 ℃,发酵时间8 h,发酵结束后置于-20 ℃保存待用。以未发酵的枸杞果汁相同处理作为对照。
1.3.2 枸杞果汁和枸杞发酵果汁提取物制备
枸杞果汁和枸杞发酵果汁水提物的制备[13]:50 mL枸杞果汁或枸杞发酵果汁加入NaOH调节pH至7.0,在70 ℃水浴中加热提取2 h,然后将枸杞果汁离心(4 ℃、3 000×g,15 min),取上清液,提取过程重复3次,55 ℃条件下旋转蒸发仪浓缩至50 mL,用0.45 μm的膜过滤,保存于-20 ℃备用,枸杞果汁样品标记为C-GOJI,发酵枸杞果汁样品标记为F-GOJI。
1.3.3 体外抗氧化活性的测定
体外抗氧化活性的测定采用Trolox等效抗氧化能力(trolox equivalent antioxidant capacity,TEAC)测定法。
DPPH自由基清除能力的测定[14]:将2 mL样品加入4 mL DPPH甲醇溶液(0.045 mg/mL)中。将混合物在黑暗中保持30 min,然后将0.2 mL的混合物迅速转移到96孔的酶标板上,在波长517 nm处测量吸光度值。
ABTS+自由基清除能力的测定[15]:根据试剂盒说明书,在96孔酶标板上,每孔反应体系中加入10 μL样品(或标准品)和20 μL肌红蛋白工作液,再加入150 μL ABTS工作液(每10 mL ABTS工作液含有25 μL 3%的过氧化氢),混匀后反应5 min,加入100 μL 终止液,波长405 nm处测量吸光度值。
铁还原抗氧化能力(FRAP)的测定[16]:将0.3 mol/L醋酸盐缓冲液(pH 3.6)、10 mmol/L TPTZ和20 mmol/L氯化铁按10∶1∶1的比例混合,混合溶液在37 ℃孵育30 min,得到FRAP溶液。将10 μL样品加入190 μLFRAP溶液中,室温下暗处孵育3~5 min,波长593 nm处测定吸光度值。
分别采用浓度为0、0.015 mmol/L、0.045 mmol/L、0.105 mmol/L、0.21 mmol/L、0.42 mmol/L的Trolox(水溶性维生素E 类似物)溶液作为样品绘制标准曲线,通过回归方程将样品的抗氧化能力换算成当量mmol/L的Trolox,结果表示为mmol/L Trolox当量(Trolox equivalent,TE)/L)。
1.3.4 细胞毒性
取对数生长期的Caco-2细胞或RAW264.7细胞接种于96 孔细胞板中,Caco-2细胞在DMEM(含质量分数10%胎牛血清、青霉素G 100 IU/mL、链霉素100 IU/mL)中进行培养,RAW264.7 细胞在RMPI 1640(含质量分数10%胎牛血清、青霉素G 100 IU/mL、链霉素100 IU/mL)中进行培养。Caco-2细胞接种密度为5.0×104cells/mL,RAW264.7细胞接种密度为1.0×105cells/mL,37 ℃、5%CO2条件下培养24 h。弃去原培养基,加入100 μL含样品(不同稀释度的样品)的培养液,对照组只加100 μL的培养液,继续培养24 h。
使用CCK-8试剂盒检测不同样品处理后细胞的存活率:移去培养基,用PBS清洗一次,加入新鲜培养基,每孔加入10 μL CCK-8溶液,培养箱内孵育4 h。用酶标仪测定在波长450 nm 处的吸光度值。细胞活力在90%以上表示样品无细胞毒性。细胞活力计算数学式如下:
式中:A样品为样品孔的吸光度值;A空白为仅含CCK-8溶液的培养基的空白孔吸光度值;A对照为含有细胞、CCK-8溶液的培养基的对照孔吸光度值。
1.3.5 枸杞提取物对细胞氧化损伤的保护作用
细胞氧化损伤模型的建立:接种密度为5.0×104cells/mL的Caco-2细胞于96 孔板中,分别设置空白组和模型组。细胞在37 ℃、5%CO2培养箱中培养24 h后,模型组分别加入终浓度为100 μmol/L、200 μmol/L、300 μmol/L、400 μmol/L、500 μmol/L的H2O2,继续孵育24 h后,CCK-8法测定细胞存活率,当细胞存活率约为50%时,对应的H2O2浓度即为建立Caco-2细胞氧化损伤模型的浓度。
对H2O2氧化损伤的细胞的保护作用:将密度为5.0×104cells/mL的Caco-2细胞接种于96 孔板中,分别设置对照组、模型组和干预组。细胞贴壁后,弃去原培养基,干预组加入含10 μL不同样品的培养基,同时模型组和对照组仅加入培养基,继续孵育24 h,干预组和模型组加入最佳损伤浓度的H2O2溶液,继续孵育12 h后,CCK-8法测定细胞存活率。
1.3.6 枸杞提取物对细胞炎症因子的影响[17]
将密度为1.0×105cells/mL的RAW264.7细胞接种于培养板,分别设置对照组、模型组和干预组。细胞贴壁后,弃去原培养基,干预组加入100 μL含样品的培养液,对照组和模型组加入100 μL的培养液,预处理4 h。随后除对照组外均加入LPS至终质量浓度为1 μg/mL,继续培养24 h,用于测定细胞因子的含量。根据试剂盒说明书,测定不同组别的RAW264.7细胞分泌细胞因子:肿瘤坏死因子(tumor necrosis factor-α,TNF-α)、白细胞介素-6(interleukin 6,IL-6)、一氧化氮(nitric oxide,NO)、白细胞介素-10(interleukin 10,IL-10)的含量。
1.3.7 统计学分析
每个数据均为3次测定的平均值,使用SPSS 23.0统计软件进行方差分析(analysis of variance,ANOVA)(P<0.05表示差异显著)。数据结果以“平均值±标准差”表示,采用Origin 9.0作图。
2 结果与分析
2.1 枸杞果汁的体外抗氧化活性
Trolox等效抗氧化能力(TEAC)测定法已广泛应用于食品样品的测定。不同的抗氧化成分可能通过不同的机制起作用,因此,采用三种抗氧化评价方法研究枸杞样品提取物的抗氧化能力,结果见图1。由图1可知,未发酵枸杞果汁提取物的DPPH·、ABTS+·、FRAP的Trolox等效抗氧化能力(TEAC)值分别为12.46 mmol/L、30.25 mmol/L和15.43mmol/L。与未发酵枸杞果汁提取物相比,经鼠李糖乳杆菌LGG发酵后,枸杞发酵果汁提取物抗氧化活性显著增加,DPPH·、ABTS+·、FRAP的TEAC值分别达到17.53 mmol/L、42.72 mmol/L和21.12 mmol/L。
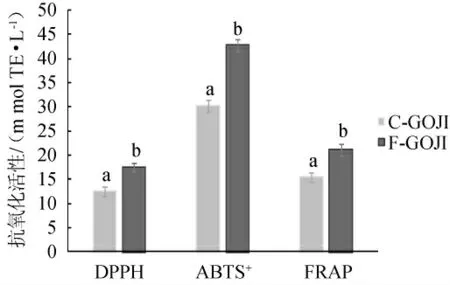
图1 基于ABTS+、DPPH和FRAP方法发酵前后枸杞果汁提取物的抗氧化活性Fig.1 Antioxidant activities of Goji berry juice extract before and after fermentation based on ABTS+,DPPH,and FRAP methods
DPPH·和ABTS+·是测定样品通过电子转移反应清除自由基的能力,主要归因于样品中羟基的总数和反应性。FRAP自由基清除活性取决于样品在TPTZ存在下将Fe(III)还原为Fe(II)的能力,用于测量样品的还原力。多糖、类胡萝卜素、萜类和酚类化合物(酚酸、类黄酮和单宁)是枸杞中发现的主要生物活性化合物,这些成分与DPPH·、ABTS+·和FRAP之间存在正相关关系[18]。在本研究中,发酵后的提取物具有更高的抗氧化活性,这与其他发酵果汁的研究结果一致,如石榴汁的发酵提高了基于DPPH和ABTS+测定的抗氧化活性[19]、植物乳杆菌发酵桑椹汁具有较强的还原能力[20]、经瑞士乳杆菌发酵的红枣汁抗氧化能力有显著提升[21]。这可能是由于乳酸菌发酵过程中的酶(如β-半乳糖苷酶、β-葡萄糖苷酶等)将高分子质量的酚类化合物转化为游离酚类物质,以及高分子质量的多糖降解而暴露出更多的活性基团。
2.2 枸杞果汁对Caco-2细胞氧化损伤的保护作用
采用蒸馏水稀释枸杞果汁提取物的含量分别为0、100 μL/mL、200 μL/mL、400 μL/mL、600 μL/mL、800 μL/mL、1 000 μL/mL,考察枸杞提取物含量对Caco-2细胞氧化损伤的保护作用,结果见图2。由图2可知,样品中0~600μL/mL的果汁提取物含量对Caco-2细胞存活率无显著影响(P>0.05)。样品中果汁提取物含量800 μL/mL和1 000 μL/mL使Caco-2细胞存活率显著下降(P<0.05)。因此,选用果汁提取物含量600 μL/mL进行Caco-2细胞的下一步实验。
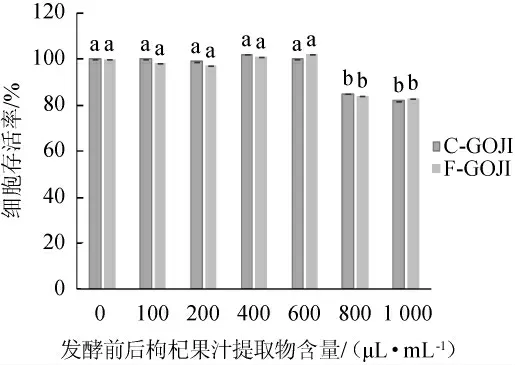
图2 发酵前后枸杞果汁提取物含量对Caco-2细胞存活率的影响Fig.2 Effects of Goji berry juice extract addition before and after fermentation on the viability of Caco-2 cell
为建立H2O2诱导的Caco-2细胞氧化损伤模型,首先研究了不同H2O2浓度对Caco-2细胞活力的影响,选用100μmol/L、200 μmol/L、300 μmol/L、400 μmol/L和500 μmol/L的H2O2浓度作用Caco-2细胞,结果见图3。由图3可知,H2O2浓度范围100~500 μmol/L细胞活力随浓度的增加也显著降低(P<0.05),其中200 μmol/L H2O2浓度使得细胞达到约半数致死量,该结果与之前对H2O2诱导Caco-2细胞的研究结果一致[22]。因此,选择200 μmol/LH2O2建立氧化损伤模型。
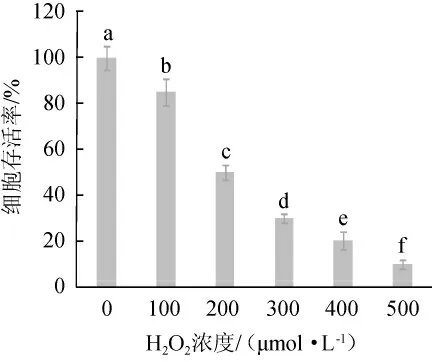
图3 不同浓度的H2O2对Caco-2细胞存活率的影响Fig.3 Effects of different H2O2 concentration on the viability of Caco-2 cell
H2O2常常被用作氧化剂,可直接损伤DNA、蛋白质和脂质等大分子,引起细胞氧化损伤,导致细胞损伤或死亡。细胞抗氧化活性考虑了细胞内的吸收、代谢和分布等多个方面,能较好地预测物质在体内的抗氧化能力。考察枸杞提取物对H2O2诱导的Caco-2细胞氧化损伤的细胞存活率的影响,结果见图4。
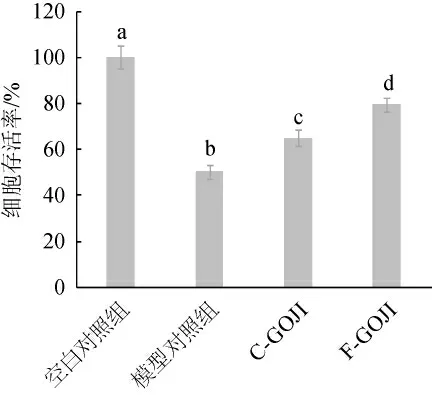
图4 发酵前后枸杞果汁提取物对H2O2诱导Caco-2氧化损伤细胞存活率的影响Fig.4 Effects of Goji berry juice extract before and after fermentation on the viability of oxidative damage cell induced by H2O2
由图4可知,H2O2处理的模型对照组细胞存活率(50.2%)约为空白对照组的一半,经过未发酵枸杞果汁和发酵枸杞果汁提取物处理后,细胞存活率分别达到65.0%和79.4%,细胞存活率分别较未经处理的模型细胞存活率增高1.29倍和1.58倍。LI Z X等[14]用植物乳杆菌(L.plantarum)ATCC14917发酵苹果汁的细胞抗氧化值约为未发酵苹果汁的2倍;ZHANG Y等[23]用植物乳杆菌(L.plantarum)J26发酵提高了蓝莓汁的细胞抗氧化活性。冯琳[24]用多菌种混合发酵枸杞汁,以Hep G2细胞为评价模型,结果发现,发酵枸杞汁可以明显缓解细胞内氧化损伤。细胞抗氧化活性的增强同样是由于乳酸菌代谢会耗尽酚类等功能化合物的葡萄糖分子,产生羟基数量更多的游离苷元,或者转换成空间位阻更低的羟基[14],从而促进在枸杞汁发酵过程中产生一些抗氧化活性更高的代谢物。
2.3 枸杞果汁对LPS 诱导的RAW264.7细胞炎症的抗炎活性
炎症是宿主对刺激、损伤和感染的一种正常的保护性反应,是维持免疫系统稳态所必需的。过度的炎症与慢性疾病相关,包括癌症、类风湿关节炎和血管疾病、肥胖、糖尿病等[25]。巨噬细胞在免疫系统中起到关键作用,抑制巨噬细胞活化是一种潜在的改善炎性疾病的方法[26]。脂多糖(LPS)来源于革兰氏阴性菌,可与细胞膜表面toll样受体(TLR)4结合,刺激巨噬细胞产生炎症细胞因子和炎症介质,是常见的炎症诱导因子之一。LPS诱导的RAW 264.7模型常被用来模拟炎症组织,评价样品的体外抗炎活性[27]。
采用蒸馏水稀释枸杞果汁提取物的含量分别为0、100 μL/mL、200 μL/mL、400 μL/mL、600 μL/mL、800 μL/mL、1 000μL/mL,考察枸杞果汁提取物对LPS诱导的RAW264.7细胞存活率的影响,结果见图5。由图5可知,样品中0~600 μL/mL的果汁提取物含量对RAW264.7细胞存活率无显著抑制作用(P>0.05)。样品中800 μL/mL和1 000 μL/mL果汁提取物含量使RAW264.7细胞存活率显著下降(P<0.05)。因此,选用果汁提取物含量为600 μL/mL进行下一步实验。
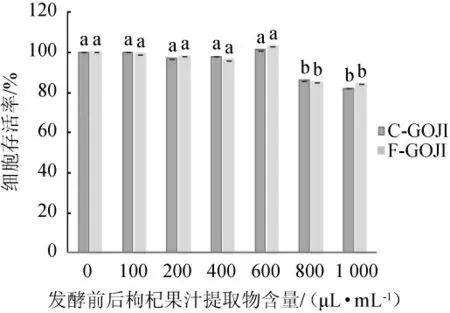
图5 发酵前后枸杞果汁提取物含量对RAW264.7细胞存活率的影响Fig.5 Effects of Goji berry juice extract content before and after fermentation on the viability of RAW264.7 cell
枸杞果汁提取物对LPS诱导的RAW264.7细胞分泌TNF-α、IL-6、NO及IL-10的影响,结果见图6。
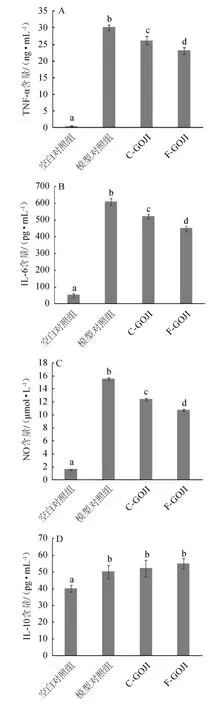
图6 发酵前后枸杞果汁提取物对LPS诱导的RAW264.7细胞分泌TNF-α(A)、IL-6(B)、NO(C)及IL-10(D)的影响Fig.6 Effects of Goji berry juice extract before and after fermentation on LPS-induced RAW264.7 cells secreting TNF-α(A),IL-6(B),NO(C)and IL-10(D)
TNF-α和IL-6是活化的巨噬细胞释放的主要促炎细胞因子[28]。TNF-α通过介导急性炎症反应和慢性炎症而启动或参与疾病病理。由图6A可知,与空白对照组(0.50 ng/mL)相比,LPS处理导致细胞释放TNF-α显著增加(30.12 ng/mL)(P<0.05)。与模型对照组相比,C-GOJI和F-GOJI可显著降低TNF-α的释放量(分别为26.21 ng/mL、23.14 ng/mL)(P<0.05),其中F-GOJI组显著低于C-GOJI组(P<0.05)。
IL-6是急性期炎症反应的强激活剂,引发全身和局部炎症反应,过量的IL-6可诱发多种慢性炎症疾病。由图6B可知,与空白对照组相比,LPS刺激下模型对照组IL-6的释放量显著增加(P<0.05)。给予枸杞果汁提取物干预后,与模型对照组(610 pg/mL)相比,C-GOJI和F-GOJI可显著降低IL-6的释放量(分别为520 pg/mL、450 pg/mL)(P<0.05),其中F-GOJI组显著低于C-GOJI组(P<0.05)。结果表明,枸杞果汁提取物可以通过降低TNF-α和IL-6分泌量发挥抗炎特性,发酵枸杞果汁提取物的效果高于未发酵枸杞果汁提取物。
NO是炎症反应的标志。它由诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)等通过L-精氨酸途径合成。病理条件下,巨噬细胞产生大量的NO,并在慢性感染、炎症中发挥双重作用。减少NO的产生是治疗多种炎症性疾病的有效策略。由图6C可知,与空白对照组(1.53 μmol/L)相比,LPS处理显著增加了NO的产生(15.57 μmol/L)(P<0.05),这可能是因为LPS激活巨噬细胞,诱导局部炎症和抗体的产生,并影响体内iNOS的表达,从而影响NO的产生。当细胞用C-GOJI和F-GOJI处理时LPS诱导的NO生成的增加被显著抑制(分别为12.41 μmol/L、10.72 μmol/L)(P<0.05),且F-GOJI的抑制效果更好。结果表明,枸杞果汁提取物能够通过抑制NO分泌发挥抗炎作用,发酵后的枸杞果汁作用效果高于未发酵的枸杞果汁。
RAW264.7细胞在不同的状态下具有不同的功能。第一种是促炎(通常是激活的巨噬细胞)功能(M1型),第二种是抗炎(交替激活的巨噬细胞)功能(M2型)。M1型巨噬细胞产生高水平的促炎介质,包括IL-6和TNF-α,而M2型巨噬细胞产生高水平的抗炎介质,如IL-10。IL-10是一种有效的抗炎因子,它通过抑制各种促炎介质来控制炎症过程[29]。由图6D可知,与空白对照组相比,LPS诱导的RAW 264.7细胞上清中IL-10水平显著增加,表明细胞有M2型巨噬细胞特征。与模型组相比,各组样品对RAW264.7细胞分泌IL-10没有促进作用,说明枸杞果汁和发酵枸杞果汁均不能通过促进IL-10的分泌发挥抗炎作用。
许多研究表明,益生菌及其活性产物具有抗炎作用。LGG减轻LPS诱导的结肠癌细胞HT-29炎症反应[30],LGG分泌的可溶性蛋白P40下调了参与先天免疫的促炎细胞因子,包括巨噬细胞产生的TNF-α和IL-6[31]。大肠杆菌(Escherichia coli)Nissle 1917分泌的胞外囊泡刺激RAW264.7细胞使IL-10的产生增加到更高的水平,IL-10可强烈抑制细胞因子信号转导中促炎细胞因子的产生[32]。浆果或浆果化合物的抗炎特性已被证实,一些研究中发现乳酸菌发酵浆果能更有效的抑制炎症。KANG Y F等[33]将枸杞汁与植物乳杆菌、罗伊氏乳杆菌、嗜热链球菌共发酵,发酵后的枸杞汁中多糖、氨基酸、游离酚和类黄酮含量增加,抗炎作用提升。YOUNU J等[34]从诺丽果发酵果汁中分离得到新的化合物2和7显示出抗炎活性。蓝莓和黑莓发酵饮料中的花青素和原花青素通过NF-κB介导途径降低了LPS诱导的巨噬细胞炎症反应[35]。在RAW264.7细胞模型中,枸杞中的一些酚酸酰胺对NO的产生表现出显著的抑制作用,特别是咖啡酸衍生物,具有良好的抗炎性能和功能成分[36]。东莨菪素是枸杞中的一种香豆素,在自身免疫性脑脊髓炎小鼠模型中,东莨菪素治疗可显著减少中枢的炎症。益生菌发酵将促进枸杞中复杂的植物化学分子降解为更小的生物活性成分,有利于抑制炎症细胞因子的产生,从而抑制炎症反应[37-38]。
3 结论
本研究选用鼠李糖乳杆菌(Lactobacillus rhamnosus)LGG对枸杞果汁进行发酵,探讨发酵对枸杞果汁体外抗氧化、抗炎活性的影响。研究表明,枸杞果汁经乳酸菌发酵后抗氧化和抗炎特性有显著提升。发酵后的枸杞果汁具有更强的清除DPPH、ABTS+自由基的作用和铁离子还原能力、改善氧化损伤细胞存活力的特性。与未发酵枸杞果汁相比,发酵枸杞果汁可以通过更强的抑制LPS诱导的巨噬细胞RAW264.7分泌TNF-α、IL-6和NO来发挥抗炎功效,表明发酵枸杞果汁在预防或减轻氧化应激和炎症方面具有更好的潜力。本研究可为枸杞的抗氧化和抗炎活性带来了一些科学见解,拓展枸杞的加工利用方式,为枸杞开发健康新产品提供依据。

