经导管“瓣中瓣”置换术治疗二尖瓣置换术后生物瓣衰败的疗效评价
张靖男,万俊义,宋会军,张旌,潘家华,吴永健,潘湘斌,张戈军
二尖瓣疾病是最常见的心脏瓣膜疾病,外科瓣膜置换术是重度二尖瓣病变的重要治疗方法。外科瓣膜置换术采用机械瓣和生物瓣,生物瓣无需终身使用抗凝药,但随时间延长会出现瓣膜衰败问题,需再次换瓣。既往研究显示,再次外科手术风险明显大于初次手术[1],二尖瓣二次外科手术30 d 死亡率约6.3%~15.0%[2-4],而三次、四次开胸30 d 死亡率更高达17.3%和40.0%[5]。
应用SAPIEN3 瓣膜(爱德华生命科学,美国)行经导管二尖瓣“瓣中瓣”置换术(MViV),对于二尖瓣置换术后生物瓣衰败患者是一种新的治疗方法,在欧美已经获得监管机构批准用于再次外科手术高风险的患者。中国医学科学院阜外医院自2021年1 月起开展了MViV 临床实践[6],现对其疗效、安全性进行分析和评价。
1 资料与方法
1.1 一般资料
2021 年1 月至2022 年4 月于我院及两家分院对二尖瓣置换术后生物瓣衰败患者行MViV共11例,纳入标准:二尖瓣生物瓣置换术后生物瓣衰败,外科手术高风险,同时满足下述任一条件:(1)有症状的生物瓣中重度狭窄;(2)有症状的生物瓣中重度反流;(3)上述两者共存。所有患者的介入治疗均经中国医学科学院阜外医院伦理委员会审核批准(项目编号:2021-K-9),并签署手术风险知情同意书,并由本院心脏团队共同评估治疗的风险及可行性。
1.2 治疗经过
所有患者术前均根据既往手术记录获取所用生物瓣的品牌及型号,并通过ViV Mitral 软件(Valvein-Valve Mitral app,UBQO)获得该瓣膜的真实内径。术前经食道超声心动图(TEE)明确生物瓣病变类型,左心房和房间隔位置形态,有无左心耳血栓或瓣周漏等情况。再通过3Mensio 软件(Pie Medical Imaging BV,荷兰)进行CT 术前评估,CT 评估时相应选择收缩中期或末期。首先结合真实内径CT 测量瓣环大小确定拟置入的瓣膜型号;其次详细评估左心室流出道形态结构及梗阻风险,在生物瓣部位虚拟置入选好型号的瓣膜,再测量瓣膜模拟置入后左心室流出道面积(neo-LVOT)(图1A)、主动脉瓣-二尖瓣夹角以及新置入瓣膜至室间隔的距离等。房间隔解剖特点(有无膨出瘤、钙化等)和穿刺点位置需结合CT 和TEE 来确定(图1B),房间隔穿刺位点一般选择房间隔后下方。
所有介入操作均于杂交手术室全身麻醉下进行。穿刺左侧股动脉置入5 F 猪尾导管行左心导管检查,并于术中持续监测主动脉压力;穿刺右侧股静脉置入6 F 多功能导管行右心导管检查,穿刺左侧股静脉送入临时起搏电极至右心室。在透视及TEE 引导下穿刺房间隔,测量左心房压力(图1C);建立右股静脉-右心房-左心房-左上肺静脉导丝轨道,交换入8 F Agilis 可调弯鞘;经可调弯鞘送猪尾导管至左心房,再操控可调弯鞘及猪尾导管(必要时配合导丝),将猪尾导管头端穿过二尖瓣生物瓣口送至左心室心尖部;然后使用预成型超硬导丝建立右股静脉-下腔静脉-右心房-左心房-左心室轨道;沿导丝送入外周血管扩张球囊至房间隔穿刺进行扩张(图1D),扩张后继续推送该球囊穿过二尖瓣口确认轨道的通畅性;沿导丝送入在体外装载好的瓣膜及其输送系统至下腔静脉近心段,并完成输送系统和瓣膜的体内组装和对齐;继续沿导丝推送输送系统及瓣膜穿过房间隔至二尖瓣生物瓣瓣架内,透视下参考外科生物瓣架的标志确定SAPIEN 3 瓣膜处于正确位置,使得SAPIEN 3 瓣膜20%~30%位于生物瓣瓣环的左心房端,70%~80%位于左心室端;再以临时起搏器按180~200 次/min频率起搏右心室,待血压下降至60/40 mmHg(1 mmHg=0.133 kPa)以下时缓慢充盈球囊释放瓣膜至目标位置并保持3~5 s(图1E),然后回抽球囊内对比剂完成瓣膜释放,并停止起搏;以TEE 评估瓣膜位置及功能无异常后撤出输送系统;最后行左心室造影和左、右心导管检查评价术后即刻疗效(图1F)。

图1 经导管二尖瓣“瓣中瓣”置换术全过程
手术成功的标准[7]:(1)无术中死亡;(2)瓣膜输送装置成功地输送和撤回;(3)成功置入单个瓣膜;(3)瓣膜功能完整(瓣膜面积>1.5 cm2且无中度以上反流);(4)无需再次干预(外科手术或介入手段)瓣膜或输送入路;(5)患者顺利出院。
所有患者出院后均口服华法林抗凝6 个月,并于术后1、3、6 个月及1 年定期随访。
1.3 观察指标
观察介入治疗术前、术后即刻、术后1、3、6个月及1 年的超声心动图检查以评价瓣膜功能,统计住院期间及出院后全因死亡和主要不良心血管事件(MACE)发生情况,MACE 定义为心血管死亡、心肌梗死和脑卒中。
1.4 统计学分析
所有数据采用SPSS 26.0 统计软件进行分析。符合正态分布的计量资料采用均数±标准差表示。计数资料采用例(%)表示。符合正态分布的计量资料采用配对t检验,计数资料通过χ2检验或Fisher精确检验进行评估,以P<0.05 为差异有统计学意义。
2 结果
2.1 11 例患者的术前临床资料(表1)
表1 11 例患者的术前临床资料(±s)

表1 11 例患者的术前临床资料(±s)
注:MS:二尖瓣狭窄;MR:二尖瓣反流;LVEF:左心室射血分数;neo-LVOT:瓣膜模拟置入后左心室流出道面积。-:无。1 mmHg=0.133kPa
11 例患者中女性8 例,男性3 例,平均年龄(73.6±5.8)岁,平均体重指数为(23.3±5.8)kg/m2。合并心房颤动10 例,合并2 型糖尿病7 例,有脑卒中病史4 例,合并高脂血症9 例,2 例有冠状动脉旁路移植术(CABG)史,6 例既往同时置换主动脉瓣生物瓣,9 例合并高血压,所有患者NYHA 心功能分级均为Ⅲ或Ⅳ级,患者平均美国胸外科医师协会(STS)评分为(10.3±2.2)%。10 例患者生物瓣狭窄合并反流,8 例患者合并中量及以上三尖瓣反流。所有患者术前均完善超声心动图、CT 等相关检查。
2.2 11 例患者的介入治疗及住院期间并发症发生情况(表2)
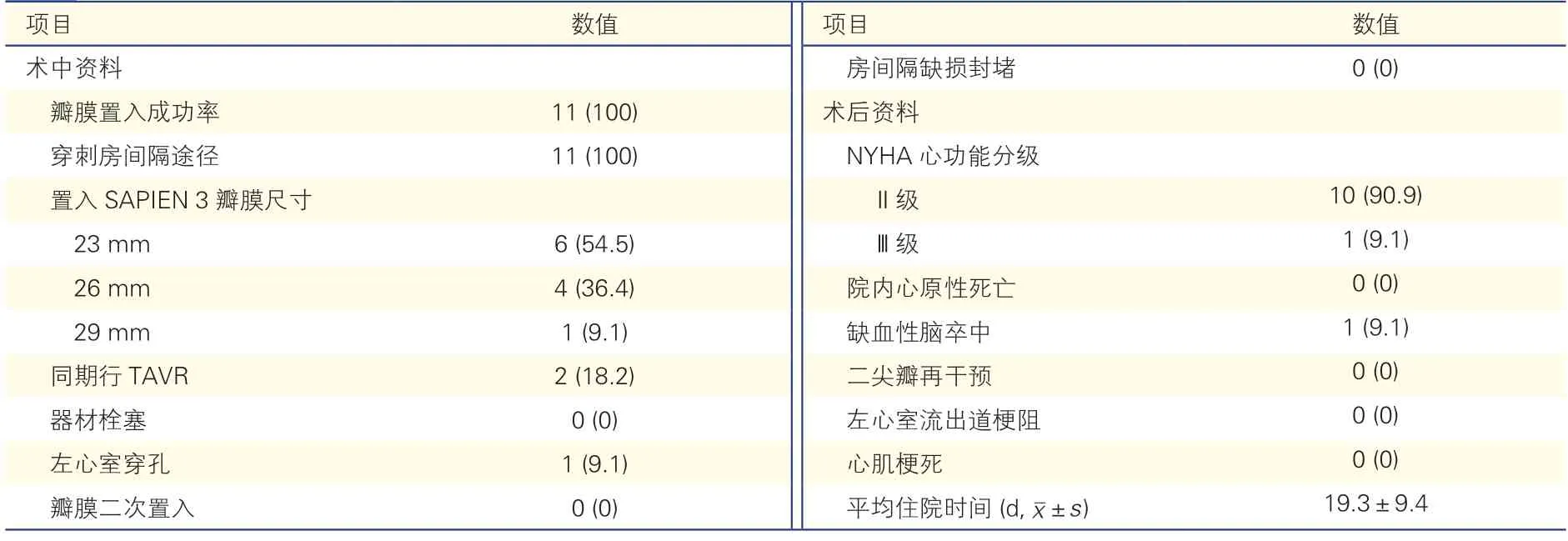
表2 11 例患者介入治疗资料[例(%)]
11 例患者手术均通过穿刺房间隔路径置入SAPIEN 3 瓣膜,6 例经评估后置入23 mm 瓣膜,4例置入26 mm 瓣膜(病例1、3、6、11),1 例置入29 mm 瓣膜(病例10);2 例因主动脉生物瓣衰败同期行经导管主动脉瓣置换术(病例2、3)。瓣膜置入成功率为100%。
11 例患者术后均无瓣膜功能异常(平均跨瓣压差大于10 mmHg 或出现2 级以上反流),无瓣周漏发生,2 例同期双瓣置换患者主动脉瓣膜功能良好。所有患者术后心功能均有明显改善,NYHA心功能分级Ⅲ或Ⅳ级患者明显减少(100% vs.9%,P<0.001)。二尖瓣平均跨瓣压差降低[(13.1±3.9)mmHg vs.(7.8±2.0)mmHg,P=0.001],4 例患者三尖瓣反流由中、重度转为轻度。
住院期间无患者出现心原性死亡、心肌梗死、左心室流出道梗阻、术中二尖瓣再干预及全因死亡;1 例(病例4)瓣膜释放成功后出现左心室穿孔导致心脏压塞行急诊外科手术,1 例术后出现缺血性脑卒中(病例1);无瓣膜功能异常需再介入或行外科手术;无起搏器植入、左心室流出道梗阻、血管入路损伤等并发症。
2.3 术后随访结果
所有患者均完成术后即刻复查;6 例完成术后1个月随访,超声心动图随访数据显示二尖瓣平均跨瓣压差及峰值流速与术前比较差异均有统计学意义(P均<0.01),见表3。1 例因肺部感染死亡(病例8),余患者瓣膜功能良好,无不良事件发生。3 例患者完成术后6 个月的随访,其瓣膜功能良好,未见不良事件发生[平均跨瓣压差(6.5±0.9)mmHg,峰值流速(1.7±0.2)m/s]。尚无患者完成术后1年随访。
表3 术前、术后即刻及随访1 个月时超声心动图结果比较(±s)

表3 术前、术后即刻及随访1 个月时超声心动图结果比较(±s)
注:LVEF:左心室射血分数。与术前比较*P<0.01。1 mmHg=0.133 kPa
3 讨论
外科二尖瓣生物瓣置换术后生物瓣衰败是该技术必然要面临的一个问题,既往只能通过再次外科手术来解决,但再次手术风险明显更大。2009 年Cheung 等[8]首先成功完成了外科二尖瓣生物瓣衰败MViV,给这类患者的治疗带来一种新的思路。早期MViV 通过经心尖路径来完成,随着器械和技术的改进,目前大多数此类治疗通过经股静脉、穿刺房间隔路径来完成,进一步降低了创伤和技术风险。
目前以经导管二尖瓣“缘对缘”修复术和MViV为代表的二尖瓣介入技术在欧美国家快速发展[9]。2021 年的前瞻性MITRAL 试验中MViV 的成功率为100%,且1 年随访显示无患者发生死亡或其他不良事件[10]。可以看出MViV 在欧美国家经过数10 年的发展已经成为一种疗效显著的安全手段,可以用于外科高危人群生物瓣衰败后再干预。FDA 也于2017年批准SAPIEN 3 瓣膜在二尖瓣位生物瓣衰败后“瓣中瓣”的临床应用。
TEE 和CT 等术前检查对MViV 至关重要,能够完整地评估生物瓣衰败类型、瓣周漏情况、并发症发生风险以及对手术流程提前规划。瓣膜尺寸选择通常基于ViV Mitral 软件和CT 测量数据进行综合选择[11],但考虑CT 图像可能会受金属瓣架伪影的影响,生物瓣的真实内径是瓣膜选择最重要的参数,对于无法判定内径的生物瓣可通过球囊测量方式确定内径。术前CT还需评估左心室流出道梗阻的风险,目前通过3Mensio 等半自动化软件测量neo-LVOT面积是准确度最高的方法[12],目前国际共识认为neo-LVOT 在170~190 mm2时预测梗阻灵敏度和特异度更高[13],在本研究纳入患者中neo-LVOT 面积均大于200 mm2,无左心室流出道梗阻发生。穿刺房间隔途径近年来应用已经超过经心尖置入途径,穿刺房间隔需要借助TEE 和CT 进行穿刺位置、左心房及房间隔形态的评估,同时排除左心耳血栓的风险。
在外科二尖瓣置换术后会出现患者瓣膜不匹配的情况,即二尖瓣有效瓣膜面积与体表面积之比小于1.2 cm2/m2,瓣膜不匹配的发生与术后不良事件密切相关[14];对于瓣膜不匹配的预防也需在术前进行评估并尽量选择有效面积更大的瓣膜。尽管目前MViV 术后瓣膜不匹配的报道较少,但基于外科瓣真实内径选择瓣膜也意味着二尖瓣有效瓣口面积的减少,这可能会增加瓣膜不匹配的发生率。因此未来术前研究和临床实践应更加关注这一问题,对于可能发生术后瓣膜不匹配的患者可考虑能否应用超高压球囊扩裂既往外科瓣膜以实现更好的血液动力学效果。
瓣膜输送时选择合适的加硬导丝能够有效降低左心室破裂的风险,国外早期研究报道使用小弯度的Safari 导丝(波士顿科学,英国)能够有效避免左心室壁损伤[15]。在本研究中使用的加硬导丝包括微创心通预塑形导丝和沛嘉公司预塑形导丝,术中出现1 例左心室壁损伤患者(病例4),因此MViV在国内推广阶段仍然需要进一步探索合适的输送导丝及操作技巧。在SAPIEN 3 瓣膜锚定时选择20%~30%位于生物瓣瓣环的心房端,70%~80%位于心室端,这个置入深度对预防瓣膜向心房移位和瓣周漏至关重要[16]。
本研究中1 例患者术后24 h 行CT 检查示右侧大脑半球梗死灶。在国外报道中MViV 术后脑卒中发生率约为2.3%~2.9%[17],Schmidt 等[18]曾报道了15 例使用脑保护装置的MViV,所有患者滤器均出现过滤物,组织学分析显示按照比例依次为急性血栓、动脉壁成分、钙化、瓣膜组织。因此,退化的外科生物瓣行MViV 手术可能有更高的血栓栓塞风险,术中需及时给予肝素并检测全血凝固时间(ACT),术后也应密切关注患者体征,避免脑卒中这一少见却严重的并发症发生;我国目前尚无可商业化使用的瓣膜介入治疗脑保护装置,以后随着这类器械在临床上的推广,有望显著降低此类并发症的发生。目前指南尚未明确MViV 术后抗栓策略,在本研究中由于心房颤动的高发生率所有患者术后均口服抗凝药,术后30 d 随访未见瓣膜血栓栓塞、压差升高及出血事件发生。有研究报道经导管二尖瓣置换术患者在术后3 个月内血栓栓塞风险最高,瓣膜内皮化后风险会降低[19],50%的瓣膜血栓形成患者会表现为跨瓣压差升高,使用抗凝治疗的患者发生率更低[19-20]。因此目前MViV 抗栓策略仍可按照外科生物瓣术后抗栓策略,即术后至少3 个月的口服抗凝药治疗,抗凝治疗时国际标准化比值(INR)应达到2.5。
国内目前少见应用SAPIEN 3 瓣膜行MViV 的报告,本研究的局限性为回顾性研究,样本量较少,未设置对照组;同时由于本研究是该技术在国内的初步探索阶段,其临床疗效和预后会受到团队学习周期因素影响而产生偏倚,因此需要期待更大规模、多中心、前瞻性、随机对照临床研究进一步验证。
综上所述,本研究结果表明对于外科二尖瓣生物瓣衰败后MViV 成功率较高,对于外科高危人群安全性良好。但是MViV 仍然有一定的风险性和技术要求,目前更适合在有经验的大型心脏中心开展。随着临床实践经验的不断积累,可预见在未来MViV 将在国内迎来更加广泛的应用。
利益冲突:所有作者均声明不存在利益冲突
——导丝概述及导丝通过病变技巧

