拘禁球囊技术应用于真性分叉病变V-RESOLVE高危病人的疗效观察
申少梦,杜文涛
近年来,冠状动脉分叉病变(coronary bifurcation lesions,CBL)已成为冠心病中的一种较常见的特殊病变,在经皮冠状动脉介入治疗(percutaneous coronary intervention,PCI)中占15%~20%[1]。且由于冠状动脉分叉病变的PCI治疗成功率较低,近、远期并发症较多,目前仍是冠状动脉介入治疗的重大挑战之一[2]。尽管目前已有大量研究对 PCI治疗分叉病变的即刻以及近期疗效进行分析报道,但由于分叉血管病变位置的变异性和对维持分支血管(side branch,SB)通畅性的要求,目前对冠状动脉分叉病变的最佳介入策略的选择仍然存在争议[3]。本研究通过对真性分叉病变且V-RESOLVE评分高危病人进行分组,对分支采取拘禁球囊技术(jailed balloon technique,JBT)和分支导丝保护技术(jailed wire technique,JWT)进行保护,对比两种术式在术后即刻和近、远期的安全性和有效性。
1 资料与方法
1.1 研究对象 选择2019年3月—2020年2月经我院心血管内科行冠状动脉血管造影术(coronary angiography,CAG)明确诊断为真性分叉病变且满足纳入标准的病人共164例,将入选病例按照随机数字表法分为JBT组(82例)和JWT组(82例),两组一般资料比较差异无统计学意义(P>0.05)。详见表1。

表1 两组一般资料比较
1.2 纳入标准 ①主支血管(main vessel,MV)直径≥2.5 mm,狭窄程度≥70%;②SB直径1.5~2.5 mm,狭窄程度50%~70%;③V-RESOLVE评分为高危;④拟行单支架策略。
1.3 排除标准 ①年龄>80岁者;②左主干分叉病变者或靶血管以外的冠状动脉狭窄程度≥50%者,③严重钙化病变者;④急性ST段抬高型心肌梗死或陈旧性心肌梗死病史者;⑤对抗血小板药物过敏或不能耐受者;⑥既往12个月内出现大出血、脑卒中或进行重大手术者;⑦合并恶性肿瘤或其他严重疾病者;⑧精神异常不能配合者。
1.4 研究方法 研究对象经明确诊断后立即予以抗血小板药物治疗,阿司匹林肠溶片联合氯吡格雷/替格瑞洛,且在PCI术前药物用量均达到负荷剂量(阿司匹林 300 mg,氯吡格雷300~600 mg,替格瑞洛180 mg),阿托伐他汀每晚20 mg,术前血压≤160/100 mmHg(1 mmHg=0.133 kPa),随机血糖≤15 mmol/L,血钾>3.5 mmol/L,血肌酐<120 μmol/L。本研究经河北工程大学医学伦理委员会批准,术前签署知情同意书。
常规采用 Judkins 法穿刺右桡动脉(如穿刺失败改为穿刺股动脉),要求至少2名经验丰富的介入医师确定为真分叉病变,通过采集数字化图像并用SIE-ADS V3.1图像处理软件测定PCI术前及术中相关资料,术中应用普通肝素100 U/kg抗凝,造影剂均使用碘克沙醇。JBT组:预先在分支开口处预置一个略小于分支直径的半顺应球囊,球囊近段超过主支支架2 mm内,球囊远端覆盖病变,主支支架定位并释放,观察分支血流情况。①若分支无闭塞且心肌梗死溶栓治疗临床试验(TIMI)血流3级,则主支支架扩张,使其贴壁良好;②若发生分支闭塞或TIMI 血流2 级以下,则立即以命名压力扩张分支球囊,尽快恢复分支血流,撤出分支球囊,使用第3根导丝rewire进入分支,再交换导丝并行球囊支架最终对吻扩张,分支血流恢复至TIMI 3级,手术结束,并记录边支闭塞情况。JWT组:分支预留导丝,主支支架定位后释放,观察分支血流情况;处理同上述①②。两组均记录术中有无胸痛,分支是否出现无复流或慢血流、闭塞、夹层等情况,术中若出现胸痛或无复流,则在靶血管予以硝酸甘油或钙离子通道阻滞剂,若出现分支夹层,必要时需外科手术治疗,并记录手术成功率。
术后对穿刺处进行消毒压迫包扎,送返病房。给予生理盐水或葡萄糖静脉输注进行水化治疗,多饮水,加快造影剂排出体外,术后监测生命体征,复查心电图。术后常规口服阿司匹林肠溶片每日100 mg联合氯吡格雷每日75 mg(波立维或泰嘉)或替格瑞洛90 mg,每日2次,至少12个月,阿托伐他汀钙每晚20 mg。高血压者将血压控制在140/90 mmHg以下,糖尿病病人将糖化血红蛋白控制在7%以下,LDL控制在1.8 mmol/L以下。
1.5 观察指标 ①两组病人PCI前后MV及SB的参考血管直径(reference vessel diameter,RVD)、最小管腔直径(minimal lumen diameter,MLD)、最大狭窄程度(maximum stenosis degree,MSD)、手术时长、术中射线剂量、造影剂用量、术中胸痛以及SB出现无复流或慢血流、闭塞、夹层的概率。②两组PCI术前及术后48 h血肌酐(Scr)、心肌肌钙蛋白I(cardiac troponin I,cTnI)。③PCI术后9~12个月复查CAG,观察MV及SB的RVD、MLD、MSD以及SB闭塞发生率。
2 结 果
2.1 两组PCI治疗参数比较 两组病人MV在支架后即刻和术后9~12个月的MLD、MSD比较差异均无统计学意义(P>0.05),JBT组SB在PCI后即刻和术后9~12个月MLD大于JWT组,MSD小于JWT组,JBT组PCI后即刻和术后9~12个月SB闭塞率低于JWT组,差异有统计学意义(P<0.05)。 JBT组PCI时间、射线剂量、造影剂用量均少于JWT组,差异均有统计学意义(P<0.05),两组均未发生SB夹层,JBT组术中胸痛及SB出现无复流或慢血流的发生率低于JWT组,JBT组手术成功率高于JWT组,差异均有统计学意义(P<0.05)。详见表2。

表2 两组PCI参数比较
2.2 两组PCI前后生化指标比较 两组病人术前Scr、cTnI水平比较,差异无统计学意义(P>0.05);两组病人PCI后Scr水平比较差异无统计学意义(P>0.05),JBT组PCI后cTnI水平低于JWT组,差异有统计学意义(P<0.05)。详见表3。
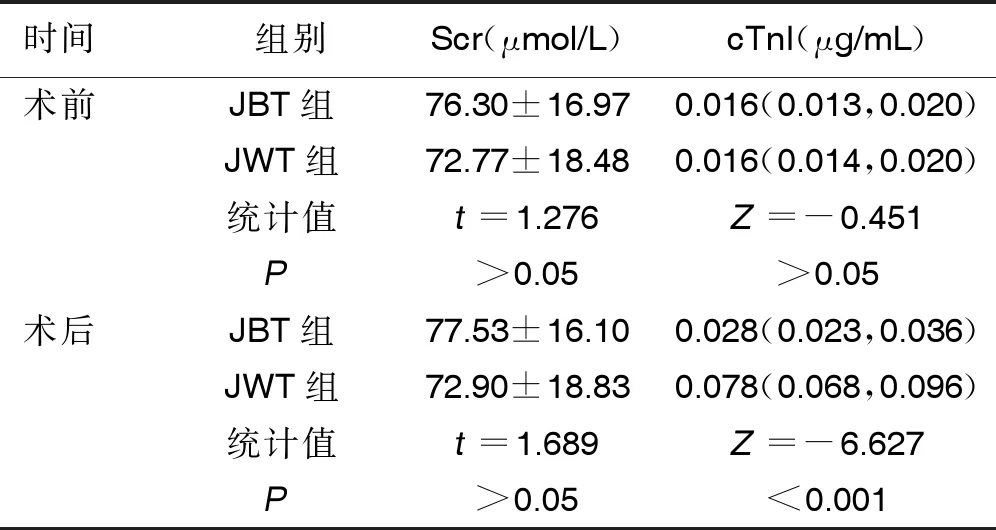
表3 两组PCI前后生化指标比较
3 讨 论
已有大量随机试验及荟萃分析表明,单支架策略处理冠状动脉分叉病变效果更好,这主要是由于采用双支架后心肌梗死和支架内血栓发生率增高所致[4-7]。单支架策略不仅减少术后并发症,而且在长期随访中发现与器械相关的临床事件也相应减少,但其也有一定的缺点,体现在支架植入过程中造成斑块移位,挤压边支开口,甚至出现分支闭塞[8]。这不仅受到操作手法的影响,同时和分叉病变局部特征有关。目前,已证实分叉病变中分支受累的风险由斑块的大小、位置、稳定性及分支开口直径、分叉角度等多种因素共同影响[9]。窦克非等根据影响分支受累的因素,建立了便于观察的V-RESOLVE系统,该评分系统包括术前主支血管斑块与分支血管位置关系等6个危险因素,评分≥12分病人定义为高危组,其分支闭塞率约为16.7%,而非高危组分支闭塞率大约为 4.3%,高危组SB闭塞率显著升高,此结果可以快速准确地筛选出SB闭塞的高风险群体[10-11]。临床上认为,对分支闭塞率低的病人,过度的保护可能增加手术费用,对分支闭塞率高的病人,更应关注对分支的保护,因此,本研究选择V-RESOLVE高危评分的病例,比较采用单支架策略对分支的不同处理术式的优劣性。
JWT通过在分支保留导丝可以在一定程度上维持主、分支血管之间的角度,但是无法阻止支架植入主支后斑块和分叉嵴的移位,主要作为分支闭塞后的补救性干预[12-13]。有研究表明,主支支架植入后,仍有超过1/3的病人出现分支狭窄加重[14],而有研究发现该方法分支闭塞率为8.4%[15]。JBT目前也作为保护分支开口以及改善分支闭塞情况的有效手段[16]。相比JWT,JBT因其球囊所占空间较大,可以阻止主支支架植入导致的斑块移位,减少SB受累的风险,同时SB球囊的扩张可以挤压SB的斑块,进而减轻SB狭窄程度,因此,也就减少了SB球囊最终对吻扩张的必要[17-19]。且JBT即使出现SB狭窄加重,球囊也可通过改变分叉夹角并作为指引,促使交换导丝的顺利完成,如出现SB的TIMI血流减少,也能通过低压扩张SB球囊达到及时重建SB血流的目的,进而降低术中并发症的出现,以及保障手术安全性[20]。
本研究发现,相比JWT,JBT减少了手术时长、射线及造影剂剂量,这不仅减少了病人和介入医师射线接触的时长,规避了一部分职业暴露风险,同时通过减少造影剂用量而减少对病人肾脏的影响;JBT组术中胸痛、SB出现慢血流或无复流的发生率更低,两组术后48 h的cTnI水平均高于术前,考虑与PCI术快速开放靶血管恢复再灌注后造成氧自由基生成、心肌细胞内钙超载、炎性细胞浸润等进而导致心肌细胞损伤有关[21],但术后48 h JBT组cTnI水平低于JWT组,提示JBT对于心肌损伤较轻,手术的安全性更好;JBT在支架后即刻和术后9~12个月的分支保护上具有明显的优势,体现在SB的MLD大于JWT组,MSD小于JWT组,SB闭塞率低于JWT组,此结果与部分研究结果[22]基本一致。
综上所述,在分支直径范围1.5~2.5 mm,狭窄程度50%~75%,V-RESOLVE高危的真性分叉病变中,对比JWT,JBT在保护边支上无论是手术即刻和近远期治疗效果上都有更好的安全性和有效性。

