过表达CaCP1 提高转基因烟草对盐胁迫的敏感性
杜清洁 周璐瑶 杨思震 张嘉欣 陈春林 李娟起 李猛 赵士文肖怀娟 王吉庆
(1. 河南农业大学园艺学院,郑州 450002;2. 河南省锄禾园林草业服务有限公司,郑州 450000)
辣椒(Capsicum annuumL.)是一类重要的蔬菜作物,在全球范围内广泛种植。随着辣椒设施栽培规模的不断扩大,复种指数高、大量使用化肥、土壤蒸发快等不利因子的影响,造成土壤盐渍化严重,迫使辣椒植株遭受盐胁迫,最终影响该产业的经济效益。
前人研究结果表明,土壤次生盐渍化可破坏植物活性氧(reactive oxygen species, ROS)的动态平衡,引起植物营养缺乏、氧化胁迫和离子失衡等一系列问题,已成为限制设施园艺作物正常生长发育的重要环境胁迫因子之一[1-2]。Varga 等[3]发现当植物受到盐胁迫时,抗氧化酶系统保护细胞免受过量产生的ROS 的伤害;Cappetta 等[4]和Møller 等[5]研究发现植物中蛋白酶通过水解蛋白质产生的多肽分子,调节植物受胁迫下的ROS 信号传导,保证植物在盐胁迫下的生长发育。研究进一步发现在高盐胁迫下植物的蛋白酶活性显著增加[6-7]。半胱氨酸蛋白酶(cysteine proteases, CPs)是植物蛋白酶的一个重要家族,研究发现其在蛋白质的降解和调节ROS水平中起着至关重要的作用[8-9]。Deng 等[10]发现盐胁迫下,苜蓿的MtCP77在ROS 积累、PCD 和根瘤衰老过程中发挥关键作用。Rodríguez-Herva 等[11]研究表明,烟草半胱氨酸蛋白酶HopN1 可以有效减少盐胁迫下叶绿体中ROS 的积累。
目前,CPs 家族基因的功能在辣椒中研究较少,前期研究初步发现沉默辣椒中的CaCP1可以提高辣椒的耐盐性[12],但CaCP1稳定遗传后的功能未进一步研究。本研究通过对CaCP1启动子5′端缺失GUS 表达载体的瞬时表达试验,分析CaCP1在盐胁迫下的主要转录活性片段。将辣椒CaCP1进行烟草遗传转化,以T3代转基因植株为材料,分析其在盐胁迫下的功能,为提高辣椒的抗盐性提供潜在的遗传资源。
1 材料与方法
1.1 材料
辣椒品种为‘B12’(var.grossum(L). Sendt),用于CaCP1的cDNA 序列和启动子序列的克隆,烟草‘本氏’品种(Nicotiana benthamiana)用于CaCP1启动子的瞬时表达,烟草‘百日红’品种(NicotianatabacumL.)用于CaCP1的遗传转化,以上材料均由河南农业大学园艺学院设施栽培研究课题组提供和保存。
1.2 方法
1.2.1CaCP1启动子GUS 表达载体构建及其烟草瞬时表达 构建CaCP1启动子5′端缺失GUS 表达载体,将基因的转录起始位点指定为-1,从辣椒基因库中获得上游区域(2 086 bp,-2 086--1 bp),利用PlantCARE(http://bioinformatics.psb.ugent.be/webtools/PlantCARE /html/)预测CaCP1启动子的逆境顺式作用元件。根据顺式作用元件的位置,将CaCP1启动子片段分为4 段(-2 086、-1 540、-980 和-410--1 bp),分别设计包含EcoR Ⅰ和SalⅠ酶切位点的扩增引物(表1),将其分别与植物表达载体pCAMBIA 1381-GUS(图1-A)连接。经双酶切验证后,送上海生工生物公司测序。
用冻融法将p1381、p1381-35S 和CaCP1启动子质粒(p1381-P1、p1381-P2、p1381-P3 和p1381-P4)分别转化到农杆菌GV3101[13]。将含有不同长度启动子片段的转化菌液,用无菌注射器以全叶片注射方式接种6-8 周龄的本氏烟草叶片(除生长点的叶片),置于人工气候箱,18℃黑暗培养2 d,具体方法参照Xu 等[14]和Yang 等[15]。
1.2.2CaCP1植物超表达载体PVBG2307-CaMV35SCaCP1 的构建及其烟草的遗传转化 设计包含XbaI和KpnI 酶切位点的引物(表1),PCR 扩增得到完整CaCP1的ORF 序列,将其与PVBG2307-GFP 连接,构建PVBG2307-CaMV35S-CaCP1植物表达载体(图1-B),用冻融法将PVBG2307-CaMV35S-CaCP1转化农杆菌GV3101[11]。用叶盘法进行烟草的遗传转化,具体方法参照Yin 等[16]和Hoekema 等[17]。
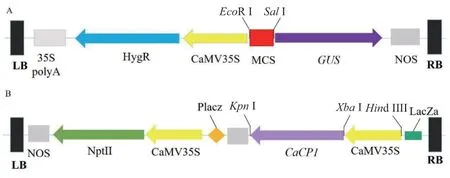
图1 载体示意图Fig. 1 Schematic of vectors

表1 本文中的引物碱基序列Table 1 Primer base sequences used in this study
1.2.3 瞬时表达和转基因烟草植株的盐胁迫处理本氏烟草暗培养2 d,150 mmol/L NaCl 溶液浇透基质,对照烟草不做任何处理,继续在培养箱内正常生长,24 h 后取样,一部分鲜样直接进行GUS 染色,另取一份叶片液氮速冻后-80℃保存,用于GUS的定量表达。
为研究盐胁迫对转基因烟草植株的影响,将T3转基因植株和野生型植株均播种于基质中,待长至两叶一心,从基质中拔出洗净根系后转入1/4 霍格兰氏营养液继续培养,待培养至6-8 片真叶时,分别加入200 mmol/L NaCl 溶液进行胁迫处理,观察叶片的表型变化,并在处理0、1、6 和12 d 后收集第3、4 节位的叶片,一部分样品液氮速冻后-80℃保存,用于测定烟草胁迫相关基因的定量表达或生理相关指标(SOD、POD 和CAT 活性,以及脯氨酸和MDA的含量),一部分鲜样用于叶绿素含量、相对含水量和电导率的测定。试验设置3 个重复。
1.2.4 烟草叶片GUS 组织化学染色及GUS定量分析 分别取3 片注射含有不同长度CaCP1启动子菌液的烟草叶片,剪切成细条(1-3 mm)混合,加入GUS 染色液(Coollaber 公司),完全浸没样品,30℃黑暗过夜。将叶片转至75%乙醇中,68℃水浴脱色,期间更换4-5 次洗脱液,直至阴性对照材料呈白色。以注射含有不同长度CaCP1启动子菌液的烟草叶片为材料,提取RNA,根据GUS片段设计定量引物,运用实时荧光定量PCR 分析GUS的表达量。
1.2.5 总RNA 提取、cDNA 第一链的合成和RTqPCR 分析 按照Trizol 试剂盒(TaKaRa, Japan)说明书提取总RNA,利用琼脂糖凝胶电泳检测RNA完整性。按照反转录试剂盒PrimeScriptTMKit 的说明书合成cDNA 第一链。用ddH2O 稀释其浓度为50-60 ng/μL,用于CaCP1的RT-qPCR 分析。利用2-ΔΔCT阈值比较法计算基因的相对表达量。
1.2.6 转基因株系盐胁迫下的生理相关指标测定和胁迫相关基因的表达分析 参考Arkus 等[18]方法测定叶绿素含量,参考Guo 等[19]方法测定丙二醛(malonaldehyde, MDA)含 量,参 考Sade 等[20]方法测定叶片的相对含水量(RWC),参照Zhou等[21]方法测定烟草叶片的电解质渗透率(EC)。参考Irigoyen 等[22]方法测定脯氨酸含量。分别参考Zhang 等[23]、Beauchamp 等[24]、Ranieri 等[25]方法测定CAT 含量、SOD 含量和POD 含量。
利用RT-qPCR 方法检测烟草胁迫相关基因NtCAT、NtSOD、NtAPX、NtLEA5、NtNHX1、NtPOX2、NtP5CS1和NtSOS1的表达,以NtActin为内参基因,引物如表1 所示。
1.2.7 数据分析 运用Excel 2010 进行数据处理,利用DPS7.5 软件进行方差分析,用SigmaPlot 14.0软件作图。
2 结果
2.1 CaCP1启动子顺式作用元件分析
为了研究CaCP1的转录调控特性,鉴定CaCP1起始密码子上游2 086 bp 启动子序列中的顺式调控元件,并利用PlantCARE 数据库进行分析。生物信息学分析表明,该区域存在一些在不同植物中已知的调节逆境和防御基因表达的顺式作用元件。这些元件包括4 个响应盐胁迫的顺式作用元件GT-1、5个响应干旱胁迫的顺式作用元件MYC、7 个响应光反应的顺式作用元件Box4 和G-box、1 个参与防御和胁迫响应的顺式作用元件TC-rich repeats。除了含有与胁迫相关的顺式作用元件,CaCP1启动子序列中含有与激素有关的顺式作用元件,2 个脱落酸(ABA)响应元件ABRE、1 个水杨酸反应元件TCAelement 和1 个生长素响应元件TGA-element。此外,17 个启动子增强区域的顺式作用元件CAAT-box 分布在整个CaCP1启动子区域中(图2)。
利用辣椒基因组序列信息克隆CaCP1的2 086 bp 启动子序列,根据CaCP1启动子中预测的相关作用元件,构建不同长度启动子片段的重组载体(图2),为寻找CaCP1启动子序列中响应盐胁迫的区域而进行启动子5′片段缺失试验。
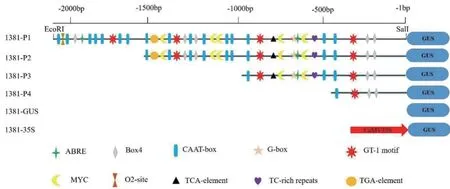
图2 CaCP1 启动子顺式作用元件分析Fig. 2 cis-elements analysis in the promoter regions of CaCP1
2.2 CaCP1启动子5′缺失表达载体的瞬时表达
将含有不同长度启动子片段表达载体转化烟草,对不同转基因植株的烟草叶片进行染色以及GUS的表达量进行检测(图3),结果发现,阳性对照植株1381-35s 叶片经GUS 染色后表现为深蓝色,并呈现极高的GUS表达水平,P2、P3 和P4 在未经处理后GUS 染色后表现出蓝色,且P4 的GUS表达水平略高于阴性对照。盐处理后,P1、P2、P3 和P4 的烟草叶片经GUS 染色后均表现出蓝色,且蓝色程度高于对照,P2、P3 和P4 的GUS表达水平均明显高于对照。其中,P4 的烟草叶片蓝色最深,且P4 的GUS表达水平是阴性对照的11 倍。
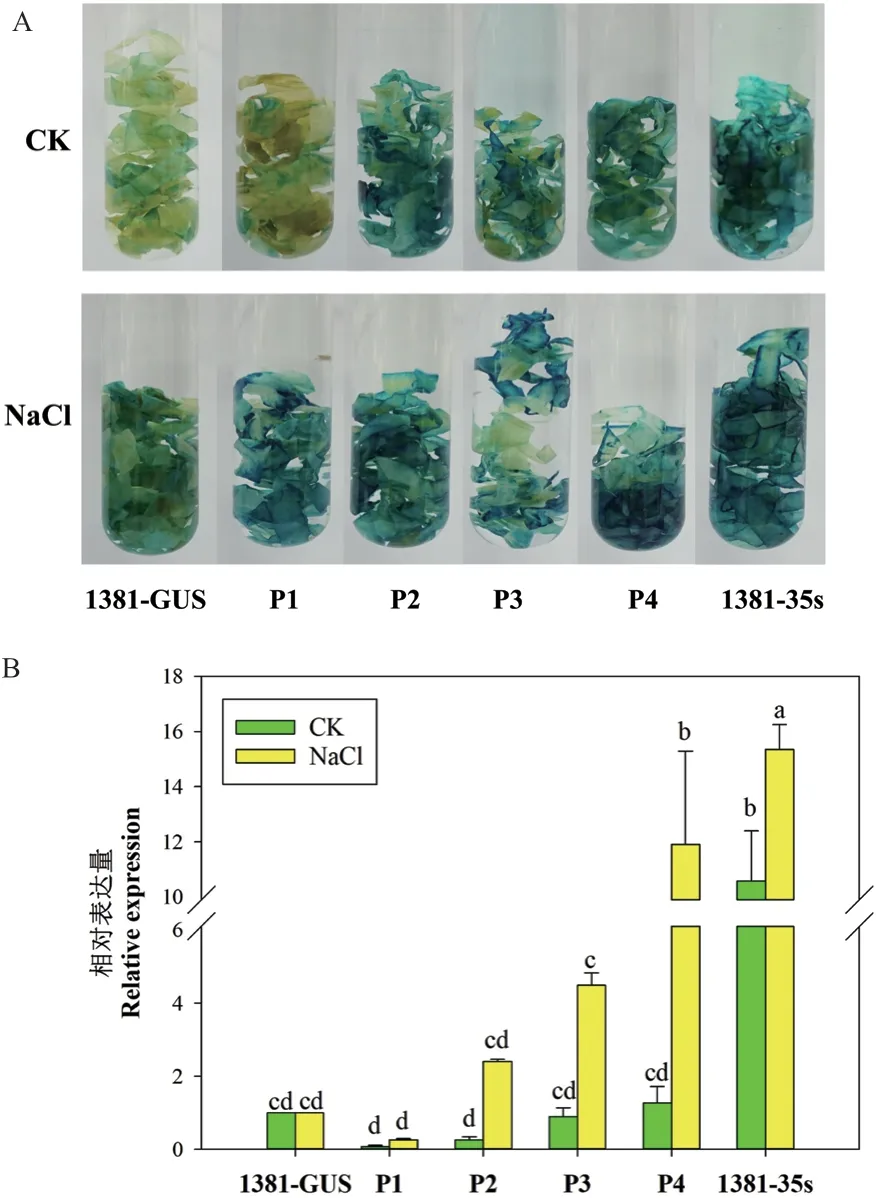
图3 CaCP1 启动子活性分析Fig. 3 Activity analysis of promoter of CaCP1
综上所述,CaCP1启动子不同区段均可响应盐胁迫,但其P4 启动子片段对盐胁迫的响应最为强烈,故P4 区段可能对于辣椒盐胁迫反应过程中CaCP1的转录激活有重要作用。
2.3 35S-CaCP1转基因植株在盐胁迫下的表型分析
为进一步研究CaCP1对盐胁迫的响应作用,构建过表达载体PVBG2307-CaMV35S-CaCP1转化烟草植株。用200 mmol/L NaCl 溶液处理T3代转基因烟草和野生型株系(图4)。在未处理前,35S-CaCP1-5-2-5、35S-CaCP1-19-6-17 和WT 表型无差异。盐处理6 d 后,三者叶片均出现皱缩,下层叶片有黄化现象,且35S-CaCP1-5-2-5、35S-CaCP1-19-6-17 株系的叶片萎蔫和黄化程度较重。盐处理10 d 后,转基因株系除最上部的幼叶呈绿色外,其他叶片均变为黄色,且下部叶片边缘已出现坏死症状。对照植株的叶片皱缩,下部老叶呈黄色,而上部叶片依然保持绿色。结果表明,CaCP1过表达烟草株系对盐胁迫响应更敏感。

图4 盐处理后35S-CaCP1 转基因烟草的表型Fig. 4 Phenotypes of 35S-CaCP1 transgenic tobacco plants after salt treatment
2.4 35S-CaCP1转基因植株盐胁迫下叶绿素、MDA、相对含水量和电导率的变化
盐胁迫处理0、6 和12 d 时,分析35S-CaCP1过表达转基因和野生型叶片的叶绿素、MDA、相对含水量和电导率的变化(图5),处理前,除35S-CaCP15-2-5 株系的电导率显著高于野生型外,其余指标在转基因和野生型间无显著性差异。随着盐胁迫处理时间的延长,转基因和野生型株系叶片的叶绿素含量和相对含水量均逐渐降低,且转基因株系降低幅度显著大于野生型。MDA 和电解质渗漏率呈上升趋势,且转基因株系的上升幅度显著高于野生型。转基因株系间的叶绿素、MDA、相对含水量和电导率无显著性差异。
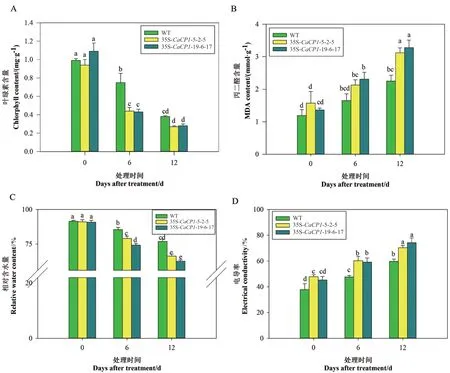
图5 盐胁迫下35S-CaCP1 转基因和野生型株系的叶绿素含量、MDA 含量、相对含水量和电导率Fig. 5 Chlorophyll, MDA, relative water content and electrical conductivity of 35S-CaCP1 transgenic tobacco plants under salt stress
2.5 CaCP1转基因植株盐胁迫下抗氧化酶和脯氨酸含量的变化
为进一步分析盐胁迫对CaCP1超表达的影响,测定转基因和野生型叶片在0、6 和12 d 后的抗氧化酶和脯氨酸含量(图6)。处理前,转基因植株叶片CAT 活性显著低于野生型,SOD 活性显著高于野生型,且2 个转基因株系无显著性差异。与0 d 时比较,随着盐胁迫处理后,转基因株系和野生型的CAT 活性显著下调,12 d 后分别下调1.38、1.35 和1.58倍。野生型的SOD 活性在盐处理6 d 时上调,12 d下调,转基因株系的SOD 活性一直显著下调,盐处理12 d 后,分别下调5.12 和3.37 倍,且转基因株系的CAT 和SOD 活性降低幅度大于野生型。转基因株系和野生型POD 活性随着盐处理而逐渐增加,且转基因株系上调的幅度显著高于野生型,尤其在12 d 时,高于对照2.54 和2.64 倍。

图6 盐胁迫下35S-CaCP1 转基因和野生型株系的CAT、SOD、POD 酶活性和脯氨酸含量Fig. 6 CAT activity, SOD activity, POD activity, and proline content of 35S-CaCP1 transgenic tobacco plants after salt treatment
处理前,转基因株系和野生型叶片的脯氨酸含量无差异,35S-CaCP1-15-2-5 转基因株系和野生型叶片的脯氨酸含量在盐处理6 d 时增加,12 d 减少,但35S-CaCP1-15-2-5 转基因株系的脯氨酸含量变化的程度显著低于野生型,且35S-CaCP1-19-6-17 转基因叶片的脯氨酸含量在盐处理后一直上调,且在12 d 显著高于野生型。
2.6 盐胁迫下CaCP1转基因植株抗氧化酶基因的表达水平变化
为进一步分析转基因和野生型烟草中的抗氧化酶活性在盐胁迫下的变化,运用RT-qPCR 测定株系中抗氧化酶基因NtCAT、NtSOD、NtAPX和NtPOX2的表达水平(图7)。与0 h 时野生型的表达水平相比,盐处理24 h 后,野生型株系的NtCAT、NtSOD、NtAPX和NtPOX2的表达水平分别上调1.37、10.76、96.34 和11.55 倍,转基因株系的NtCAT的表达水平分别下调0.59 和0.77 倍,而NtSOD、NtAPX和NtPOX2的表达水平分别上调5.17 和6.38 倍、12.52和37.87 倍、5.17 和6.93 倍。NtCAT在 转 基 因 株系中的抑制程度大于野生型,NtSOD、NtAPX和NtPOX2在转基因株系中的上调量显著低于野生型。
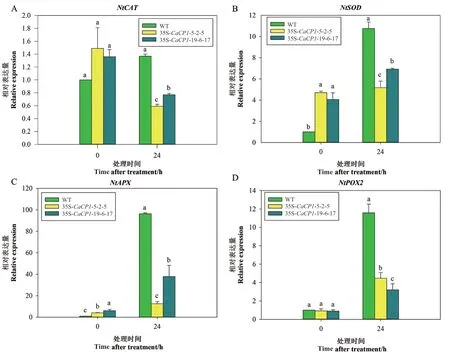
图7 盐胁迫下35S-CaCP1 转基因和野生型株系抗氧化酶相关基因的表达变化Fig. 7 Expression profiles of antioxidant-related genes in 35S-CaCP1 transgenic tobacco plants and wild plants after salt treatment
2.7 盐胁迫下CaCP1转基因植株胁迫相关基因的表达水平变化
为了进一步分析盐胁迫下CaCP1转基因植株的受胁迫程度,检测野生型和转基因烟草中的胁迫相关基因NtLEA5、NtNHX1、NtP5CS1和NtSOS1的表达水平发现,经盐处理24 h 后,野生型植株中的NtLEA5、NtNHX1、NtP5CS1和NtSOS1均呈现大幅度的上调表达,分别上调5.36、5.82、288.05 和17.08 倍,转基因烟草中的NtLEA5和NtP5CS1的表达也显著增强,分别上调1.35 和2.68 倍、40.42 和137.82 倍,但上调幅度显著小于野生型。转基因烟草中的NtNHX1和NtSOS1表达出现小幅度的上调,分 别 为1.77 和1.50 倍、3.43 和4.10 倍。盐 处 理后,转基因株系的NtLEA5、NtNHX1、NtP5CS1和NtSOS1的表达水平都显著低于野生型(图8)。
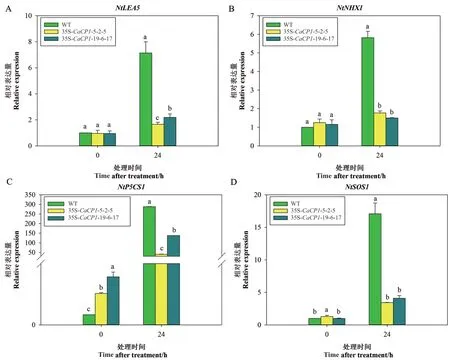
图8 盐胁迫下35S-CaCP1 转基因和野生型株系胁迫相关基因的相对表达量变化Fig. 8 Relative expression profiles of stress-related genes in 35S-CaCP1 transgenic tobacco plants and wild plants after salt treatment
3 讨论
在植物中,CPs 参与盐胁迫。如拟南芥AtRD21A和AtRD19A,在盐胁迫的诱导下表达量增高[26]。在NaCl 处理的豌豆幼苗中,Cyp15a的转录水平增加[27]。在盐胁迫下,小麦PLCP 基因(TaCP)表达上调[28]。拟南芥中SPCP2的过表达增强了对盐胁迫的抗性[29]。水稻中的CPs 基因LOC_Os01g73980、LOC_Os02g27030 和LOC_Os05g01810 的表达也被盐胁迫高度激活[30]。在之前的研究中,盐胁迫可促进CaCP1显著上调表达[12],为了研究辣椒在盐胁迫下如何调控CaCP1的表达,本研究首先克隆了CaCP1的2 086 bp 启动子,并在其中识别了几个顺式调控元件,这些元件被预测会响应信号分子和环境胁迫。随后,对CaCP1启动子进行了缺失分析,通过农杆菌介导的烟草叶片瞬时表达,确定盐胁迫应答的主要启动子区域。本研究获得的瞬时表达结果显示,NaCl 处理显著诱导CaCP1启动子的缺失片段P2、P3 和P4,且启动子缺失片段P4 的GUS定量高于其他缺失片段。表明410 bp(P4)段可能含有非生物胁迫诱导的顺式作用元件。在CaCP1启动子中发现了4 个GT-1 motif,它是一个参与响应盐胁迫顺式作用元件[31]。结果表明,启动子缺失片段P4 上的GT-1 motif 可能对于调控CaCP1在盐胁迫下的表达发挥主要作用。
为了更好地了解CaCP1的功能,用T3代CaCP1过表达烟草转基因植株进行盐处理,并测定其叶绿素含量和相对含水量发现,CaCP1转基因株系和野生型株系叶片的叶绿素和相对含水量均显著低于野生型。前人研究得知叶绿素含量和相对含水量与植株的受损伤程度成反比[32],本研究结果表明,过表达CaCP1加剧了植株在盐胁迫下的损伤程度。基于转录组分析发现,缺失或过表达CPs 基因,如AtCEP1、HvPAP14等能诱导植物光合基因表达变化[33-34]。此外,细胞质中的CPs 影响叶绿素含量[35]。MDA 一般用于评价植物高盐胁迫下ROS 介导的脂质过氧化程度[36]。盐处理下,CaCP1转基因株系和野生型的MDA 和电解质渗漏率呈上升趋势,且转基因株系的上升幅度显著高于野生型。结果表明,CaCP1过表达提高植株脂质过氧化程度,即胁迫程度增加。这与HpXBCP3的过表达可增加雨生红球藻对NaCl 胁迫的敏感性一致[37]。
脯氨酸在植物遭受土壤盐分引起的高渗透胁迫时起着保护渗透的作用,据报道NtP5CS1参与了脯氨酸在盐胁迫下的生物合成[38]。盐处理6 d后,转基因株系的脯氨酸含量显著低于野生型,而NtP5CS1在盐处理24 h 的表达量低于野生型,而盐处理12 d 后,转基因株系的脯氨酸含量略高于野生型,证明CaCP1基因提高了植株对盐胁迫的敏感性。
在处理前和盐胁迫下,CaCP1过表达转基因植株ROS 清除酶活性(CAT、SOD 和POD)与野生型相比有极大的差异。其中转基因株系的CAT 和SOD活性显著低于野生型,POD 活性显著高于野生型。盐胁迫对CAT、POD、SOD 等抗氧化酶均有显著的提高作用,表明清除活性氧是棉花耐盐机制的重要组成部分[39],但是楝树幼苗的POD 活性呈上升趋势并且随着盐浓度的增加而下降[40],推测是由于POD 既能消除ROS,也可以促进ROS 的生成而引起的[41]。此外,在CaCP1过表达植株中,NtCAT、NtAPX、NtSOD和NtPOD2等抗氧化酶基因的低表达会降低这些酶的活性,从而减弱对盐胁迫的耐受性。以上结果表明,转基因烟草中CaCP1的过表达主要导致活性氧清除基因/酶CAT 和SOD 水平降低,提高CaCP1过表达植株对盐胁迫的敏感性。
当植物遭受盐胁迫时,许多信号通路被激活,如逆境应答基因SOS、NHX1、P5CS和LEAs的表达[42-45]。AlSRG1转基因烟草在盐胁迫或渗透胁迫之后,NtSOS1和NtNHX1的转录水平显著增加,提高了AlSRG1转基因烟草的抗性[46]。干旱和盐胁迫下,与野生型相比,NtP5CS1、NtSOS1和NtNHX4的表达水平上调,TaGF14b转基因烟草通过调节逆境应答基因表达改善非生物胁迫的耐受性[47]。NtLEA5和NtP5CS1高度上调表达也提高转基因烟草的抗盐性[48-49]。本研究中,转基因植株的NtLEA5、NtNHX1、NtP5CS1和NtSOS1等胁迫相关基因在盐胁迫下的表达量显著低于野生型,说明CaCP1的过表达降低了植株的抗盐性。
4 结论
CaCP1的启动子缺失片段-410- -1 bp 对于调控CaCP1在盐胁迫下的表达具有较高的转录活性,CaCP1的过表达提高植株对盐胁迫的敏感性,CaCP1在调节植物盐胁迫应答方面起重要作用。

