姜黄素光动力技术对扩展青霉生长及分泌棒曲霉素的抑制效果
庞甲雷,张芳
(中国海洋大学食品科学与工程学院,山东青岛 266003)
扩展青霉是苹果、梨果和柑橘等水果贮运及销售环节的主要病原真菌之一,普遍存在于空气和土壤中, 环境适应性极好,在温度25 ℃、湿度90%的环境下生长最为旺盛。扩展青霉侵染水果可引发青霉病,并伴随产生具有细胞毒性、遗传毒性的次级代谢产物棒曲霉素,降低水果品质[1],损害机体健康[2]。因此,亟需针对扩展青霉诱发水果病害和毒素分泌情况,开发新型靶向杀菌技术,保证水果产业的健康可持续发展。
光动力技术的原理是依靠可见光、光敏剂及氧气,通过诱导细菌、真菌等微生物细胞内氧化失衡而引发细胞死亡[3]。以姜黄素、核黄素、叶绿素等天然植物提取物作为外源光敏剂的光动力技术,在食品领域应用前景广阔[4]。其中,姜黄素是南非、印度等国家主要的食品着色剂,其具有光敏活性,经420 nm蓝光激发,可通过能量传递和/或电子转移产生ROS,进而导致细胞膜及细胞内生物大分子如蛋白质、脂质及核酸等发生不可逆性氧化损伤,最终诱发微生物死亡[5]。
姜黄素介导的光动力技术已被证明能灭活食品基质表面细菌,如鲜切梨[6]和鸡皮[7]上的单增李斯特菌;同时有效延长鲜枣[8]、哈密瓜[9]、银耳[10]和草莓[11]等食品保质期。此外,该技术可有效抵抗真菌病害,如抑制食品中黄曲霉[12]及灰霉孢子[13]生长,控制苹果青霉病[14]、灰霉病[15],然而光动力技术对毒素消减与控制的研究尚未报道。因此,本文将从体外及活体实验探究姜黄素介导的光动力技术对扩展青霉生长及棒曲霉素分泌的抑制效果,为进一步开发果实抑菌保鲜技术提供研究基础。
1 材料与方法
1.1 材料与试剂
扩展青霉菌株,本实验室从腐烂苹果中分离纯化并鉴定得到;红富士苹果,同批次采购于山东省烟台市福山区苹果种植户,选取成熟度相似、大小均一且无损伤的苹果用于实验;马铃薯葡萄糖琼脂(PDA)、查氏液体(CY)培养基,北京陆桥技术股份有限公司;棒曲霉素标准品(纯度:99.7%),上海源叶生物科技有限公司;乙腈和冰乙酸(色谱级),德国Merck公司;果胶酶,北京索莱宝科技有限公司;其余试剂均为国产分析纯。
1.2 仪器与设备
YXQ-LS-100A立式压力蒸汽灭菌器、BMJ-250C霉菌培养箱、ZQTY-70S振荡培养箱,上海博讯实业有限公司医疗设备厂;HCB-900V洁净工作台、HYC-390冷藏箱,青岛海尔电器有限公司;Legend Micro 21R微量离心机、ST 16R高速离心机,赛默飞科技(中国)有限公司;Agilent-1260高效液相色谱仪(HPLC),美国安捷伦科技有限公司。
1.3 实验方法
1.3.1 培养基和试剂配制
PDA培养基:称取40 g PDA粉末加入0.8 L蒸馏水,超声水浴辅助溶解,定容至1 L,灭菌备用。CY培养基:称取35 g CY粉末加入0.8 L蒸馏水,再加入5.0 g酵母提取物,超声水浴辅助溶解,调pH值为5.2,定容至1 L,灭菌备用。棒曲霉素标液:乙腈(色谱纯)溶解5 mg棒曲霉素标准品,定容至5 mL,制得1 mg/mL标准溶液,棕色小瓶分装后冷藏待用。乙酸水溶液:冰乙酸(色谱纯)调整水溶液pH值至4.0,定容至1 L后备用。姜黄素储备液:称取粉末36.8 mg置于50 mL烧杯,分别加入1 mL的吐温80和二甲基亚砜,超声水浴辅助溶解,定容至0.1 L,得到1 mol/L母液冷藏备用。实验时,蒸馏水稀释至所需浓度。
1.3.2 菌种活化和菌丝制备
接种扩展青霉孢子至PDA平板,温度25 ℃、湿度90%霉菌培养箱中倒置7 d。小心刮取生理盐水预孵育的孢子,以平板计数法,生理盐水调节孢子悬液至1×107CFU/mL,移取1 mL等份添加到20 mL CY培养基,25 ℃ 130 r/min 培养3 d,获得大小均一的球状菌丝。
1.3.3 固体再培养生长情况
裁剪透析玻璃纸为1×1 cm,捆扎后灭菌。将玻璃纸置于PDA平板,确保两者之间无气泡,接种菌丝球,温度25 ℃、湿度90%霉菌培养箱中倒置培养,每天3次测量菌落直径并拍照观察。结束后,分离玻璃纸与培养基,称重3次并记录。
1.3.4 棒曲霉素检测
棒曲霉素标液:于40 ℃的氮吹仪中吹干标液,乙酸水溶液梯度稀释制作标曲,0.22 μm孔过滤,注入高效液相色谱仪的C18柱20 μL溶液,重复3次,每次3次平行。
参照Li等[16]的方法,使用5 mL乙酸水溶液孵育固体培养基表面菌丝30 min,充分溶解固体培养基中棒曲霉素;收集病斑处果实,均质10 min确保果肉和果皮均一,转移果浆至50 mL离心管后5 000 r/min离心10 min,提取苹果中棒曲霉素,移取1 mL上清液与1.5 mg果胶酶粉末混匀,静置5 min,确保果胶降解以防堵塞C18柱,离心过滤后高效液相色谱仪分析,重复3次。高效液相色谱仪的洗脱条件:流动相为水和乙腈(90:10,V/V),0.5 mL/min流速等度洗脱,柱温30 ℃,检测波长276 nm。
1.3.5 不同姜黄素浓度处理扩展青霉菌丝
本实验室设计了由420 nm发光二极管阵列组成的多功能光源仪。单因素实验中使用50 W功率 (0.275 W/cm2能量),方程(1)计算光剂量:
式中:
E——剂量,单位J/cm2;
P——功率,单位W/cm2;
t——时间,单位s。
将50、100、200、300 μmol/L浓度的姜黄素溶液和菌丝球置于96孔板中,黑暗孵育30 min后置于光源仪中(时间20 min,功率50 W)。处理后,生理盐水洗去多余姜黄素,接种菌丝球至覆盖玻璃纸的PDA平板中培养5 d,以菌落直径、菌丝质量、棒曲霉素含量为指标,评价菌丝在固体培养基上再培养的生长情况,重复3次。未光照及未添加姜黄素样本设为对照组(L-P-),其中,L:光照;P:光敏剂(姜黄素),-:未光照或未添加;+:光照或添加。
1.3.6 不同姜黄素浓度处理接种扩展青霉菌丝的苹果
光动力处理苹果流程图(图1)。2%次氯酸钠溶液消毒红富士苹果,无菌台晾干,在正反面赤道周围3×5 mm人为处理伤口并接种等量菌丝球。光动力处理组,以50、100、300 μmol/L浓度姜黄素溶液孵育30 min,光源仪中40 W照射20 min。随后将苹果置于长、宽、高30×20×10 cm塑料箱,温度25 ℃、湿度90%霉菌培养箱培养10 d,第4、6、8天以十字交叉法测定病斑直径,第10天测量病斑质量及棒曲霉素含量。结果以病斑/果实质量作为病斑比重表示果实病害程度。每组10个果实,重复3次。
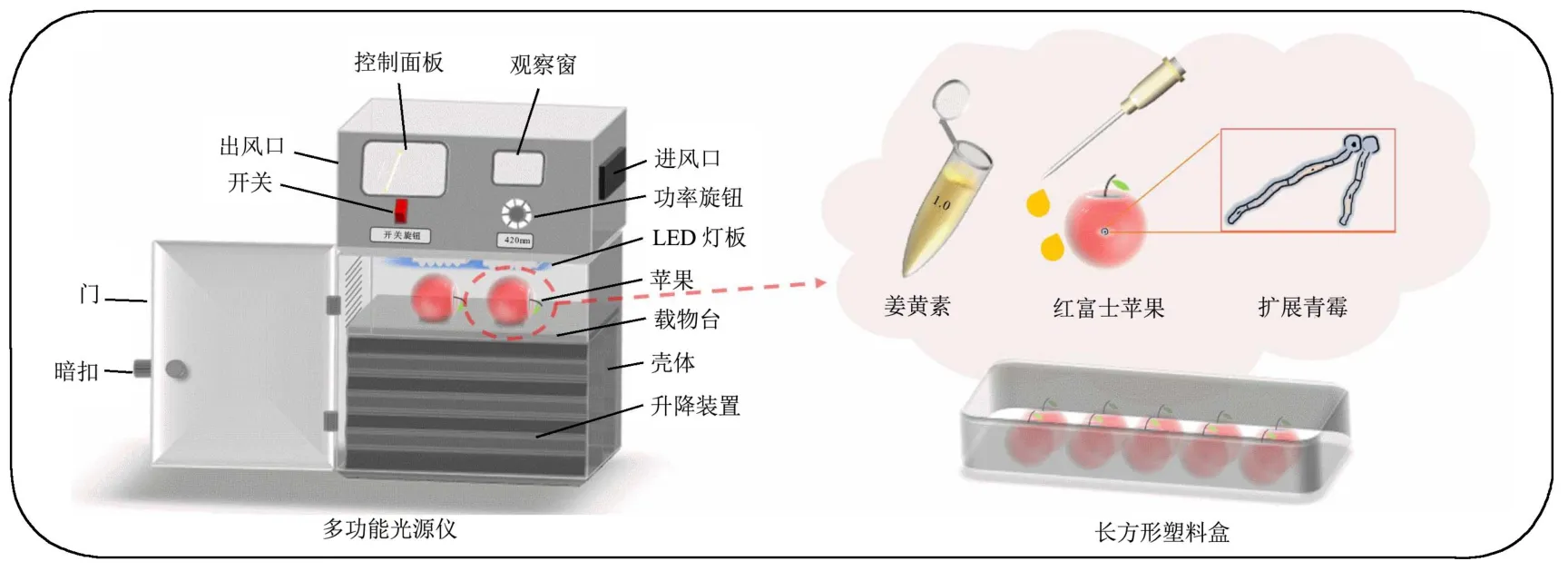
图1 姜黄素光动力处理接种扩展青霉菌丝的苹果流程图Fig.1 Flow chart of CUR-PDT treatment of apple inoculated with P.expansum mycelium
1.4 数据分析
SPSS18.0软件分析实验数据,结果以平均值±标准差(n≥3)表示。Origin Lab(Origin Pro 8.0)软件分析方差(ANOVA),P<0.05认为存在显著性差异。
2 结果与分析
2.1 不同培养时间对扩展青霉菌丝生长及PAT分泌的影响
探究菌丝球在固体培养基再培养的生长与棒曲霉素分泌的关系,由图2可知,菌落呈规则圆盘状,其直径、菌丝质量、棒曲霉素含量均与培养时间呈正相关。营养充足时,菌丝生长旺盛伴随棒曲霉素分泌量增大;在第5~6天产毒期,棒曲霉素由6.58 μg/mL大幅上升至43.02 μg/mL,这与葡萄糖、蔗糖等碳源含量减少有关[17],而菌落直径与菌丝质量仍缓慢增长,分别为0.25 cm和103.63 mg。同时图2明显观察到6 d后菌丝表面出现绿色孢子,且平板呈现深褐色,这可能与有机酸的分泌或利用NH4+将其表面pH降至3.6~4,以使采后果实有利于自身生长有关[18]。因此选择第5天作后续实验条件。
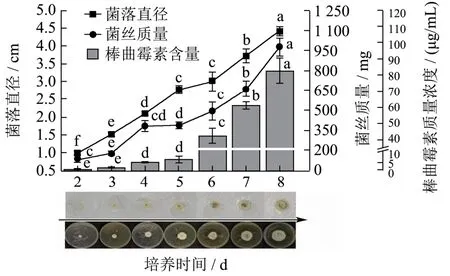
图2 球状菌丝在固体培养基中再培养后菌落直径、菌丝质量及PAT含量Fig.2 The diameter of colony, the weight of mycelium, and the content of PATafter the spherical mycelium
2.2 不同姜黄素浓度对扩展青霉菌丝的生长抑制
观察光动力处理后培养5 d的菌丝,显示仅添加姜黄素处理组菌落直径和菌丝质量轻微抑制(图3)。有研究表明低剂量姜黄素、短时间处理不会因诱导灰霉菌细胞内产生ROS而抑制生长[19]。仅光照处理组菌落直径下降约28.14%,菌丝质量下降约47.37%,表明纯光照可轻微抑制菌丝生长;不同姜黄素浓度的光动力处理组(0.275 W/cm2)均显著抑制菌丝生长,其菌落直径与菌丝质量分别降低0.84 cm、68.37 mg。我们前期发现光动力技术显著抑制扩展青霉孢子活力,且与姜黄素浓度呈正相关[14],本研究进一步表明光动力技术对菌丝抑菌效果良好,但与姜黄素浓度关系不大。

图3 不同姜黄素浓度对菌丝生长的影响Fig.3 Effects of different CUR concentrations on mycelial growth
2.3 不同姜黄素浓度对PAT的分泌抑制
外源ROS可抑制扩展青霉生长,降低毒素分泌[20]。图4a显示4.80 min为棒曲霉素的出峰时间,且峰面积差异显著,图4b表明棒曲霉素分泌抑制与菌落直径和菌丝质量相关,仅光照处理组不显著,抑制率仅为28.86%。类似研究发现未光敏化的姜黄素抑菌效果较差,0.125~2 mg/mL姜黄素浓度对曲霉菌生长和黄曲霉毒素B1抑制率在26.6%~94.9%[21]。与阴性对照组相比,仅光照组棒曲霉素分泌量为5.48 μg/mL,而 300 μmol/L姜黄素介导的光动力处理组为2.01 μg/mL,抑制率达83.85%,证明光动力处理可以显著抑制菌丝的棒曲霉素分泌。
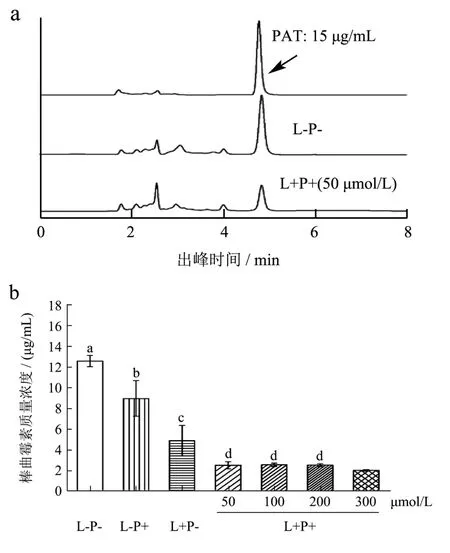
图4 不同姜黄素浓度对菌丝分泌PAT的影响Fig.4 Effects of different CUR concentrations on PAT secretion by mycelium
2.4 光动力对苹果青霉病的控制
利用苹果载体探究光动力技术应用的可行性发现姜黄素浓度与病斑直径抑制率呈正比例,表明苹果载体比体外效果更佳(图5)。延长贮藏时间,300 μmol/L姜黄素介导的光动力处理组是阴性对照组平均病斑直径的49.38%,且病斑表面孢子数量极低,进一步证明光动力处理可显著抑制菌丝生长及孢子产生。我们前期发现500 μmol/L姜黄素有效控制苹果灰霉病害[15],本研究证明果实青霉病害对光动力处理更为敏感。
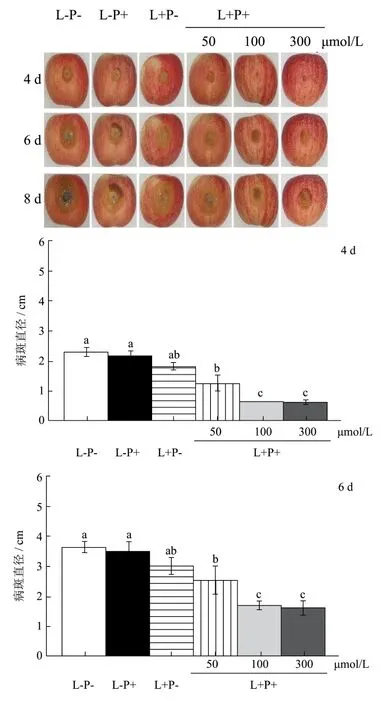

图5光动力对苹果青霉病的控制效果Fig.5 Inhibition effect of photodynamic treatment on apple disease
2.5 光动力对苹果载体PAT分泌的抑制
检测果实病斑处棒曲霉素的分布,发现赤道中央向外1 cm处棒曲霉素较高;1~2 cm处棒曲霉素较低;2~2.5 cm处仍可有微量棒曲霉素(图6a),表明食用剔除腐烂组织的果实仍存在安全风险。图6b显示对照组与仅姜黄素处理组病斑比重差异不大(0.15%),棒曲霉素仅降低30%,表明纯姜黄素无法抑制青霉病害,但低程度控制了棒曲霉素的分泌及菌丝生长。 300 μmol/L姜黄素介导的光动力处理组的病斑比重及棒曲霉素分别为0.09%、18.02%,显著低于阴性对照组,证明光动力处理可有效延缓果实青霉病害、降低棒曲霉素的分泌。
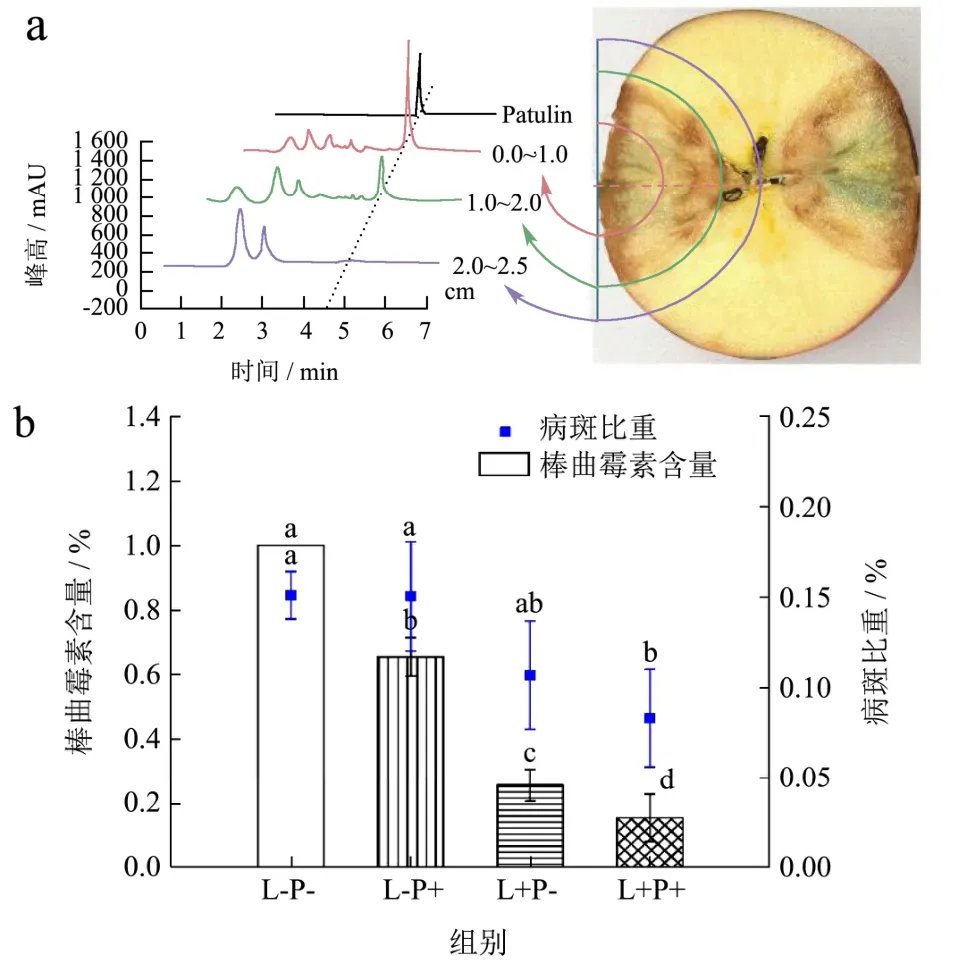
图6 光动力对苹果PAT分泌抑制效果Fig.6 Effect of photodynamic treatment on inhibition of PAT secretion in apple
3 结论
本文利用多功能光源仪探究了姜黄素介导的光动力技术对扩展青霉分泌棒曲霉素的影响。结果表明,扩展青霉菌丝在固体培养基再培养后,其菌落直径、菌丝质量、棒曲霉素含量均与培养时间呈正相关,且低浓度姜黄素介导的光动力处理(0.275 W/cm2光剂量)就显著抑制菌丝生长,减少棒曲霉素分泌。此外,光动力处理能有效控制苹果青霉病害,同时显著降低棒曲霉素的分泌。综上,本研究证明了光动力技术可有效防控棒曲霉素污染和采后病害,为其进一步应用提供了理论基础。

