盐制巴戟天多糖结构表征及其免疫活性
赖岚玉,罗志锋,朱思阳,陶倩,黎攀,杜冰*
(1.华南农业大学食品学院,广东广州 510642)(2.无限极(中国)有限公司,广东广州 510623) (3.花安堂生物科技集团有限公司,广东广州 511500)
巴戟天为茜草科植物巴戟天(Morinda officinalisnHow.)的干燥根,全年均可采挖,其产地主要分布于广东、广西、福建、海南等地。近几年巴戟天作为保健食品原料,其功能活性物质备受大家关注。在中医理论中认为巴戟天味辛、甘,性微温,归肾、肝经,具祛风湿、强筋骨等功效[1]。现代科学也证明巴戟天具有广泛的药理和保健功能,其具有免疫调节[2]、抗骨质疏松[3,4]、抗肿瘤[5]、抗氧化[6]和抗抑郁[7]等多种生物活性,其中主要活性成分有多糖[3,4,6]、寡糖[7]、 蒽醌[8]和环烯醚萜[9]等,多糖作为巴戟天中活性成分之一[10],是一类具有功能活性的大分子物质。多糖是植物中一种功能活性物质,具有副作用小,安全性较高等特点,是功能性食品及保健食品开发的热点,近年来备受专家学者们的关注。
盐制巴戟天作为传统炮制加工的一种方式,早在宋代的《太平惠民和剂局方》中有提及“巴戟盐扬浸”。现在盐制仍然是巴戟天炮制的主要方式,《中华人民共和国药典(2020)》亦收载有盐制巴戟天[1]。关于盐制巴戟天多糖的研究还处于提取工艺以及含量测定阶 段[11]。现有的研究已经证实,多糖结构与其功能活性密切相关[12]。因此对盐制巴戟天多糖结构表征是研究其功能活性的重要一步。虽然已有人对巴戟天多糖进行结构鉴定[4,6,13,14],但是炮制前后得到多糖会有所不同。在万晓莹[15]的研究中酒制前后黄精多糖有所不同。因此对盐制巴戟天多糖进行结构表征,对巴戟天多糖结构的研究具有重要意义。
鉴于此,本研究中采用离子交换纤维素DEAE-52和葡聚糖凝胶Sephadex G100柱分离纯化得到盐制巴戟天多糖(Salt-processedMorinda officinalisnPolysaccharides,SMP)得到多糖SMP-4,测定其分子量,单糖组成和结构等并研究其免疫活性。探究SMP的结构并评价其免疫活性,为盐制巴戟天多糖的研究奠定理论基础。同时,巴戟天作为国家卫健委规定可用于保健食品的原料,对于其活性成分的研究,为巴戟天在功能性食品方面的进一步开发利用指明方向。
1 材料与方法
1.1 材料与试剂
抽芯巴戟天,广东省云浮市郁南县大方镇巴戟天市场;RAW264.7巨噬细胞,中山大学细胞库;离子交换纤维素DEAE-52(DE-52)、葡聚糖凝胶Sephadex G100等为国产分析纯;小鼠白细胞介素-1β(IL-1β)、肿瘤坏死因子-α(TNF-α)和CCK-8 ELISA试剂盒,欣博盛生物科技有限公司。
1.2 仪器与设备
Vertex 70傅立叶变换红外光谱仪,美国布鲁克·道尔顿公司;LC-20A高效液相色谱仪,日本岛津公司;Heratherm™高端微生物培养箱、Evolution 300紫外可见分光光度计、Multiskan™ FC酶标仪、Thermo Scientific™ ISQ™ 7000 GC-MS单四极杆,赛默飞世尔科技(中国)有限公司;Hei-VAP旋转蒸发仪,德国Heidolph公司;SHZ-III循环水真空泵,上海亚荣生化仪器厂。
1.3 方法
1.3.1 盐制巴戟天制备
将巴戟天去除泥土,用清水洗净,沥干待用。洗净沥干水分的巴戟天按料液比1:1(g/mL)加入2%(m/V)盐水煮60 min,捞出沥干。60 ℃热风干燥24 h,干燥后粉碎过24目筛,得干燥的盐制巴戟天粉末。
1.3.2 盐制巴戟天粗多糖提取
准确称取盐制巴戟天粉末,按料液比1:60(g/mL)加入φ=80%乙醇,80 ℃回流两次,每次2 h,过滤后取滤渣。再按料液比1:100(g/mL)加入蒸馏水,100 ℃回流提取、过滤、减压浓缩,加入4倍体积的φ=95%乙醇,4 ℃静置12 h。取沉淀加少量φ=75%乙醇溶解后,在4 000 r/min离心10 min,得到的沉淀用少量水溶解后,采用Sevage法脱蛋白质,再装入透析袋中,透析至透析液电导率≤1.5 μs/cm。透析后的多糖溶液真空冷冻干燥48 h,得到盐制巴戟天粗多糖。
1.3.3 盐制巴戟天粗多糖纯化
将盐制巴戟天粗多糖样品配制成浓度为10 mg/mL的溶液,用0.22 μm滤膜过膜处理后,上样到DE-52交换柱(Φ1.5×40.0 cm),流速为2.0 mL/min,用0.00、0.02、0.10、0.30 mol/L的NaCl溶液进行梯度洗脱,自动收集器收集分离组分(5 mL/管)。共收集到4个不同组分:SP-1、SP-2、SP-3、SP-4,苯酚-硫酸法测定收集组分的多糖含量。再使用Sephadex G100柱对含量较高的组分SP-4(Φ1.5×40 cm)进一步纯化,最后通过减压浓缩、透析脱盐和真空冷冻干燥得到纯化多糖(SMP-4)。
1.3.4 多糖结构鉴定
1.3.4.1 傅里叶变换红外光谱(Fourier Transform Infrared Spectroscopy,FT-IR)检测
在无水的条件下,将1 mg的SMP-4粉末与100 mg KBr粉末混合,充分磨成1 mm微球,用压片机压片,用Vertex 70傅立叶变换红外光谱仪在4 000~400 cm-1范围内进行扫描分析SMP-4。
1.3.4.2 单糖组成检测
参考黄晓兰等[16]的方法。精确称取100 mg SMP-4,加入8 mL的2 mol/L H2SO4,加热回流6 h,冷却后加入饱和Ba(OH)2溶液中和至中性,过滤,将滤液旋干,加入14 mg盐酸羟胺和1 mL吡啶置于90 ℃水浴加热1 h,取出冷却至室温,加入5 mL乙酸酐,再于90 ℃水浴加热1 h,冷却至室温,加入10 mL蒸馏水破坏乙酸酐。用氯仿对乙酰化产物进行萃取,经蒸馏水洗涤后,用无水硫酸钠脱水后氮吹浓缩至 1 mL,采用气相色谱质谱联用仪(GC-MS)分析,得到SMP-4的图谱。采用核糖、鼠李糖、阿拉伯糖、木糖、甘露糖、葡萄糖、半乳糖的标准品进行GC-MS分析,得到单糖标准品图谱。SMP-4通过与单糖标准品色谱图的保留时间,确定单糖组成。
GC-MS条件:色谱柱为SE-30,柱温初温100 ℃,以10 /min℃ 升温至280 ℃,载气为氦气,柱前压为70.0 kPa,分流比为10:1,进样量为1 μL。
1.3.4.3 相对分子量测定
参考黄晓兰等[16]的方法。采用高效凝胶渗透色谱(HPGPC)分析SMP-4的分子量。准确称取10 mg SMP-4用0.050 mol/L含0.05% NaN3的NaH2PO4- Na2HPO4缓冲液溶解,经0.22 μm滤膜滤过后进行HPGPC分析。根据峰面积归一化求得该多糖的相对质量分数。
HPGPC条件:流动相为0.1 mol/L磷酸缓冲溶液,流速为0.5 mL/min,进样量为20 μL溶液(质量浓度为1 g/L),色谱柱和RID的温度均保持在35.0 ℃。 1.3.4.4 甲基化检测
参考郑恒光等[17]方法,稍作修改。准确称取10 mg SMP-4加入5 mL无水二甲基亚砜溶解,再加入100 mg NaOH粉末,超声处理下直至完全溶解,冷却至室温,缓慢加入2 mL碘甲烷溶液启动甲基化反应,避光反应24 h后加入2 mL蒸馏水终止甲基化反应。再加入3 mL氯仿进行萃取,重复三次,合并萃取液,60 ℃减压旋干。加入10 mL 4 mol/L三氟乙酸,100 ℃水解2 h,再在60 ℃减压旋干,加入5 mL乙醇,减压旋干,加入2 mL蒸馏水溶解,用1% NaOH溶液将pH值调至10,加入10 mg NaBH4,再室温反应6 h。加入冰乙酸溶液将pH值调至5.5,再60 ℃减压浓缩,加入 1 mL吡啶和1 mL乙酸酐100 ℃反应1 h后加入1 mL蒸馏水终止反应。加入2 mL二氯甲烷萃取,重复三次,合并萃取液加入无水硫酸钠干燥过膜备用。
GC-MS条件:色谱柱为HP-5石英毛细管柱,柱温初温150 ℃,以10 /min℃ 升温至280 ℃,载气为氦气,分流比为50:1,进样量为1 μL。
1.3.4.5 核磁共振波谱(Nuclear Magnetic Resonance Spectroscopy,NMR)检测
准确称取10 mg SMP-4溶解于600 μL D2O, 3 000 r/min离心10 min,取上清液于核磁管中,用500 Hz核磁共振波谱仪检测1H-NMR信号和13C-NMR信号。
1.3.5 巴戟天多糖免疫活性研究
1.3.5.1 细胞培养
参考于弋涵等[18]方法,稍作修改。RAW264.7巨噬细胞采用添加了10%胎牛血清的DMEM完全培养基(含0.5%青链霉素和链霉素)的中进行培养,置于5% CO2、37 ℃细胞培养箱中孵育。当细胞铺板率达到培养瓶底面积的80%以上时,用移液枪吸净原培养基并吸取3 mL PBS对漂浮的死细胞进行洗涤,重复3次。然后用2 mL培养基将细胞吹打至完全脱落,将细胞悬液浓度为每毫升1.0×104个,按每孔加入l00 μL的细胞悬浮液接种至96孔板中,置于培养箱中孵育24 h。
1.3.5.2 细胞增殖活性以及细胞因子分泌水平测定
按1.3.5.1节对细胞培养完成后,吸尽培养液并用PBS进行洗涤。对照组(Control组)每孔加入200 μL完全培养基;阳性对照组(LPS组)每孔加入200 μL含10 μg/mL LPS溶液的完全培养基;实验组每孔加入200 μL含不同质量浓度(15.625、31.25、62.5、125、250和500 μg/mL)的SMP-4溶液完全培养基,每组设置6个平行,孵育24 h。干预完成后,采用CCK-8 ELISA试剂盒测定巨噬细胞RAW264.7增殖活性,采用ELISA试剂盒测定TNF-α和IL-1β的分泌水平。
1.3.6 数据处理
每项实验进行三次以上重复实验,收集所有结果,数据以平均数±标准差表示。采用SPSS 26.0版本的单因素方差分析(ANOVA)分析数据的统计学意义。P值小于0.05被认为有统计学意义。
2 结果与讨论
2.1 盐制巴戟天多糖纯化
图1a为采用DEAE-52柱纯化盐制巴戟天粗多糖得到的洗脱曲线,共得到了4个不同的多糖组分,其中SP-4组分含量明显高于其他组分,收集SP-4组分用于后续的实验。图1b为采用Sephadex G100柱纯化SMP-4得到的洗脱曲线,结果显示得到无拖尾单一峰,说明组分纯度较高,利于后面的实验。SMP-4得率为0.085%,纯度为91.46%。
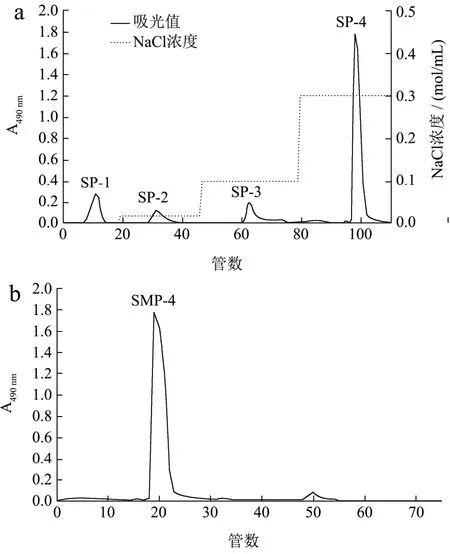
图1 盐制巴戟天多糖洗脱曲线Fig.1 Elution curve of polysaccharide from salt-processed Morinda officinalis
2.2 SMP-4结构分析
2.2.1 SMP-4的FT-IR谱图分析
SMP-4的FT-IR检测图如图2所示,SMP-4在 4 000~400 cm-1范围内具有多糖特征峰。如在3 403 cm-1处为多糖特征峰,峰型又强又宽是由O-H的拉伸振动形成;在2 932 cm-1处的吸收峰是由C-H的拉伸和弯曲振动形成的[19]。在1 240 cm-1处的吸收峰是吡喃糖的C-O-H伸缩振动引起的。1 093 cm-1和537 cm-1处的吸收峰是吡喃糖苷上的C=O伸缩振动引起,SMP-4具有吡喃环糖残基[20,21]。1 044 cm-1出现的吸收峰,是由呋喃环C-O-C伸缩震动引起的,说明SMP-4含有呋喃糖[22]。SMP-4同时包含有吡喃糖和呋喃糖。在639 cm-1处的吸收峰可能是羰基的C=O扭曲振动形成的[23]。在 1 613 cm-1吸收峰是由N-H弯曲振动引起的[24]。在1 750~ 1 700 cm-1无吸收峰,表示SMP-4中不含有糖醛酸[25]。
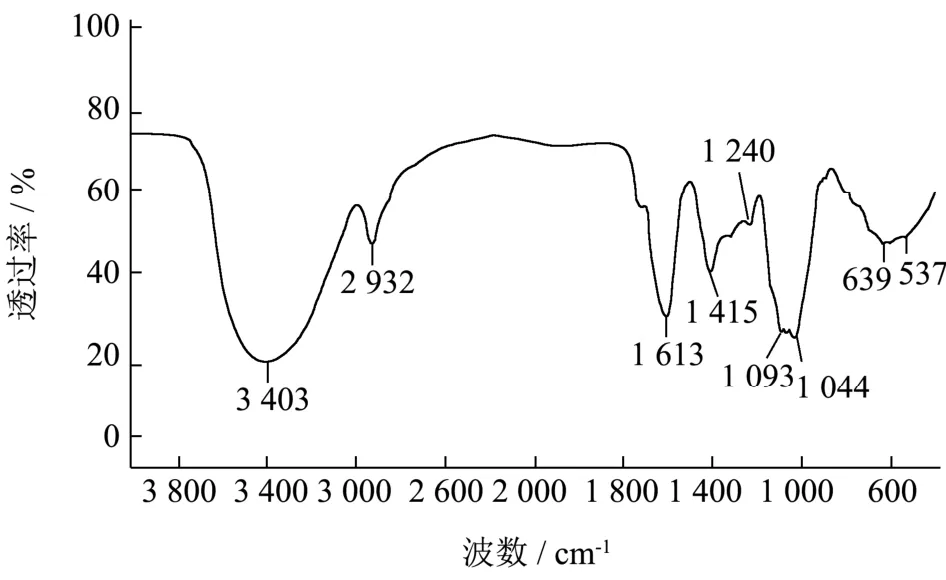
图2 SMP-4的FT-IR检测图Fig.2 FT-IR detection figure of SMP-4
2.2.2 SMP-4的单糖组成分析
多糖是由单糖残基通过糖苷键连接而成的,因此在分析多糖结构中,分析单糖组成是关键性步骤。采用GC-MS分析得到单糖标准品和SMP-4的结果见图3。
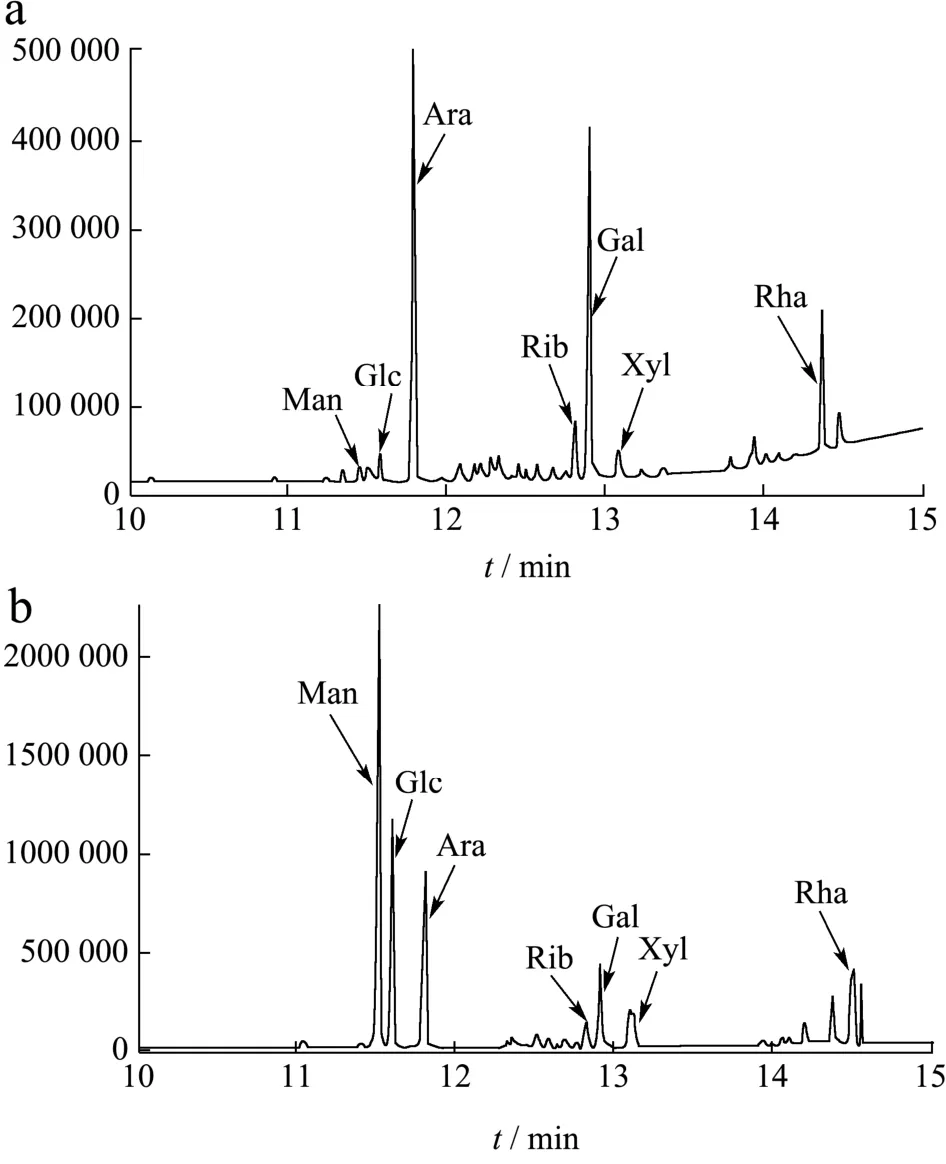
图3 SMP-4(a)和单糖标准品(b)的GC-MS谱图Fig.3 GC-MS profile of SMP-4 (a) and monosaccharide standard (b)
对色谱图分析得到结果如表1所示,结果表明SMP-4由核糖、鼠李糖、阿拉伯糖、木糖、甘露糖、葡萄糖和半乳糖组成,其中阿拉伯糖含量最高,达到了54.74%。其次为半乳糖,含量达到了22.58%。这与之前的研究中,单糖的种类较为一致,相对摩尔比具有较大的差异。如Zhang等[6]从巴戟天中分离具有抗氧化活性酸性多糖APMO由鼠李糖、阿拉伯糖、木糖、甘露糖、葡萄糖和半乳糖组成,相对摩尔比为1:48.58:0.86:1.67:0.74:14.92。何传波等[13]从巴戟天分离出的一种多糖主要有葡萄糖、阿拉伯糖和半乳糖构成,摩尔比为5.08:2.91:1。何传波等[14]关于分离纯化巴戟天多糖的研究中,得到两种多糖MOHP-Ⅰ和MOHP-Ⅲ其单糖组成分别为葡萄糖、果糖和阿拉伯糖、木糖、葡萄糖、果糖以及半乳糖。

表1 SMP-4的单糖组成Table 1 Monosaccharide composition of SMP-4
2.2.3 SMP-4的相对分子量分析
多糖的分子量与其免疫活性有着密切的关系。HPGPC的检测结果如表2,SMP-4的相对分子量为1.32×105u。分布列(Mw/Mn)为1.41<2,说明SMP-4的有良好的均一性和溶解性,在水中具有较小的粘度,能够增大多糖与细胞特定基团的接触面积[26]。

表2 SMP-4分子量Table 2 Molecular weight of SMP-4
2.2.4 SMP-4的甲基化分析
在多糖的研究中,常采用甲基化分析多糖中单糖残基连接的方式。SMP-4经GC-MS分析,得到了SMP-4的单糖残基组成、单糖残基结构、连接和分支,对SMP-4甲基化分析结果见表3。SMP-4主要由→3)-D-Araf-(1→、→6)-D-Galp-(1→、和→2)-D-Rhap-(1→残基组成,摩尔比分别为58.35%、23.11%和12.54%。SMP-4是以(1→3)糖苷键为主要糖苷键,→3)-D-Araf-(1→、→6)-D-Galp-(1→为主要构成的大分子多糖。这与FT-IR数据和单糖组成分析的结果一致。
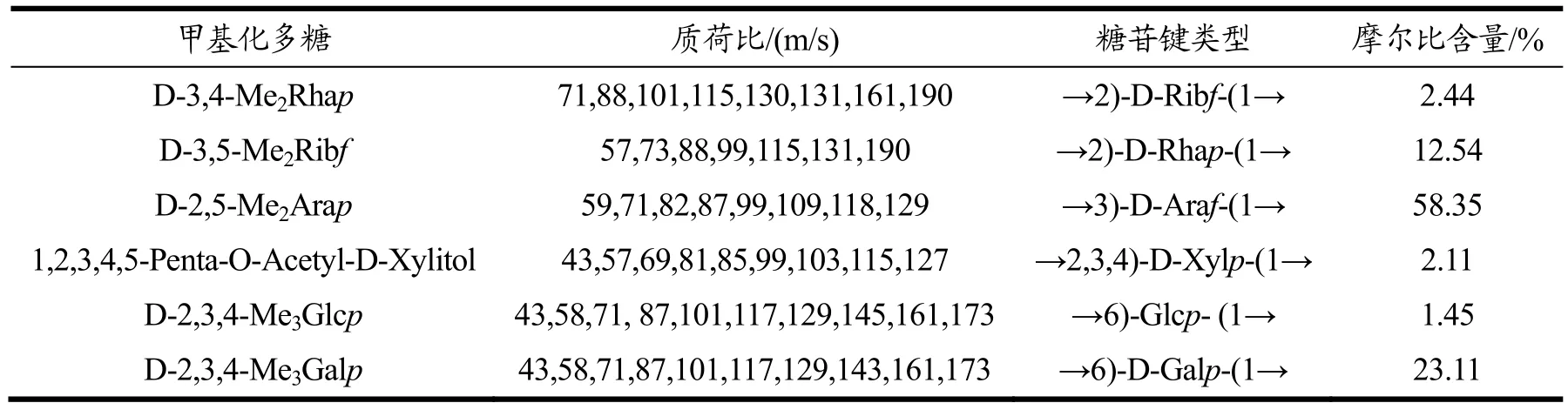
表3 SMP-4甲基化分析结果Table 3 Methylation analysis results of SMP-4
2.2.5 SMP-4的NMR图谱分析
SMP-4的1H-NMR图谱和13C-NMR图谱如图4、图 5所示。多糖的特征峰[27]大多集中在δH3.0×10-6~5.5×10-6和δC60.0×10-6~100.0×10-6,本实验结果中氢谱和碳谱图都符合这一特征。在δH4.700×10-6处出现的强烈信号是D2O中的HDO所导致的。一般认为δH>5.000×10-6是α构型糖苷键氢信号,δH<5.00×10-6是β构型糖苷键信号[28]。SMP-4存在有δH5.040×10-6、5.133×10-6、5.692×10-6异位质子信号表明其存在α构型糖苷键。SMP-4存在有δH4.688×10-6、4.947×10-6异位质子信号表明其存在β构型糖苷键。在δH3.200×10-6~4.500×10-6环质子区域的信号对应于糖环中从C-2到C-6的质子,而SMP-4的1H-NMR图谱中δ值为3.200×10-6~4.500×10-6的信号被堆叠,表明多糖分子量较大,聚合程度高,结构复杂导致信号重叠,较难分辨。在δH5.500×10-6~5.843×10-6(δH5.545×10-6、5.685×10-6、5.692×10-6)范围内出现信号峰中说明 SMP-4 存在α-呋喃糖,在δH5.000×10-6~5.500×10-6(δH5.040×10-6、5.067×10-6、5.133×10-6、5.307×10-6、5.452×10-6)范围内出现信号说明SMP-4存在α-吡喃糖[29]。在δC60×10-6~84×10-6(δC76.412×10-6、δC81.229×10-6)范围内出现的信号峰说明SMP-4中存在吡喃糖构型[30]。这与FT-IR分析的结果相一致。
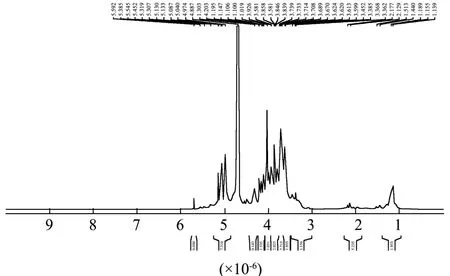
图4 SMP-4核磁共振氢谱图Fig.4 NMR hydrogen diagram of SMP-4
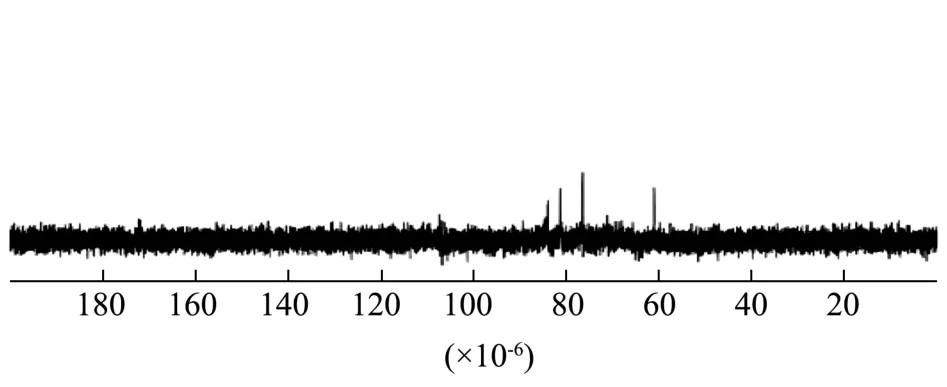
图5 SMP-4核磁共振碳谱图Fig.5 NMR carbon diagram of SMP-4
综上分析,SMP-4是以→3)-D-Araf-(1→和→6)-D-Galp-(1→为主要构成的大分子多糖结构。多糖的生物活性与其结构密切相关[12]。Yan等[3]从巴戟天中分离出能够调节靶基因的表达从而改善骨质疏松的多糖,其主要以(2→1)-β-D-Fruf为主链,以(1→)-α- D-Galp和(2→)-β-D-Frup为侧链的结构。Zhang等[4]从巴戟天中分离抗骨质疏松活性多糖MOP50-2,主要由α-D-Glcp-(1→、→1)-β-D-Fruf-(2→和β-D-Fruf-(2→残基的构成。在Yan等[3]和Zhang等[4]的研究中是采用巴戟天干燥处理后直接提取多糖,对比发现与本研究中分离出SMP-4有所不同,属于不同的多糖。
2.3 SMP-4免疫活性研究
2.3.1 SMP-4对细胞增殖活性影响分析
巨噬细胞是机体重要的免疫细胞,在特异性免疫和非特异免疫中都发挥着重要的作用[31]。本实验中的SMP-4对于RAW264.7细胞增殖活性实验数据如图6所示,与Control组相比,不同浓度SMP-4对巨噬细胞RAW264.7不存在显著差异(P>0.5),说明15.625~500.000 μg/mL SMP-4不影响巨噬细胞RAW264.7增殖活性。在15.625~500.000 μg/mL质量浓度范围内,进行SMP-4对RAW264.7细胞免疫细胞因子分泌水平实验,不受细胞增殖活性的影响。
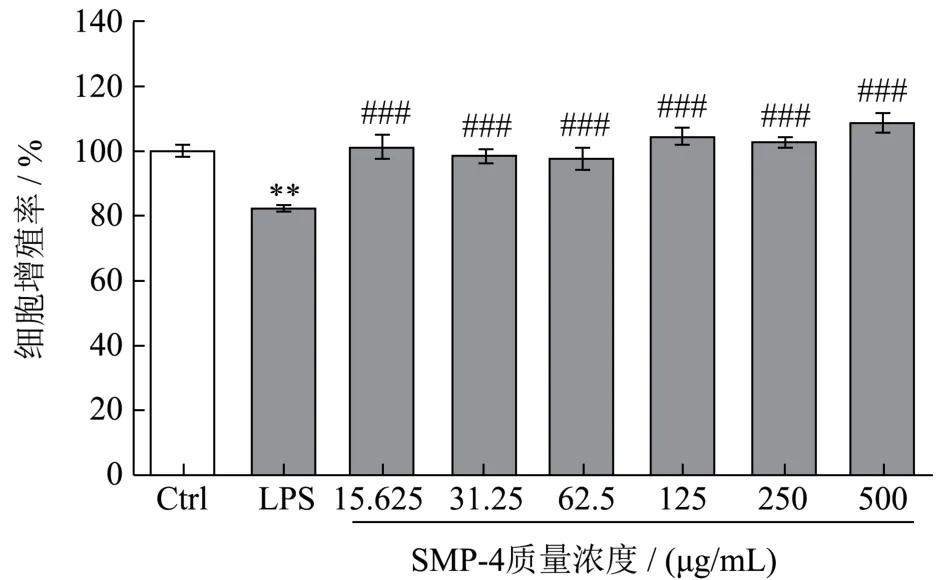
图6 RAW264.7细胞的增殖活性Fig.6 Proliferative activity of RAW264.7 macrophages
2.3.2 SMP-4对小鼠RAW264.7巨噬细胞TNF-α和IL-1β分泌水平影响分析
TNF-α和IL-1β是由巨噬细胞分泌与机体的特异性免疫相关的细胞因子,对于研究各种炎症性和免疫性疾病具有重要意义[32]。细胞因子在机体内的平衡具有重要意义,现有的研究已证实,虽然机体内炎症因子的升高有利于细胞修复,但是过高的炎症因子水平又会导致炎症损伤。因此炎症相关因子要保持在正常分泌水平以发挥最适合作用。图7为不同浓度SMP-4对RAW264.7巨噬细胞分泌免疫细胞因子的影响。与LPS组相比,Control组的RAW264.7巨噬细胞相关因子分泌水平显著低于LPS组(P<0.05或P<0.01),说明RAW264.7巨噬细胞炎症造模成功。
TNF-α是由巨噬细胞分泌的免疫细胞因子,在机体免疫调节中发挥着重要作用[33]。SMP-4对RAW264.7巨噬细胞分泌细胞因子TNF-α的影响如图7a所示。与Control组相比,在15.625~500.000 μg/mL质量浓度范围内SMP-4能显著增加TNF-α的分泌,并随着SMP-4浓度的增大TNF-α分泌水平也随之增高,呈浓度依赖性。尤其是在250 μg/mL质量浓度下,TNF-α达到了2 100 pg/mL,差异极显著(P<0.001)。但在15.625~500.000 μg/mL质量浓度范围内SMP-4促进TNF-α分泌水平均低于LPS组。这表明在15.625~500.000 μg/mL质量浓度范围内能够提高RAW264.7细胞的TNF-α分泌水平,同时又可以避免过高的分泌水平所导致的炎症。在赵文俊等[26]从美藤果粕中分离出的植物多糖SISDF在质量浓度为 62.5~1 000.0 μg/mL范围内能够使得RAW264.7巨噬细胞分泌的TNF-α质量浓度达到1 400~1 500 pg/mL,相比之下,62.5~500.0 μg/mL质量浓度下SMP-4也能达到相近的效果且能避免过高分泌水平。
IL-1β是由活化的单核巨噬细胞分泌的免疫细胞因子,在介导T、B细胞活化、增殖和分化中起重要作用。SMP-4对RAW264.7巨噬细胞分泌细胞因子IL-1β的影响如图7b所示。在15.625~500.000 μg/mL质量浓度范围内SMP-4促进IL-1β分泌水平均低于LPS组。与Control组相比,15.625~31.250 μg/mL质量浓度下SMP-4能提高IL-1β的分泌水平(P<0.05)。在31.25 μg/mL下IL-1β质量浓度最高,达到了 14.5 pg/mL,未呈现浓度依赖性。这可能是不同浓度SMP-4对RAW264.7巨噬细胞的某一通路的刺激程度不一,导致细胞的IL-1β分泌水平有所不同。关于SMP-4刺激RAW264.7细胞中潜在的信号通路的研究有待进一步探讨。对比Zhang等[34]从罗望子中提取的具有良好免疫活性的植物多糖TKP-2-1,不同浓度的TKP-2-1能够使得RAW264.7巨噬细胞分泌的IL-1β质量浓度达到10~15 pg/mL,而SMP-4质量浓度为31.25 μg/mL时,能达到与之相近的分泌水平且不具有计量浓度依赖性。实验结果表明SMP-4能够平衡特异性免疫相关因子的分泌水平,能够促进分泌水平升高的同时避免过高的分泌水平,说明SMP-4在免疫活性方面的开发具有较大的潜力。
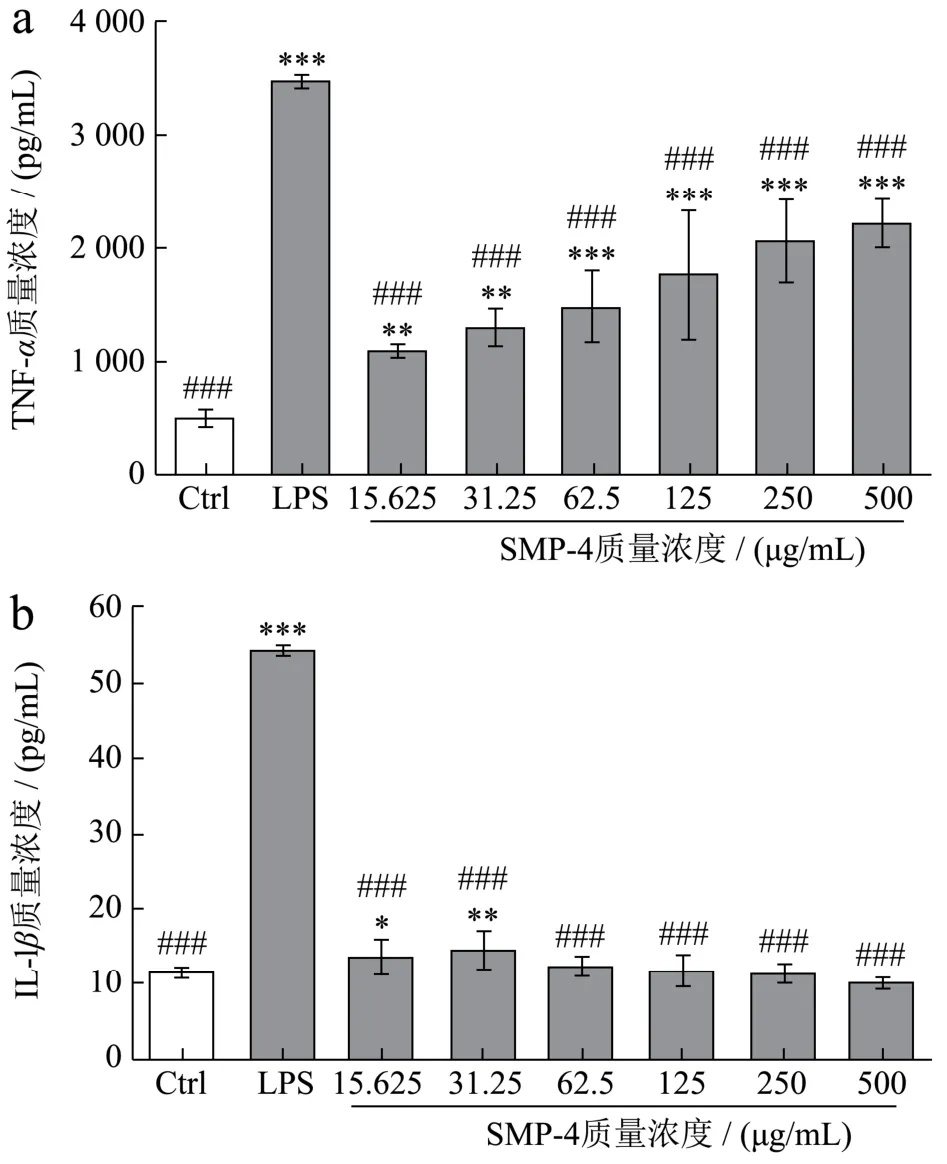
图7 不同浓度SMP-4对RAW264.7巨噬细胞分泌细胞因子的影响Fig.7 RAW264.7 macrophage secretion level of related factors
SMP-4具有良好的免疫活性可能与其多糖结构中存在有一定的联系。SMP-4是以→3)-D-Araf-(1→和→6)-D-Galp-(1→为主要构成的大分子多糖结构。多糖以(1→3)糖苷键为主链的连接方式与其免疫活性有关[35]。如Shen等[36],从玫瑰茄中分离出的多糖主要的由(1→3)糖苷键相连的HSP-II,具有良好的免疫活性。在以半乳糖和阿拉伯糖为主要单糖组成的多糖已被证实具有较高的免疫活性[37]。
3 结论
本研究分析的盐制巴戟天多糖SMP-4是以→3)-D-Araf-(1→和→6)-D-Galp-(1→为主要糖残基,分子量在1.32×105Da的大分子多糖。在免疫活性评价实验中,SMP-4不影响RAW264.7巨噬细胞的增殖,同时能够提高RAW264.7巨噬细胞分泌TNF-α和IL-1β的水平且避免过高分泌水平导致炎症。SMP-4可作为一种良好的功能性食品免疫调节剂,应用于保健食品产品开发中。本研究为盐制巴戟天多糖在功能性食品方面的开发提供了理论支撑,这将对巴戟天作为保健食品原料的开发具有积极的意义。

