芽孢杆菌强化发酵降低小曲白酒中高级醇的含量
黄治国,罗润森,李彦中,邓杰,3,任志强,3,卫春会,3*
(1.四川轻化工大学酿酒生物技术及应用四川省重点实验室,四川宜宾 644000)(2.四川江口醇隆鼎酒业有限公司,四川巴中 636400)(3.中国轻工业酿酒生物技术及智能制造重点实验室,四川宜宾 644000)
白酒中高级醇是指三个及三个以上碳原子的一元醇,主要有异丁醇、异戊醇、异丙醇、正丙醇、正丁醇,β-苯乙醇等,是白酒中的一类主要香味物质,也是一些香味成分的前体物质[1,2]。适宜含量的高级醇能为白酒带来舒适的口感与芳香,过量的高级醇含量则会使白酒口感辛辣苦涩,还对人体健康具有不利影响,饮用高级醇含量较高的白酒更容易引起上头、恶心、眩晕等症状[3,4],因此对白酒中高级醇含量的控制至关重要。
白酒行业大多按照GB/T 5009.48-2003《蒸馏酒与配制酒卫生标准的分析方法》中有关规定,以每 100 mL饮料酒中高级醇含量不超过0.15 g(以戊醇计)或0.30 g(以异丁醇和异戊醇计)来评判酒中高级醇含量是否符合标准。我国GB 2757-1981规定白酒中高级醇含量不得高于2.00 g/L,因国外蒸馏酒高级醇含量普遍偏高,我国GB 2757在2012年取消了对高级醇的限制要求。各类白酒在酿造中均会出现高级醇含量偏高的现象,倍受青睐的小曲白酒也不例外。对多种川法小曲酒、大曲清香、麸曲清香、米香型等白酒进行风味物质分析,发现小曲白酒高级醇含量相对较高[5]。目前,受蛋白质分解机理影响,业内普遍认为正丙醇的产生与堆积料中的耐高温细菌有关[6],已有研究表明酵母是高级醇的主要代谢微生物[7,8],少数报道过芽孢杆菌产正戊醇、异戊醇等[9]。芽孢杆菌是白酒酿造的重要功能菌,在大曲、窖泥和酒醅中广泛分布,为白酒酿造过程提供丰富的酶系,也对白酒风味物质的产生有重要的影响[10,11]。芽孢杆菌在清香型小曲白酒的菌群中占有一定数量优势[12],且地衣芽孢杆菌是清香型白酒中的产香功能微生物,可产较多乙酸乙酯,较少乳酸乙酯,符合清香型白酒“增乙降乳”的趋势[13],理论上将芽孢杆菌运用到小曲白酒酿造中具有一定价值。
本研究从大曲来源的13株功能芽孢杆菌出发,通过实验室模拟液态发酵和固态发酵,对发酵产物的挥发性物质进行风味分析,从中筛选出强化发酵能降低高级醇含量的芽孢杆菌,并进行菌株鉴定。然后制成芽孢杆菌麸曲,将其运用到小曲白酒酿造的小试和中试试验,验证其发酵性能,探究芽孢杆菌的添加对降低酒体高级醇含量的影响。
1 材料与方法
1.1 材料
菌种:13株芽孢杆菌均从大曲中筛选得来,现保存于酿酒生物技术及应用四川省重点实验室,编号B1~B13;高粱、糠壳、小曲:市售;BacterialDNA Isolation Kit试剂盒,成都福际生物技术有限公司;正丙醇、异丁醇、异戊醇、正戊醇、苯乙醇(均为色谱纯),上海源叶生物科技有限公司。
1.2 仪器与设备
7890A-5975B气相色谱质谱联用仪(GC-MS),美国安捷伦公司;M367983 PCR仪、ChemiDocXPS+凝胶成像仪和164-5070电泳仪,美国BIO-RAD公司;A360紫外可见分光光度计,上海翱艺仪器仪器有限公司;DM3000生物显微镜,德国徕卡仪器有限公司。
1.3 方法
1.3.1 菌株筛选
1.3.1.1 种子液制备
将纯化的芽孢杆菌分别接入LB液体培养基培养基,于37 ℃、120 r/min培养12 h,调节菌体OD600nm= 1.0(108CFU/mL),制成种子液,备用。
1.3.1.2 液态发酵
制备高粱营养液,将高粱粉100 g(过100目筛)加入至1 L沸水中糊化5 min,自然pH。在1 000 mL广口瓶中加入800 mL高粱营养液,接种0.4%(m/V)市售小曲。取种子菌液10 mL,6 000 r/min离心5 min,弃上清液,留菌体沉淀,用10 mL无菌水,分次洗下菌体至广口瓶中,密封发酵,置于25 ℃恒温培养箱中发酵7 d。
1.3.1.3 固态发酵
参照小曲清香白酒的酿造工艺[14],以高粱为原料,用100 ℃水浸泡4~8 h进行润粮,初蒸15~20 min,焖粮50~55 min,复蒸60~70 min,摊晾至40~50 ℃,加入蒸好的糠壳5%(m/V),添加0.4%(m/V)活化小曲,拌匀。25 ℃左右堆积20~24 h,添加菌液于1 000 mL广口瓶,每瓶装800 g酒醅,密封,25 ℃恒温发酵7 d。空白对照组仅添加0.4%(m/V)市售小曲进行发酵,试验组添加0.4%(m/V)市售小曲和0.04%(m/V)芽孢杆菌,芽孢杆菌接种方式参照1.3.1.2中的方法。
1.3.1.4 总酯和高级醇含量测定
采用气相色谱-质谱法(GC-MS)对发酵结果中的高级醇含量与酯含量进行分析[15]。样品测定参照GB/T 10345-2007《白酒分析方法》对酒醅进行处理后,取900 µL样液于进样瓶中,加入2 mg/mL的2-辛醇内标溶液和3 mg/mL乙酸戊酯内标溶液各50 µL,随后自动进样。
气相色谱条件:毛细管色谱柱为DB-WAX(60.00 m ×0.25 mm×0.25 μm);进样口温度为230 ℃;程序升温:36 ℃保持13 min,以6 /min℃ 升温至200 ℃,保持5 min,以10 /min℃ 升温至230 ℃,保持10 min;运行时间共计58.333 min;载气:99.999%氦气,流速为1 mL/min。
质谱条件:电子离子源EI,电子能量70 eV,采集模式全扫描,质量扫描范围20~550 u,溶剂延迟 3 min,离子源温度230 ℃,四极杆温度150 ℃,接口温度230 ℃。
1.3.2 菌株鉴定
1.3.2.1 形态特征观察
观察菌株的菌落形态,并进行革兰氏染色及芽孢染色。
1.3.2.2 生理生化试验
针对芽孢杆菌菌种特性,进行葡萄糖分解试验、甲基红(MR)试验、V-P试验、过氧化氢酶(触酶)试验、淀粉水解试验、柠檬酸盐试验、硝酸盐还原试验进行生理生化指标测定。 1.3.2.3 16S rDNA测序
使用Bacterial DNA Isolation Kit试剂盒提取所筛选菌株的基因组DNA,以此为模板,以通用引物27F、1492R进行序列扩增,反应体系为25 μL:27F引物 1 μL、1492R引物1 μL、MIX酶12.5 μL、DNA模板1 μL、ddH2O 9.5 μL。PCR条件:94 ℃预变性5 min,94 ℃变性1 min,50 ℃退火1 min,72 ℃延伸2 min,循环30次;72 ℃延伸10 min。PCR产物经1%琼脂糖凝胶电泳,用凝胶成像系统观察电泳条带,确定有无目的性条带出现。然后将PCR产物寄往上海生工生物工程有限公司进行测序。测序完成后,用DNAstar软件对测得的序列进行拼接及人工校正,在NCBI数据网站的GenBank中进行BLAST比对分析,选取序列相似性较高的标准菌株的基因序列,使用MEGA-X软件进行系统发育分析,采用邻接法构建系统发育树。
1.3.3 小曲白酒酿造试验
以麸皮为原料,接种目标芽孢杆菌,通过三级制曲的模式,制备芽孢杆菌麸曲[16]。参照小曲清香白酒固态酿造工艺进行小试、中试,小试采用5 L发酵容器,中试采用50 L发酵容器。试验组分别添加0.4%市售小曲和0.04%芽孢杆菌麸曲,以只添加0.4%市售小曲为对照组,按照1.3.1.4方法对发酵产物中的高级醇含量与酯含量进行分析,验证菌株B13与B8在小曲白酒发酵中降低酒体高级醇含量的功能。
1.4 数据处理
2 结果与讨论
2.1 醇酯种类和高级醇代谢差异分析
功能菌株的开发与应用对于酿造行业来说,能更好地调控白酒生产,提高生产质量与产量。一般对于菌株的筛选多基于培养基的设计等,但是对于酿酒生产来说,这种试验过于理论化,当投入实际生产时却往往效果不佳,这大多是由于理论试验于实际生产的差距导致,因此对于酿酒生产来说,筛选发酵相关的菌株,应采取发酵试验来进行筛选,并且尽可能与实际生产工艺相符合,才能更好地达到最初目的。通过固态和液态发酵试验研究13株菌参与发酵对醇酯类物质产生的影响,对醇酯类物质数量的影响如图1,对高级醇含量的影响如图2所示。

图1 13株菌发酵产物中醇酯类种数比较Fig.1 Comparison of alcohol ester species in fermentation products of 13 strains
由图1可知,B2、B8、B9、B13这四株菌与空白组相比,无论在液态还是固态发酵条件下,其发酵产醇酯类物质种数都显著高于空白组(P<0.05)。由 图2可知,B8、B10、B13在固、液发酵条件下,其发酵产物中高级醇含量都显著低于空白组(P<0.05),在确保醇酯类物质种数增加的的情况下,菌株B8、B13对高级醇含量的降低作用最显著,液态发酵中,B8、B13分别低至1.070 mg/mL和1.03 mg/mL,较空白组分别降低0.71和0.75 mg/mL;固态发酵中,B8、B13分别低至0.69和0.56 mg/mL,较空白组分别降低 0.41 mg/mL、0.54 mg/mL。在液态发酵中可利用氮源少,大多通过糖代谢途径生成较高浓度的高级醇[17],其高级醇含量普遍高于固态发酵,与试验结果相符。通常液态法制备的小曲白酒中高级醇含量为0.60~2.50 mg/mL,固态发酵制备的小曲白酒中高级醇含量为0.50~1.80 mg/mL[18],菌株B8与B13参与发酵后,高级醇含量在其正常范围内。
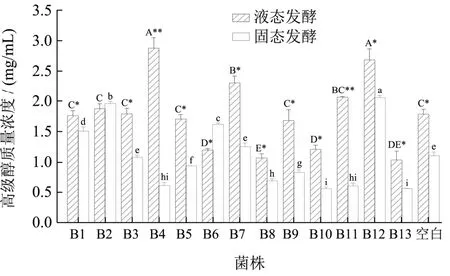
图2 13株菌发酵产物中高级醇含量比较Fig.2 Comparison of higher alcohol contents in fermentation products of 13 strains
由上述可知,菌株B8与B13在液态、固态发酵过程中,能保持小曲白酒主体风味的情况下,增加醇酯类物质种数,对降低小曲白酒高级醇含量作用明显,这可能在一定程度上改善小曲白酒风味,提高小曲白酒酒质。
2.2 芽孢杆菌鉴定
通过菌落形态观察、生理生化试验及16S rDNA测序分析方法,对菌株B8、B13进行菌种鉴定。两菌株菌落特征及镜检如图3所示,B8的菌落形状不规则,呈白色不透明,表面多褶皱,中间凹陷,靠近边缘有一圈隆起,易挑起。菌株B13的菌落呈乳白色圆形,不透明,质感黏腻,不易挑起,表面光滑,湿润有光泽,边缘整齐。两菌株革兰氏染色与芽孢染色结果表明,均为革兰氏阳性菌,且菌体为杆状,两株菌均产芽孢,初步判定其为产芽孢杆菌。

图3 两株菌菌落特征图及镜检图Fig.3 Microscopic examination of gram stain and spore stain of 2 strains
生理生化试验结果如表1所示,菌株B8葡萄糖分解、甲基红、V-P、触酶、淀粉水解、柠檬酸盐、硝酸盐还原、精氨酸双水解酶试验结果均为阳性,菌株B13甲基红试验、柠檬酸盐试验与精氨酸双水解酶试验结果呈阴性,其余结果呈阳性。菌株B13不能利用柠檬酸盐产生碱性化合物,具有分解葡萄糖产酸的能力,但分解葡萄糖产酸量较小,或者产生的酸进一步转化为其它物质(如醇、酮、醚、气体和水等),使得甲基红试验结果为阴性。两者均表现出良好的葡萄糖分解能力、淀粉水解能力,说明两者均具有葡萄糖分解酶、淀粉酶,推测两株菌在酿造环境中具有一定的生存能力。结合形态学观察,根据《伯杰氏细菌鉴定手册》[19]初步判定菌株B8、B13为芽孢杆菌属。
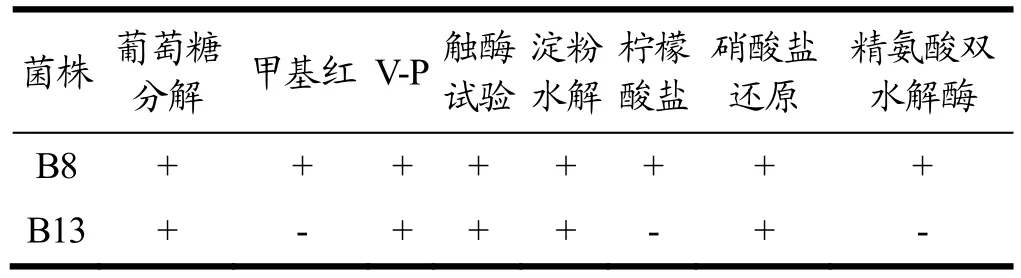
表1 两株菌的生理生化试验Table 1 Tests of physiological and biochemical of the 2 strains
对16S rDNA测序结果进行分析,使用MEGA 7构建系统发育树,结果如图4所示。菌株B8与Bacillus licheniformis具有最大的序列相似性,且发育树上处于同一个分支,结合形态学观察与生理生化结果,故将菌株B8鉴定为地衣芽孢杆菌(Bacillus licheniformis)。Bacillus velezensis与其相近种在生理生化上的区别包含精氨酸双水解酶为阴性,结合菌株B13与Bacillus velezensis具有最大的序列相似性,发育树上处于同一个分支,故将菌株B13鉴定为贝莱斯芽孢杆菌(Bacillus velezensis)。
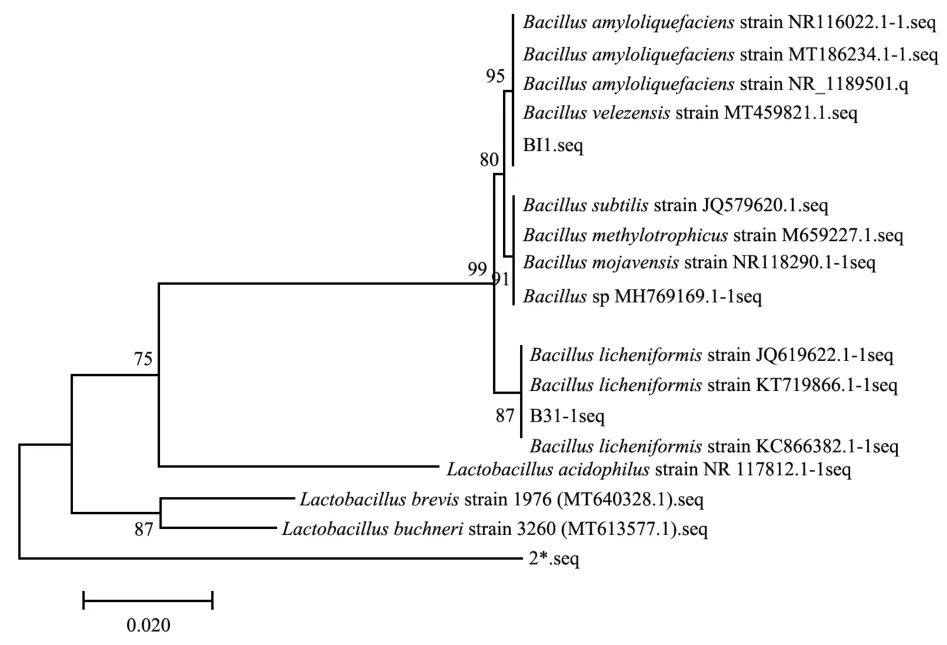
图4 邻接法构建的B8、B13菌株16S rDNA序列系统发育树Fig.4 Phylogenetic tree of strain B8 and B13 16S rDNA constructed by adjacency method
Bacillus licheniformis是白酒酿造中贡献风味的重要微生物,凌杰[20]、孟醒[21]等发现Saccharomyces通过产酸以及大分子的蛋白质类物质对Bacillus licheniformis生长形成抑制,结合蛋白组学,发现Bacillus licheniformis能影响酿酒酵母的乙醇、有机酸等物质代谢。推测Bacillus.licheniformis的添加可能影响高级醇的代谢途径,从而起到降低高级醇的作用。Bacillus velezensis多应用于生物防治,关于醇类代谢研究鲜有报道,但是其为重要的酿酒功能微生物,是白酒高温大曲的优势菌,具有较高的产蛋白酶和产淀粉酶能力,能通过调节代谢活性,改变大曲的原生菌群、酶活性和风味成分[22]。
2.3 小试和中试固态酿造高级醇及总酯含量分析
小试试验可以对发酵过程进行更准确的控制,但中试试验是将实验室与生产连接的重要桥梁,是将科研成果转化为生产力的必经之路[23]。两种芽孢杆菌麸曲的小试和中试酿造试验产总酯与产高级醇结果如 图5、图6。总体上来看,两株芽孢杆菌以麸曲形式参与到固态酿造试验后,高级醇以及酯含量与对照组相比均存在显著性差异(P<0.05),高级醇含量显著降低,酯类含量有明显提升。对于酯含量,两菌株分别参与发酵后,无论小试还是中试,其酯含量均高于空白组,主要表现为乙酸乙酯的增加,小试最高总酯含量为1.53 mg/mL,中试最高为1.20 mg/mL,两株菌之间对比无明显差异性。对于高级醇,菌株B13降低小曲白酒中高级醇含量能力稍优于B8,但无显著性差异,小试中高级醇含量最低达1.18 mg/mL,空白组为 1.80 mg/mL,降低了34.44%,中试中最低达 1.25 mg/mL,空白组为1.78 mg/mL,降低了29.87%,小试效果总体优于中试。由于在小试中可以准确控制发酵条件,在中试放大发酵时,增加了许多其它不可控的因素,致使中试降高级醇效果整体低于小试,但两轮次酿造试验都能显著降低小曲白酒高级醇的含量。由图7所示,异丁醇、异戊醇在接种芽孢杆菌麸曲的试验组产量降低最快,与只添加小曲发酵的对照组有显著性差异(P<0.05),芽孢杆菌强化发酵后,β-苯乙醇总体呈现上升趋势,有微量的正戊醇产生,但其总高级醇含量显著低于空白组,说明2株芽孢杆菌在高级醇的调控均存在着密切的相互作用关系,这对高级醇的调控有一定的贡献。
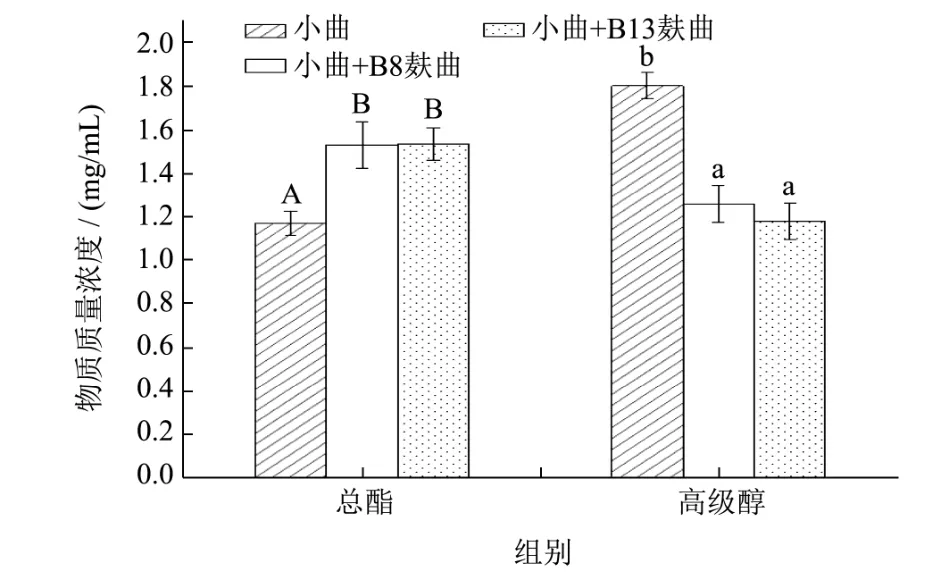
图5 两种芽孢杆菌麸曲的小试酿造产总酯和高级醇含量情况Fig.5 The contents of total esters and higher alcohols produced by two kinds of Bacillus bran koji in pilot fermentation
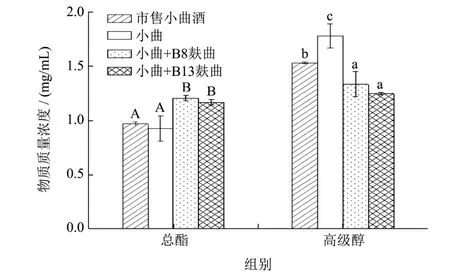
图6 两种芽孢杆菌麸曲中试酿造产总酯和高级醇含量情况Fig.6 Contents of total esters and higher alcohols produced by two kinds of Bacillusfuqu in pilot fermentation
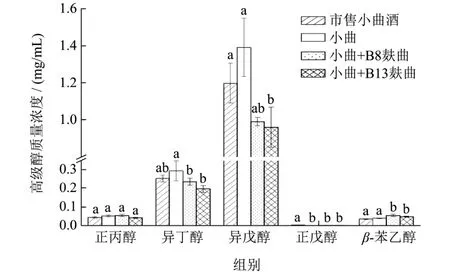
图7 中试酿造中主要高级醇产量对比分析Fig.7 Comparative analysis of yield of main high alcohols in pilot brewing
目前关于小曲白酒中高级醇发酵调控的研究较少,曲冠颐等[24]通过分析固态发酵过程中菌群合成高级醇的代谢差异特征,确定Saccharomyces、Pichia与Lactobacillus是调控小曲白酒高级醇含量的主要微生物。研究表明,直接参与高级醇代谢途径的相关基因如BAT2以及调控基因如GATA对高级醇合成具有重要影响,均可有效的调节酿酒酵母中高级醇的代 谢[25,26],结合芽孢杆菌能影响酵母产醇的代谢途径[21], 由此推测功能芽孢杆菌的添加能降低高级醇的原因一方面可能是抑制了能调控高级醇生成的相关微生物的生长,造成菌群差异、代谢差异;另一方面可能是芽孢杆菌自身低产高级醇,然而酿酒酵母所产高级醇含量超出了芽孢杆菌对高级醇的耐受范围,产生反馈机制,对高级醇代谢进行调控。此外,芽孢杆菌参与发酵会使β-苯乙醇含量增加和产生少量正戊醇。添加适量的B8和B13菌株到小曲白酒发酵能够降低高级醇含量,可能是强化菌株代谢了正戊醇或β-苯乙醇等物质,这些醇类物质含量的增加改变或抑制了酵母代谢其它高级醇,但是目前还未有相关文献报道过正戊醇或β-苯乙醇对高级醇的调控作用,在今后的试验中还需进一步验证。
由此可见,B8、B13在小曲白酒酿造中均具有一定降低高级醇含量的能力,且其风味物质也有所增加,小试总体优于中试,但中试酿造环境更接近实际的生产情况,能有效的将科研成果转向生产。中试结果表明,菌株对高级醇含量最高降低率达29.87%,且低于某市售小曲白酒,验证了芽孢杆菌强化发酵能有效的降低白酒中高级醇的含量,以期在实际生产中能加以运用。
3 结论
本文利用发酵试验筛选功能菌株,通过液态酿造和固态酿造试验,筛选得到2株可降低高级醇的优良菌株,分别为B8(Bacillus licheniformis)、B13(Bacillus velezensis)。将功能菌株以麸曲的形式进行两轮次酿造试验,均能在维持小曲白酒主体风味的情况下,显著降低小曲白酒中高级醇的含量。中试酿造中,高级醇含量变化主要变现为异戊醇与异丁醇的降低,以及β-苯乙醇的增加和微量正戊醇的产生,中试最高降低率可达29.87%,且低于某市售小曲清香型白酒成品酒中高级醇含量。通过研究发现芽孢杆菌通过麸曲的形式应用到小曲白酒发酵中是可行的,同时对降低高级醇含量和改善酒质有一定作用,有较大应用潜力。后续将从芽孢杆菌代谢物质对高级醇的调控及微生物间的相互作用等两方面进行更深入研究,以此探究其降低高级醇的机理,以期为解决小曲白酒中高级醇含量偏高问题提供理论依据,提升小曲白酒品质。

