低苦味多肽固体饮料的制备及其体外模拟消化研究
尹乐斌,刘桠丽,何平,李乐乐,罗雪韵,杨学为,邹文广,贺超,孙孟京
1(邵阳学院 食品与化学工程学院,湖南 邵阳,422000)2(豆制品加工与安全控制湖南省重点实验室,湖南 邵阳,422000)3(贵州亮欢寨生物科技有限公司,贵州 凯里,556000)
大豆蛋白是一种具有较高营养价值的植物性蛋白,大豆多肽是大豆蛋白的水解产物,其氨基酸组成和大豆蛋白一致。但大豆多肽分子质量比大豆蛋白更小,从而更容易被吸收。大豆多肽还具有降血压、降血脂、抗氧化及抗肿瘤等多种活性功能[1-2],关于大豆多肽的生理活性功能探究也是目前的研究热点。FANG等[3]比较了不同酶解方法制备多肽对蛋白质提取率、抗氧化及免疫活性的影响,LI等[4]概述了大豆多肽在降高血压中的作用。
固体饮料是指以食品或植物提取物为原料,添加适当的辅料或食品添加剂制成的粉末状、颗粒状的固态制品,具有风味独特、贮存期长、易携带等特点[5-6]。多肽固体饮料既保留了固体饮料原有特点,同时还具备了大豆多肽的活性功能,能够一定程度地提高免疫力,提供营养和能量的同时能够增加饱腹感,减少多余热量的摄入等。但由于多肽具有一定的苦味,在一定程度上也限制了多肽类产品的发展[7-8]。目前与大豆多肽相关的研究大多集中在其制备工艺、分离纯化及生理活性的探究上,尹乐斌等[9]探究了酶解豆清液制备大豆多肽的工艺条件,最后还进行了抗氧化活性的研究;肖聪丽等[10]对大豆多肽进行分离纯化,最后鉴定并筛选出5个多肽。目前有关大豆多肽固体饮料的研究还鲜有报道。
本文以大豆分离蛋白为原料,采用包埋掩盖脱苦方式以酶解后大豆多肽为芯材,β-环糊精为壁材进行包埋从而降低大豆多肽的苦味制备一款低苦味多肽固体饮料,并进行结构表征及体外模拟消化探究,以期为大豆多肽的产品开发提供新思路。
1 材料与方法
1.1 材料与试剂
大豆分离蛋白,浙江一诺生物科技有限公司;β-环糊精,广州嘉业食品配料有限公司;碱性蛋白酶,河南仰韶生物酶制剂有限公司;ABTS,合肥巴斯夫生物科技有限公司;其余试剂均为国产分析纯。
1.2 仪器与设备
TDZ5台式低速离心机,Dynamica Scientific Ltd.;ZNCL-BC磁力搅拌器,上海越众仪器有限公司;D-7型紫外可见分光光度计,上海舜宇恒平仪器有限公司;DX-2700BH X射线衍射扫描仪,丹东通达科技公司;DSC3热量扫描差示仪,梅特勒-托利多公司。
1.3 实验方法
1.3.1 工艺流程
低苦味多肽固体饮料工艺流程如下:
碱性蛋白酶 β-环糊精
↓ ↓
大豆分离蛋白→酶解→离心→纯化→低苦味多肽固体饮料的制备
1.3.2 低苦味多肽固体饮料的制备
将大豆分离蛋白3%(质量分数)分散于水中,先在(80±2) ℃条件下处理15 min,冷却至预定温度后恒温水浴,调节pH至8.0,加入碱性蛋白酶[V(酶)∶V(底物)=1∶100]于50 ℃水浴中酶解。酶解4 h后,调节pH至7.0,立即沸水灭酶10 min,待溶液冷却后离心(8 000 r/min,15 min),取上清液过5 kDa超滤膜纯化后备用[11]。
取一定量的大豆多肽溶液,添加一定量的β-环糊精,在一定温度下恒温磁力搅拌反应一段时间后,于-20 ℃下预冻后取出并冷冻干燥20 h,粉碎后即得低苦味多肽固体饮料[12]。
1.3.3 多肽含量的测定
参考吕凯波等[13]的方法略作修改:取样品溶液2 mL,按1∶1加入10%(质量分数)的三氯乙酸(trichloroacetic acid,TCA)溶液使其混合均匀,室温下静置10 min后在6 000 r/min 条件下离心10 min,取上清液加入双缩脲试剂[V(样液)∶V(双缩脲试剂)=2∶3]混合均匀,37 ℃恒温水浴30 min,测定吸光度(纯水代替样品做空白),根据标准曲线计算样品中多肽含量。
1.3.4 包埋率与苦味值的测定
配制质量浓度为20 mg/mL的样品溶液,充分溶解后于6 000 r/min 离心10 min测定其多肽含量,并计算包埋率,包埋率计算如公式(1)所示:

(1)
苦味评分标准参考孟雅潇[14]方法稍作修改:取适量未包埋的大豆多肽冻干粉配制成质量浓度为20 mg/mL的溶液,将其苦味定义为10分,取20 mL包埋处理后的多肽液10份依次加入0、10、20、30、40、50、60、70、80、90 mL的去离子水,搅拌均匀将其苦味值分别定义为10、9、8、7、6、5、4、3、2、1。选取20名经专业培训后的同学(10男10女)进行评分,最终结果取均值。
1.3.5 单因素试验
分别以壁芯比(7∶1、8∶1、9∶1、10∶1、11∶1,分别记为7、8、9、10、11)、包埋温度(35、40、45、50、55 ℃)、包埋时间(30、40、50、60、70 min)为单因素,考查各因素在制备过程中对低苦味多肽固体饮料的包埋率与苦味值影响。
1.3.6 响应面优化试验
在单因素基础上,以包埋率和苦味值为指标采用响应面分析法中Box-Menken的中心组合试验设计优化低苦味多肽固体饮料制备工艺。
1.3.7 物理指标的测定
1.3.7.1 水分的测定
1.检验人员。食品检验是人员手工操作与仪器紧密结合的工作过程,需要检验工作人员熟练掌握仪器的使用并严格按照检验流程进行检验活动的开展,但在实际的检验工作过程中,却存在着人员专业素质欠缺、技术能力不足和处理意外事件的反应能力较差等问题。加之对人员工作的管理力度不够大,使得检验人员的工作过于随意,忽视了对工作流程和各个环节的要求,影响了食品检验结果的准确性。
采用水分测定仪测定多肽固体饮料的水分含量。
1.3.7.2 流动性的测定
参考李鹏飞等[15]的方法进行测定,流动性使用Carr index(CI)来衡量,流动性CI值的计算如公式(2)所示:

(2)
1.3.8 结构表征
傅里叶转换红外光谱(Fourier-transform infrared spectroscopy,FT-IR):参考岳阳[16]的方法。X-射线衍射(diffraction of x-rays,XRD)分析、热重-热差同步分析:参考徐思鑫等[17]的方法。
1.3.9 体外模拟消化研究
胃消化过程:用HCl将消化液调节pH至2.0,随后加入10 mL胃蛋白酶溶液(由HCl溶液配制,终质量浓度2 mg/mL),搅拌均匀,37 ℃下振荡(100 r/min)2 h。从瓶中在0、1、2 h分别吸取10 mL消化液样品,迅速低温冷冻离心(4 ℃,5 000 r/min),取上清液,置于-20 ℃保存备用,分别作为胃消化阶段0、1、2 h样品,消化时间记为1、2、3。
肠消化过程:用NaOH将瓶中消化液调节pH至7.4,随后加入胰酶和猪胆盐混合液(终质量浓度分别为1.2、2.4 mg/mL),搅拌均匀,置于37 ℃下振荡4 h(100 r/min)。分别在0、1、2、3、4 h吸取10 mL消化液样品,迅速低温冷冻离心,取上清液,置于-20 ℃保存备用,分别作为肠消化阶段0、1、2、3、4样品,消化时间记为4、5、6、7、8[18-19]。
1.3.10 抗氧化活性的测定
羟自由基清除率、ABTS阳离子自由基清除率的测定参考尹乐斌等[20]的方法。
1.4 数据处理
所有实验重复3次,运用WPS Excel 2016和Design Expert 8.0.6 软件对数据进行处理分析,Origin 9.0进行绘图。
2 结果与分析
2.1 单因素试验结果
由图1可知随着β-环糊精的增加,包埋率也随之上升而后呈缓慢下降趋势,当壁芯比为9∶1时,包埋率较好,达到52.06%。可能是因为β-环糊精含量较低,大豆多肽含量较高,使得β-环糊精不足以有效包埋大豆多肽,随着β-环糊精含量的增加,大豆多肽被包埋进β-环糊精空腔中,但β-环糊精过多时,其内部空腔未能充分利用,从而导致大豆多肽微胶囊包埋率缓慢下降。随着β-环糊精的添加,苦味值逐渐减小,而超过一定量后,苦味值增加,产生了焦糊味[21],因此选择壁芯比为9∶1时进行包埋最合适。
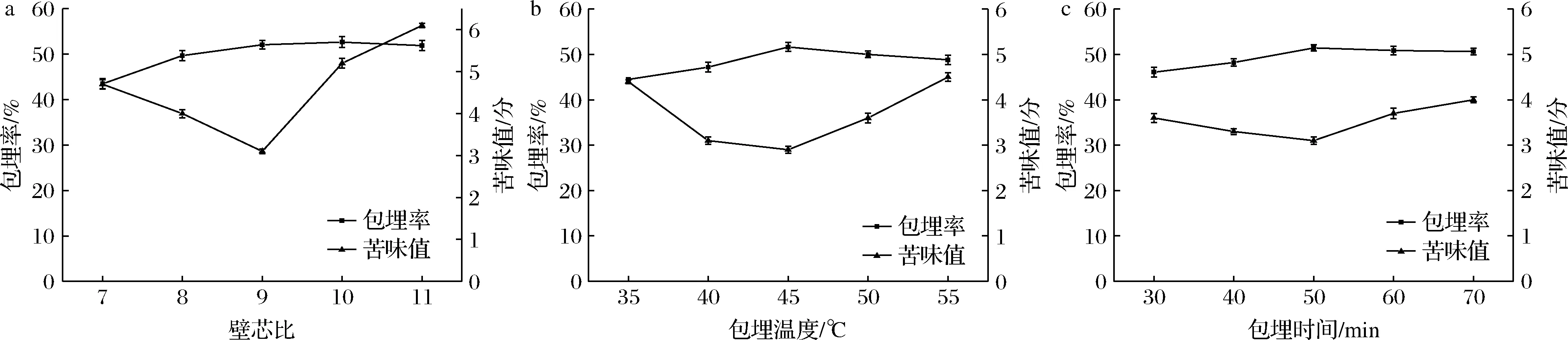
a-璧芯比;b-包埋温度;c-包埋时间
随着温度的升高,样品的包埋率逐渐升高,苦味值降低,当温度为45 ℃时,苦味值最低,随着温度再次升高,苦味值开始增大,可能是因为高温使得β-环糊精的内部结构发生变化,分子运动更为剧烈,大豆多肽又从β-环糊精空腔中移出[22]。综合考虑,选择45 ℃为最适包埋温度。
随着包埋时间的延长,包埋率逐渐增大,在包埋时间为50 min时包埋率趋于平缓。搅拌时间太短,大豆多肽与β-环糊精的接触不充分,大豆多肽无法充分地进入β-环糊精的空腔内;一定时间后影响效果不明显,可能是因为搅拌时间太长导致大豆多肽与β-环糊精之间的相互作用发生变化,造成包埋效果不良[23]。因此选择时间为50 min进行包埋。
2.2 响应面优化试验结果
响应面设计方案与优化结果根据单因素试验结果,确定壁芯比(A)、包埋温度(B)、包埋时间(C)为响应变量,运用Design-Expert8.0.6软件Box-Behnken的中心组合设计,以包埋率(Y1)与苦味值(Y2)为响应值,优化低苦味多肽固体饮料制备工艺。实验设计与结果见表1。

表1 Box-Behnken试验设计与结果
运用Design-Expert 8.0.6软件进行多元回归拟合得到回归方程:包埋率Y1=57.88-0.62A-0.40B+0.36C-0.083AB+0.41AC+0.21BC-1.85A2-1.57B2-1.35C2;苦味值Y2=2.78+0.15A-0.046B-0.023C-0.013AB+0.055AC-0.020BC+1.01A2+0.44B2+0.043C2。回归方程进行方差分析见表2、表3。
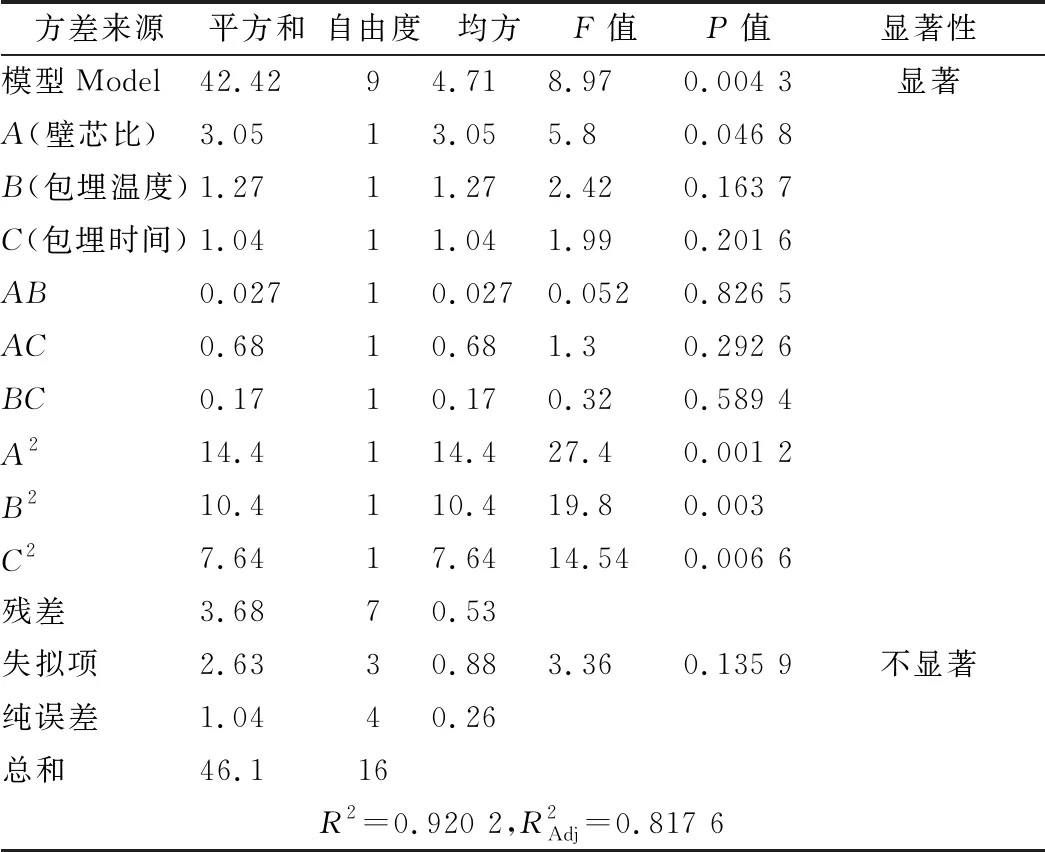
表2 包埋率回归模型方差分析
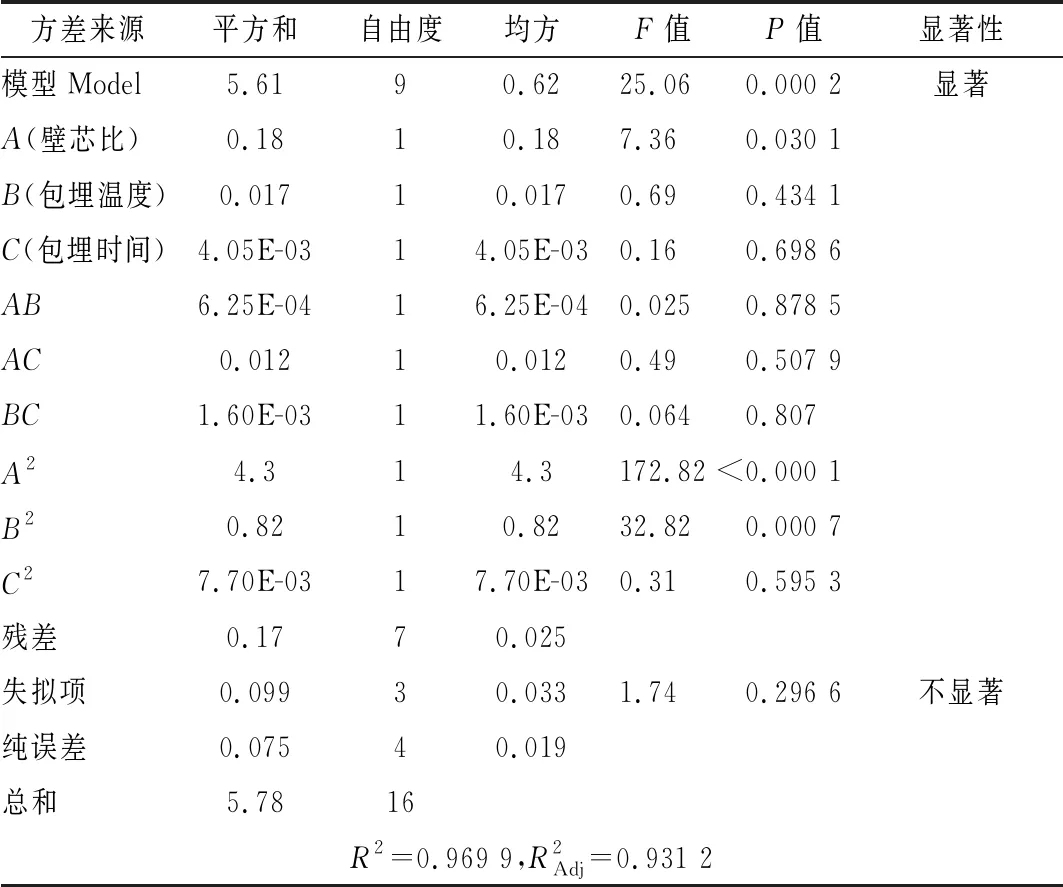
表3 苦味值回归模型方差分析
2.3 最佳制备工艺的确定
经过Design-Expert 8.0.6软件分析得到制备低苦味多肽固体饮料最佳条件为当壁芯比为8.85∶1,包埋温度为44.42 ℃,包埋时间为51.02 min时,包埋率预测值达57.97%;当壁芯比为8.92∶1,包埋温度为45.30 ℃,包埋时间为53.34 min时,苦味值预测为2.77分。结合实验具体情况调整参数为壁芯比9∶1,包埋温度为45 ℃,包埋时间为50 min。经3次平行实验测得包埋率为(58.04±0.32)%,苦味值为(2.72±0.27)分,与预测值无明显差异。
2.4 物理指标测定结果
对粉体的流动性CI值进行分级,<15表示流动性非常好,15~20较好,20~35一般,35~45较差,>45非常差。
由表4可知,固体饮料的水分含量为4.37%,低于国标要求6%,且其CI值为18.99%,流动性较好,颗粒间的吸附不强。

表4 低苦味多肽固体饮料物理指标测定结果
2.5 FT-IR红外光谱分析

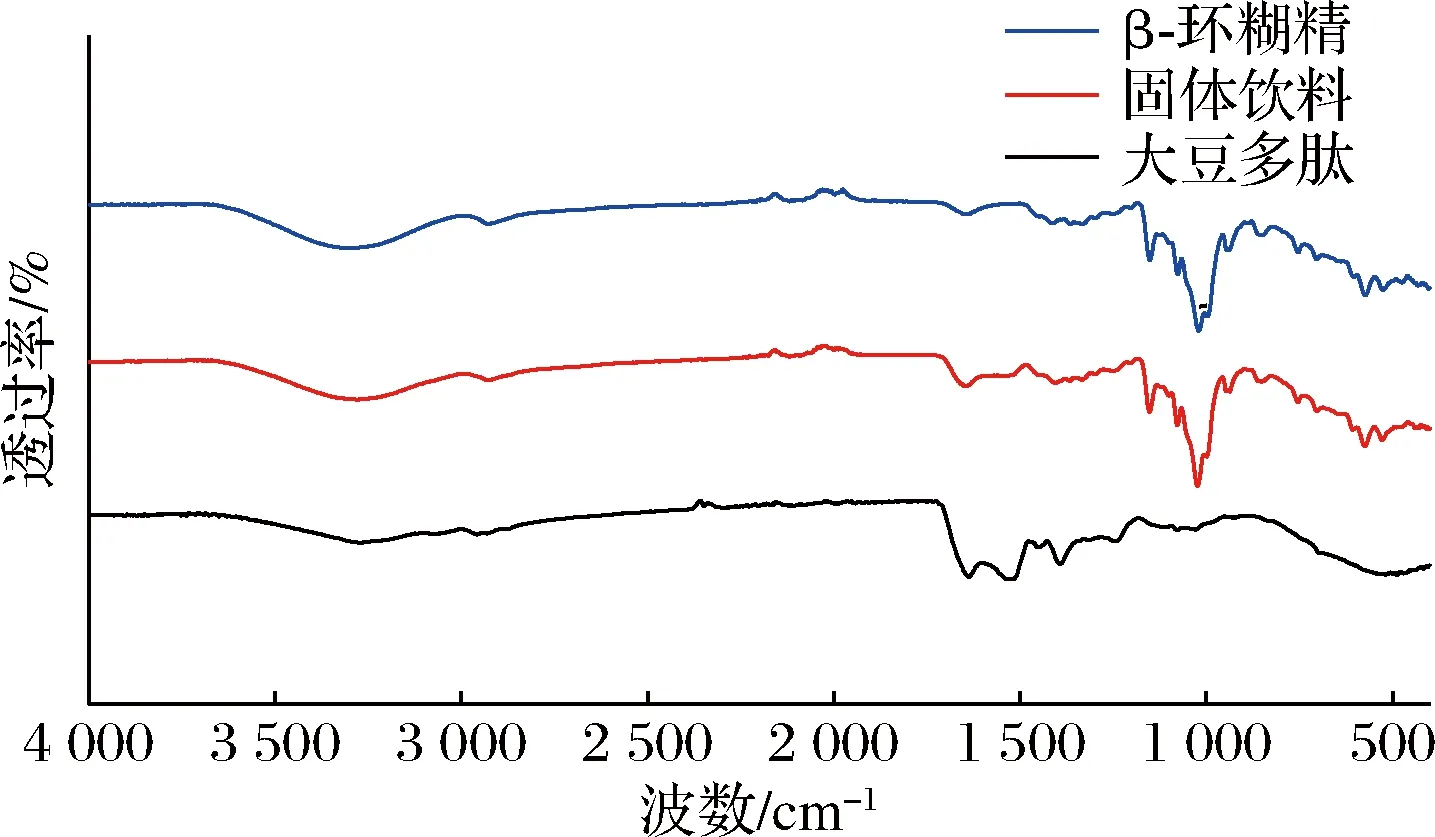
图2 大豆多肽、β-环糊精及固体饮料红外扫描光谱图
2.6 XRD分析
由图3可知β-环糊精在10°、12°、22°、27°均有较强的衍射峰,说明其具有较强的晶体结构,是以晶体形态存在的化合物,大豆多肽呈现无定型状态,只在25°附近存在1个较宽泛的衍射峰,可能是由于α-螺旋结构引起。对比3种物质的XRD谱图可看出,固体饮料峰的强度发生了明显变化,与β-环糊精相比,峰值减弱或消失,说明固体饮料具有晶体结构,且结构发生了变化[26-27],也从侧面证明芯材与壁材包埋成功。
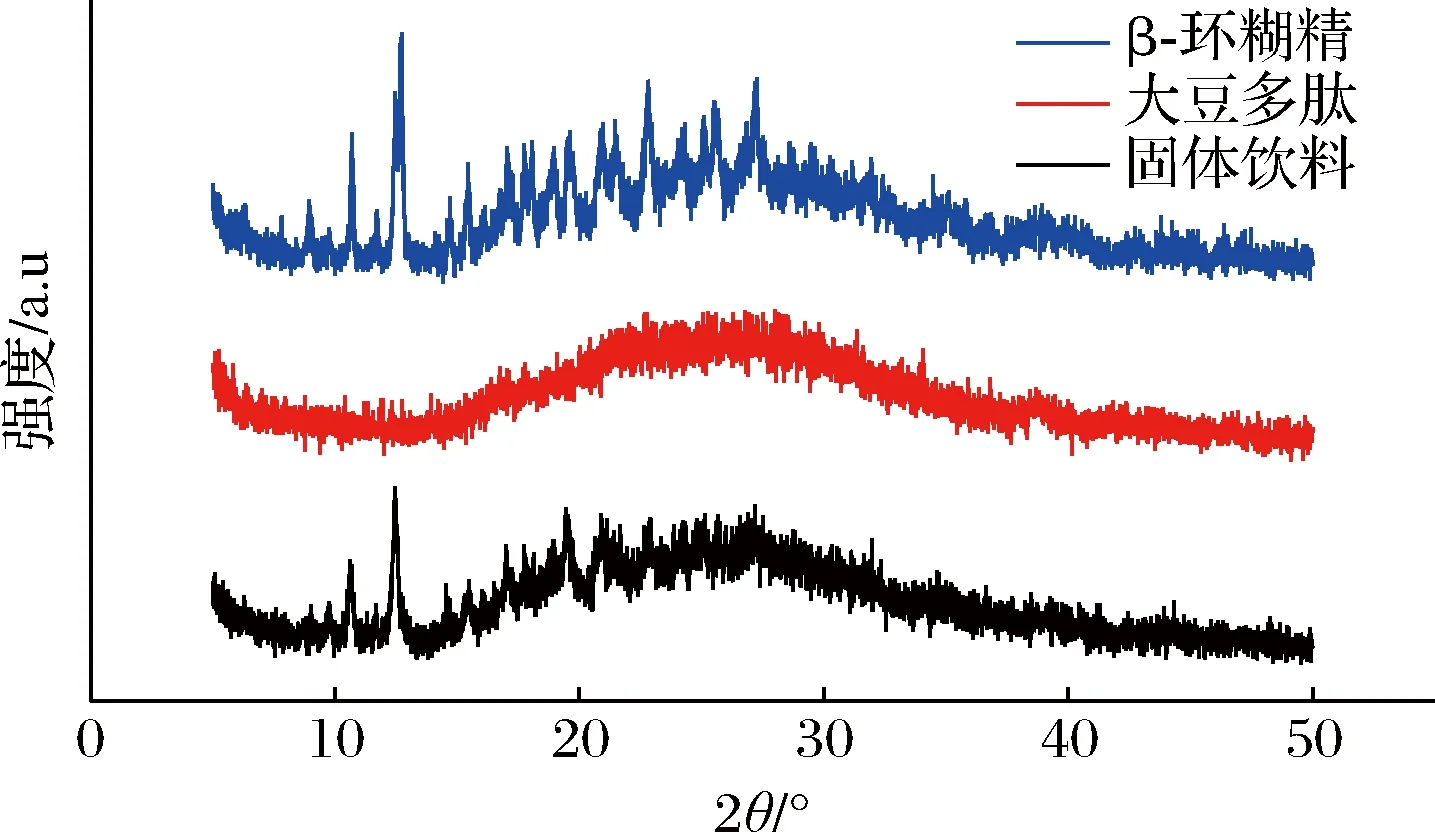
图3 大豆多肽、β-环糊精及固体饮料的XRD谱图
2.7 热重-差热分析
热重-差热同步分析 (thermogravimetric-differential thermal analysis,TG-DTA)可对样品热稳定性、组成及热反应变化有效表征。将图4与图5进行对比可知,当温度在100 ℃附近时,二者均有一定程度的失重,可能是由于样品中水分的蒸发所导致,随着温度的上升也可看出,固体饮料的失重曲线较为平缓,说明固体饮料与大豆多肽相比,具有更好的热稳定性。随着TG曲线的下降,DTA曲线峰值也发生变化,二者对比可发现固体饮料的DTA曲线变化更为显著,115 ℃附近出现1个吸热峰,可能是因为物质的脱水作用[28-29],由此也说明固体饮料在冲调饮用过程中的热稳定性比大豆多肽更佳。

图4 大豆多肽的TG-DTA曲线
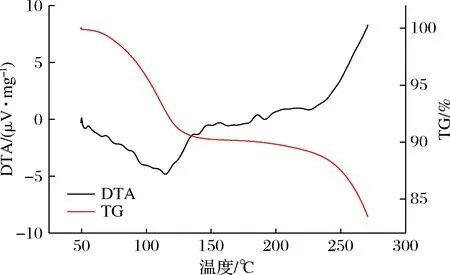
图5 固体饮料的TG-DTA曲线
2.8 体外模拟消化过程中抗氧化活性变化情况
由图6可知,在肠消化阶段的羟自由基清除率比胃消化阶段要高,随着消化时间的延长,羟自由基清除率逐渐升高,最终达到74.55%;由图7可知在肠消化阶段其ABTS阳离子自由基清除率最高达到99.72%,接近100%,二者均说明β-环糊精能够较好的包埋大豆多肽,随着消化时间的延长,固体饮料的抗氧化活性也随之增强,可能是胃、胰蛋白酶处理使得多肽中的抗氧化氨基酸残基更充分暴露,使得抗氧化活性增长[30],也有可能是因为在肠消化阶段包埋后的大豆多肽得到了一定的释放,大豆多肽本身具有较好的抗氧化活性,因此表现出肠消化阶段的抗氧化活性高于胃消化阶段,更有利于人体的吸收利用。
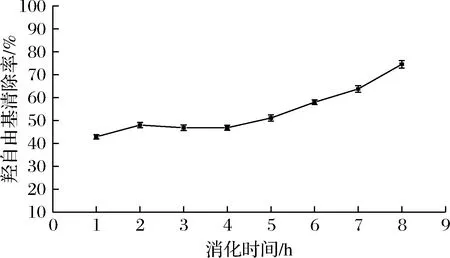
图6 羟自由基清除率变化情况
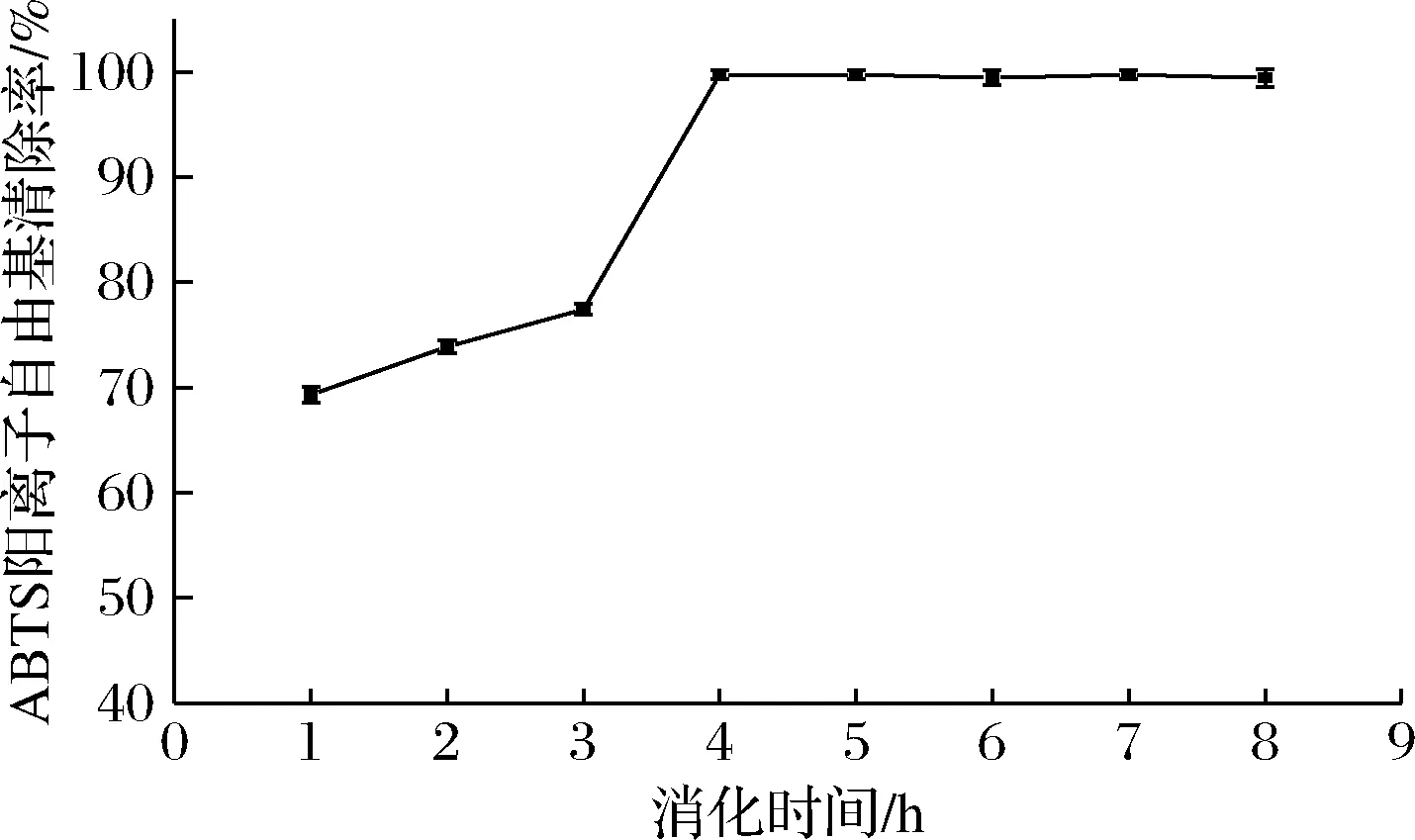
图7 ABTS阳离子自由基清除率变化情况
3 结论
以酶解大豆分离蛋白所得大豆多肽为原料芯材,采用β-环糊精为壁材对其进行包埋掩盖脱苦制备低苦味多肽固体饮料,以包埋率与苦味值为评价指标,在壁材与芯材比例、包埋温度、包埋时间3个单因素的基础上,采用响应面试验进行工艺优化。得到最适的包埋条件为壁芯比为8.85∶1,包埋温度为44.42 ℃,包埋时间为51.02 min,此时包埋率预测值达57.97%;壁芯比8.92∶1,包埋温度为45.30 ℃,包埋时间为53.34 min时,苦味值预测为2.77。结合实验具体情况调整参数为壁芯比9∶1,包埋温度为 45 ℃,包埋时间为50 min。经3次平行实验测得包埋率为(58.04±0.32)%,苦味值为(2.72±0.27)分与预测值无显著差异。固体饮料结构表征结果说明,固体饮料的制备过程为物理包埋过程,体外模拟消化系统对其固体饮料抗氧化活性的影响情况可知,通过包埋掩盖脱苦制得的多肽固体饮料既使多肽本身苦味得到掩盖降低,又仍保持其良好的抗氧化活性。因此,通过包埋掩盖方式制得的低苦味多肽固体饮料,将产生一定的经济和社会效益,具有广阔的开发应用前景。

