橙皮苷、柚皮苷与酪蛋白相互作用机制比较分析
刘雪梅,王华敏,赵 利,白春清
(江西科技师范大学生命科学学院,江西 南昌 330013)
近年来,多酚类化合物因广泛的生物活性备受关注,橙皮苷(hesperidin,HES)、柚皮苷(naringin,NAR)是柑橘类黄酮多酚的典型代表。HES是橙皮素与芸香糖形成的糖苷,多来源于橘子、橙子和柠檬等柑橘类水果中,其分子式为C28H34O15;而NAR存在于葡萄柚、橘、橙的果皮和果肉中,两者结构相似(图1),均有8 个酚羟基,但NAR在C-4位置有一个羟基,而HES在C-4位置是一个甲氧基,在C-5位置有一个羟基。两者因具有抗炎[1]、抗肿瘤[2-3]、清除自由基[1,4]及减低血管脆性[5]等多种生理功能,目前多应用于饲料、食品、医药等领域,其中HES被研究者们认定为一种有前景的预防和治疗新冠肺炎(corona virus disease 2019,COVID-19)感染的药物[6]。因此,HES、NAR的生物活性研究、改性研究以及药理研究成为近年来研究的热点。然而,HES、NAR水溶性和吸收性较差,导致其生物利用度较低。采用递送载体进行包埋,已被证实是改善功能因子水溶性、提高稳定性及生物利用度的有效方法,而适宜载体的开发对解决HES、NAR上述缺陷具有重要意义。
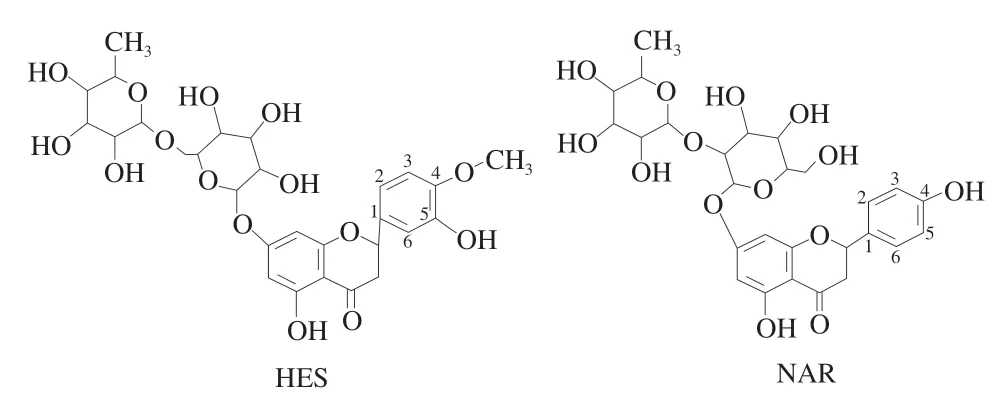
图1 HES、NAR结构式Fig.1 Structural formulae of HES and NAR
CA是哺乳动物奶中的主要蛋白质之一,作为一种公认的安全蛋白质,由于营养价值丰富,还具有优良的表面活性、稳定性、乳化性和自组装性能等功能特性,在食品工业中被广泛应用。有研究发现CA可与离子、小分子、大分子结合并形成复合物,被认为是生物活性物质的天然载体,可包埋和保护小分子功能因子,以促进功能因子更好吸收和释放,提高其在水中的溶解度和化学稳定性,因此,CA在功能因子、药物新型传递系统中得到了越来越多的应用[7-8]。有研究表明CA可与蓝莓花青素产生相互作用并结合,蓝莓花青素被包裹于蛋白质中,可提高蓝莓花青素的稳定性及抗氧化能力[9];程昊[10]发现CA作为载体包埋白藜芦醇后能够提高顺、反式-白藜芦醇的贮藏稳定性。因此,采用CA对NAR、HES进行包埋,可解决NAR、HES的上述缺陷。
蛋白质自组装包埋多酚的过程与蛋白质-多酚间的相互作用密切相关,并对载体稳定性、包埋物的释放等起着决定性作用[11]。目前,CA与多种多酚类物质如茶多酚[12]、木糖醇[13]、花青素[14]间的相互作用已有报道;HES、NAR与蛋白质的相互作用也有相关研究,如:刘蓉[15]发现NAR诱导的牛血红蛋白的荧光猝灭机制是一个静态猝灭过程且两者间的结合仅有一个结合位点;也有研究表明HES与牛血清白蛋白(bovine serum albumin,BSA)间的相互作用为单一的动态猝灭过程,且主要靠疏水作用力结合[16]。然而,国内外对HES、NAR与CA之间的相互作用研究较少,其作用机制尚不清楚,CA作为HES、NAR载体的可行性有待验证。因此,探究CA与HES、NAR的相互作用及其机制,对HES、NAR递送载体的开发具有重要意义。
有研究表明,荧光光谱是研究分子间相互作用的有效方法,通过对荧光数据的分析结合同步荧光光谱、热力学参数分析可获得小分子与蛋白质间的相互作用方式、作用位点及结合力类型等有效信息。分子对接则可利用计算机模拟可视化技术实现受体与配体空间结构的匹配,通过对分子对接结果的分析,计算出多酚与蛋白质之间的相互作用力、相互作用力距离、相互作用官能团及结合位点等,从理论上分析相互作用的可行性以及相互作用机制[11]。
综上,本研究拟综合采用荧光光谱、同步荧光光谱结合热力学参数分析及分子对接比较研究CA与HES及NAR之间的相互作用及机制,以期为黄酮类多酚与蛋白质间的相互作用研究以及CA作为HES及NAR载体的应用提供参考依据。
1 材料与方法
1.1 材料与试剂
酪蛋白(casein,CA) 美国Sigma公司;HES(纯度≥95%)、NAR(纯度≥95%) 上海阿拉丁生化科技股份有限公司;其他试剂均为分析纯。
1.2 仪器与设备
F-2700荧光分光光度计 深圳市谱赛斯科技有限公司;85-2恒温磁力搅拌机 上海向帆仪器有限公司;PHS-25型酸度计 上海仪电科学仪器股份有限公司;激光粒度分析仪 英国Malvern公司;U-T6A紫外-可见分光光度计 屹谱仪器制造有限公司。
1.3 方法
1.3.1 溶液配制
配制pH 7.410 mmol/L的磷酸缓冲盐溶液,并以此为溶剂配制1 mg/mL的CA储备液,4 ℃保存备用;HES或NAR使用去离子水溶解,并使用0.1 mol/L的NaOH溶液将pH值调至12,配制成浓度为1 mmol/L的HES及NAR溶液作为储备液,4 ℃保存备用。
1.3.2 多酚与CA相互作用的荧光光谱
将CA质量浓度固定在0.8 mg/mL,滴加HES或NAR储备液至多酚浓度为0~9.68×10-6mol/L,于不同温度下(298、304、310 K)充分振荡混合1 h后,移入石英比色皿中,在激发波长为280 nm、激发和发射狭缝宽度为5 nm条件下进行扫描,记录发射波长为300~500 nm的荧光光谱。以不含多酚的CA作为空白对照,扫描荧光强度。
为探究CA分别与HES、NAR的相互作用机制,采用Stern-Volmer方程对荧光光谱测定数据进行了拟合,并基于相关参数的分析对荧光猝灭类型进行判断。Stern-Volmer方程如下:
式中:F0为未加入多酚时CA的荧光发射强度;F为含多酚时CA的荧光发射强度;KQ为双分子猝灭过程速率常数/(kJ/(mol•K));[Q]为多酚浓度/(mol/L);KSV为Stern-Volmer的猝灭常数/(L/mol);τ0为没有猝灭剂(HES、NAR)存在下荧光分子平均寿命(10-8s)。
对于静态猝灭,可以使用双对数方程(式(2))计算结合常数(Ka)和结合位点数(n)。
式中:Ka为结合常数/(L/mol);n为结合位点数。
为进一步研究CA与HES、NAR的相互作用所涉及的热力学参数,引入了Van’t Hoff方程计算焓变(ΔH)、熵变(ΔS)和自由能变化(ΔG)。
式中:R为气体常数(8.314 J/(mol·K));T为绝对温度/K;Ka为结合常数/(L/mol)。
1.3.3 同步荧光光谱法分析
设定激发和发射狭缝宽度为5 nm,参照1.3.2节方法制备样品,测定样品在298 K温度下,Δλ分别为15、60 nm时,激发波长为200~350 nm的同步荧光光谱。
1.3.4 分子对接
β-CA是CA的主要成分,本研究将β-CA模型作为CA分子对接模型,探讨β-CA与HES及NAR之间的相互作用。β-CA的氨基酸序列在Uniprot(https://www.uniprot.org/)上搜索,选择UniProtKB为P02666的序列在I-TASSER服务器进行蛋白结构预测[17]。β-CA模型的质量由C-score预测,其C-score为-2.41,属于[-5,2]的置信区间,这表明模型预测的准确性和合理性较好。将预测模型使用SPDVB软件能量最小化,最终三维模型如图2所示。HES和NAR的3D结构(CID分别为10621、442428)从PubChem数据库(http://PubChem.ncbi.nlm.nih.gov)中下载。将配体(HES、NAR)和受体(β-CA)利用AutoDockTools-1.5.6预处理后,使用AutoDock Vina进行半柔性分子对接,且以全蛋白作为潜在的结合位点,进行盲对接。对接坐标为x=64.904、y=64.72、z=67.736,最终选择自由结合能最低的构象,使用Pymol和Ligplot进行分析处理。
图2 β-CA的三维结构Fig.2 Three-dimensional structure of β-CA
1.3.5 粒径的测定
取1.3.2 节制备的复合物(多酚浓度为0、9.68×10-6mol/L),分别放入检测池中依次测量粒径。
1.3.6 抗氧化性的测量
根据文献[18]的方法略有改动。将CA质量浓度固定在1.6 mg/mL,滴加HES或NAR储备液至多酚浓度为0~19.36×10-6mol/L,于298 K条件下充分振荡混合1 h后获得CA-HES、CA-NAR复合物。将20 mmol/L的FeCl3溶液、10 mmol/L TPTZ溶液和0.3 mol/L的醋酸钠缓冲液(pH 3.6)按照体积比1∶1∶10混合配制成TPTZ工作液,避光放置于37 ℃水浴锅中,移取4.5 mL工作液分别加入1 mL CA-HES、CA-NAR复合溶液、HES和NAR样品溶液进行混合。以磷酸缓冲液代替样品为空白(A0),对照组(A1)则以4.5 mL去离子水代替混合液。将反应液放置黑暗中,37 ℃反应10 min后于波长593 nm 处测定吸光度(A实验)。使用式(5)计算出各样品的铁离子还原力。
1.4 数据统计与处理
所有实验重复进行3 次,采用Origin 2019绘图,IBM SPSS Statistics 26软件进行方差分析,Duncan多重检验确定数据间的差异,显著水平为P<0.05。
2 结果与分析
2.1 HES和NAR对CS荧光猝灭作用
蛋白质中因含有色氨酸(Trp)、酪氨酸(Tyr)及苯丙氨酸等残基而发射较强的内源荧光,当激发波长为280 nm时,蛋白质的内源荧光主要由Trp和Tyr产生[19]。由图3可知,CA具有较高的荧光强度,两种多酚的加入均可导致CA荧光强度的降低,且随着多酚浓度的增加,CA的固有荧光逐渐减弱,且在多酚浓度相同条件下,温度越高,降低幅度越大。如:CA在最大吸收波长处的荧光强度为3895.667,当加入HES(4.92×10-6mol/L)后,在不同温度下(298、304 K和310 K)反应1 h荧光强度分别降至3311.333、3097.333、3047.667;类似的,在加入相同浓度的NAR(4.92×10-6mol/L)后,在不同温度下荧光强度分别降至3448.667、3275.333、3236.667。这些结果说明HES及NAR与CA发生了相互作用,且引起了典型的荧光猝灭现象[20]。此外,比较HESCA与NAR-CA的荧光光谱发现,HES对CA荧光强度的猝灭效果强于NAR。如:在298 K条件下,两种多酚浓度相同时(9.68×10-6mol/L),CA荧光强度由4066.333降至2869,降低了29.45%,而HES组的荧光强度则下降了32.39%。同时可发现,CA的最大发射波长为336 nm,随着HES及NAR的引入量增多,发生轻微红移(约1 nm),说明HES及NAR的加入改变了CA的荧光基团的微环境[21-22]。
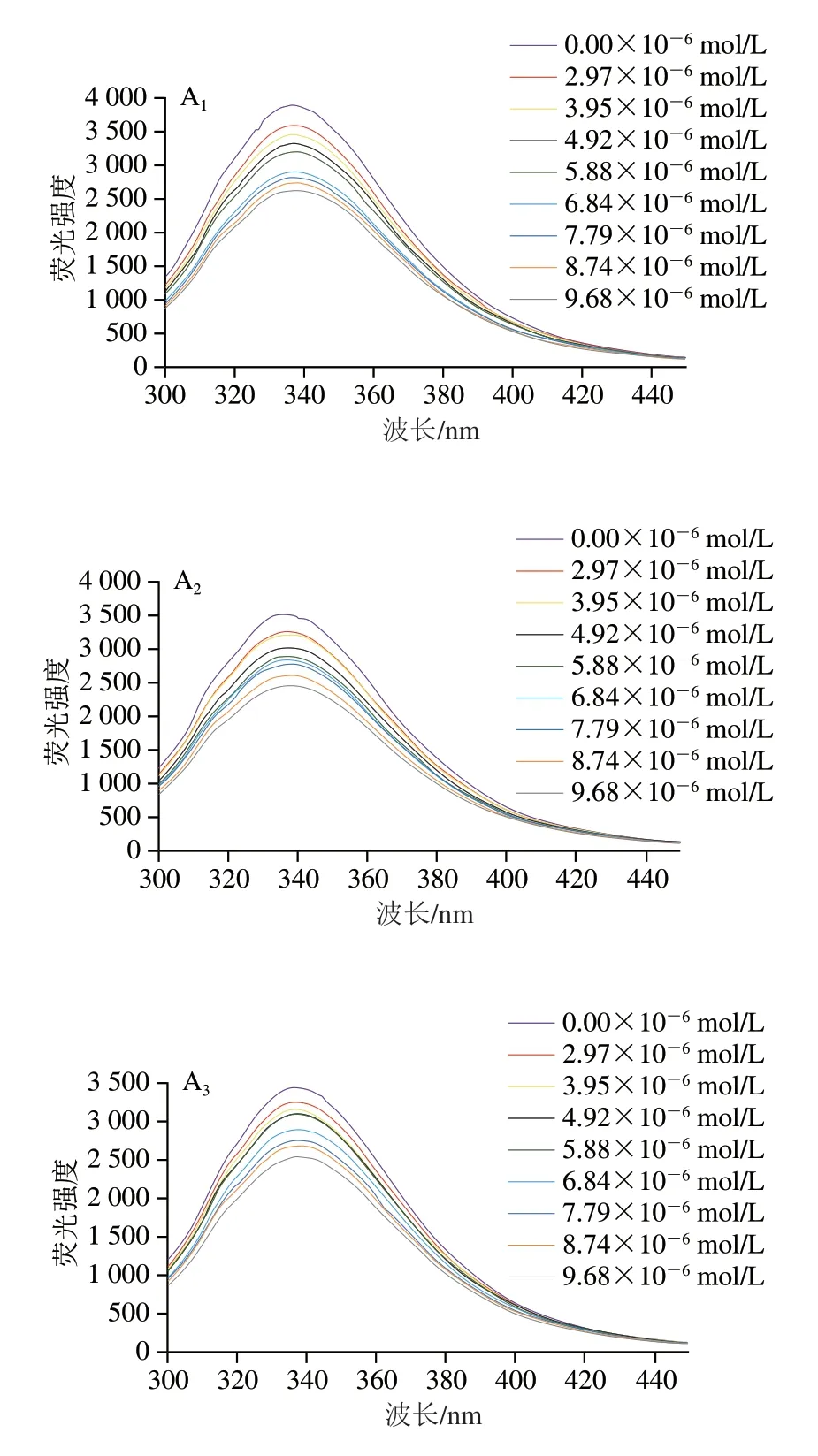
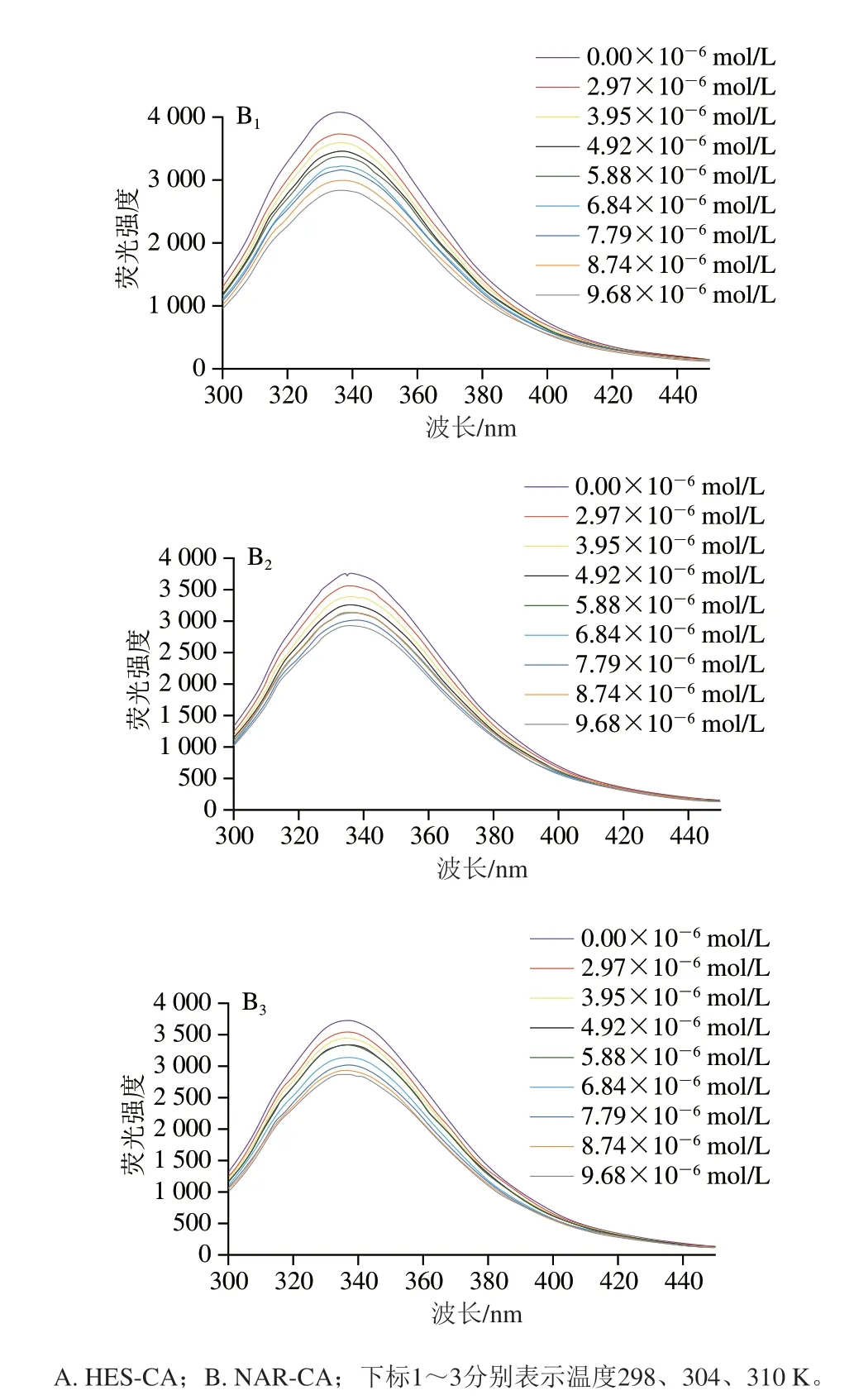
图3 HES、NAR对CA荧光猝灭光谱Fig.3 Fluorescence quenching spectra of HES and NAR for CA
2.2 荧光猝灭机制
CA分别与HES、NAR相互作用的Stern-Volmer方程的曲线拟合结果如图4所示,相关参数见表1。可发现3 种不同温度下拟合曲线的相关系数都大于0.99,表明线性关系良好,因此可以用Stern-Volmer方程进行分析。一般来说,荧光猝灭机理可以分为两种:静态猝灭和动态猝灭,且可根据猝灭常数随温度的变化进行判断。对于静态猝灭,其荧光猝灭的发生是源于荧光分子和猝灭剂之间形成不发光的复合物,因此温度升高,猝灭常数则下降;对于动态猝灭,其荧光强度的降低是源于荧光分子和猝灭剂之间发生相互碰撞所致,即温度越高,荧光分子和猝灭剂之间的有效碰撞越多,扩散系数越大,猝灭常数也随之增大,故而温度升高,动态猝灭常数会随之增加[23]。由表1可知,HES-CA、NAR-CA在298、304 K和310 K处的KQ值都远大于最大扩散碰撞猝灭速率常数值(2.0×1010L/(mol•s)),且猝灭常数(KSV)随温度升高而降低,说明HES、NAR对CA荧光的猝灭都为静态猝灭,且随着温度升高所形成的复合物稳定性降低[24]。同时可发现,相同温度下,HES-CA的KQ、KSV值都大于NAR-CA的对应值,如:298 K条件下,HES-CA的KQ、KSV值分别为5.92×1012L/(mol•s)、5.92×104L/mol,而对应NAR-CA值分别为4.74×1012L/(mol•s)、4.74×104L/mol。说明同等条件下,HES对CA内源荧光的猝灭速率快于NAR。
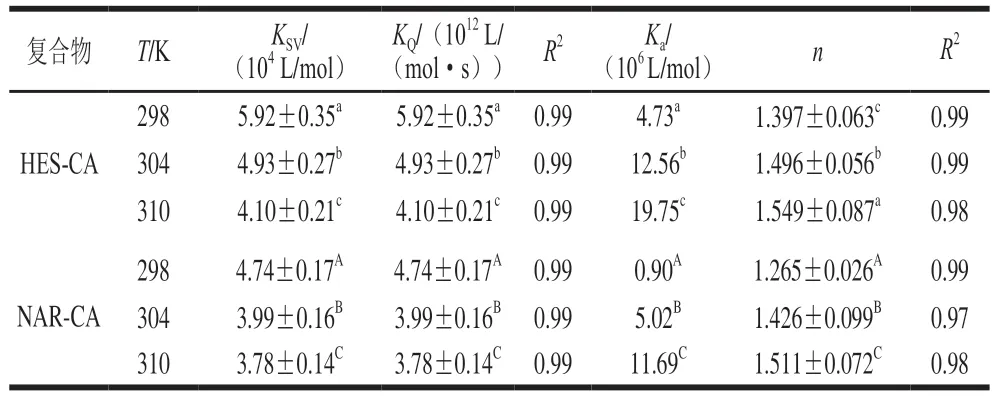
表1 不同温度下HES、NAR与CA相互作用的猝灭常数KSV、结合常数Ka及相关参数Table 1 Quenching constant (KSV),binding constant (Ka) and other related parameters of the interaction between HES or NAR and CA at different temperatures
如表1所示,HES-CA、NAR-CA复合物的Ka均随温度升高而升高,表明两者均为吸热反应[25],这个结论可由表2中的焓变(ΔH)进一步验证;Ka值均在105数量级以上,表明两种多酚与CA之间均有较强的结合作用[26],而HES-CA复合物的Ka值(4.73×106(298 K)、12.56×106(304 K)和19.75×106L/mol(310 K))高于NAR-CA的Ka值(0.90×106(298 K)、5.02×106(304 K)和11.69×106L/mol(310 K)),说明与NAR相比,HES对CA有更强的结合亲和力。目前,有研究发现黄酮类化合物与BSA的结合亲和力HES强于NAR[27],这与本研究结果类似。此外,HES-CA和NAR-CA复合物的n值均约为1.5,表明两种多酚与CA均以3∶2比例结合[28]。同样可发现,NAR-CA复合物的n值低于HESCA,说明NAR与CA的相互作用位点比HES与CA间少,这也与图3所示的HES组比NAR组具有更强的荧光猝灭效果一致。
2.3 热力学分析
热力学参数常用于生物活性物质和蛋白质之间相互作用的判定(如氢键、疏水力和静电力)。通过ΔH和ΔS的符号,可以深入分析分子间的作用力。如:当∆H>0,∆S>0时,表示疏水力占主导地位;∆H<0,∆S<0表示范德华力或氢键占主导地位;∆H<0,∆S>0表示以静电相互作用为主[29]。利用上述2.2节分析结果计算了HES、NAR与CA相互作用相关的重要热力学参数。图5显示了294、304、310 K时lnKa对1/T的变化,然后利用Van’t Hoff方程对实验结合数据进行线性拟合,以确定结合∆H、∆S,计算结果列于表2。可发现,∆H>0且∆S>0,表明两种多酚与CA之间均是疏水相互作用力占主导地位;类似的,有研究发现黄酮类化合物与牛血清白蛋白和人血清白蛋白的相互作用中疏水作用力起主要作用[30]。此外,表2中∆G均小于0,说明两种多酚与CA之间的反应均是自发相互作用[21];而HES-CA的∆H小于NAR-CA,说明在反应过程中,NAR与CA的结合需吸收更多的热量。
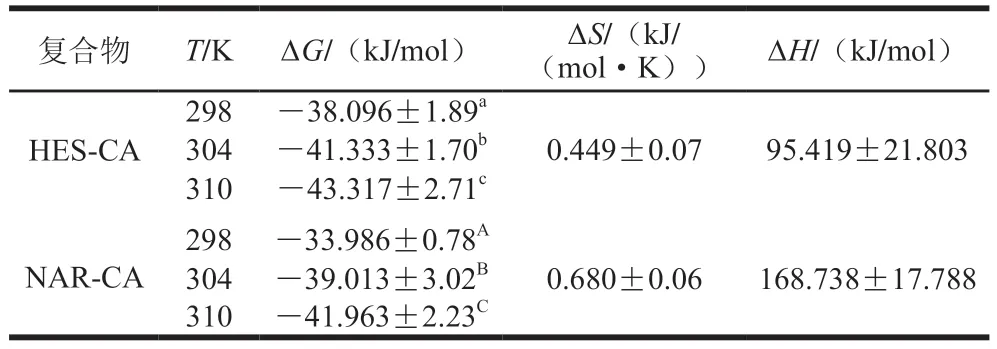
表2 热力学参数Table 2 Thermodynamic parameters
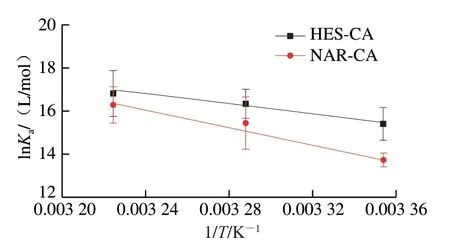
图5 HES-CA、NAR-CA体系的Van’t Hoff曲线Fig.5 Van’t Hoff curve of HES-CA and NAR-CA systems
2.4 同步荧光光谱
同步荧光光谱常用于监测蛋白与多酚结合前后的微环境变化[31],设定Δλ=60 nm、Δλ=15 nm监测到的荧光光谱可分别反映CA中荧光残基基团Tyr、Trp残基微环境的变化。图6显示,未加多酚时,Tyr残基在最大波长处的荧光强度为1002.03,显著低于Trp残基的荧光强度(4080),说明CA的内源荧光主要由Trp残基贡献。而加入多酚后,随着溶液中多酚浓度的增加,两种氨基酸残基的荧光强度都逐渐降低,且多酚对Tyr残基的猝灭能力比Trp残基更强。如当HES浓度为9.68×10-6mol/L时,Trp残基的荧光强度由4080降至2929,下降了28.21%;而Tyr残基的荧光强度由1002.03降至700,降低了30.14%。此外,多酚的加入一定程度上可引起最大波长发生偏移。一般情况下,蓝移表明氨基酸残基周围的疏水性增加,而红移表明这些残基更多暴露于亲水相[32]。由图6A可发现,当Δλ=60 nm时,最大波长从276 nm移至274 nm,发生轻微蓝移,这表示HES和CA相互作用后Trp残基周围的疏水性提高,极性降低;但当Δλ=15 nm时,未发生偏移。因此,HES与CA的结合主要改变了CA中Trp残基附近的微环境,使其腔内疏水环境的极性降低。对于NAR-CA复合物,NAR同样主要改变了Trp残基的微环境,使其疏水性提高。
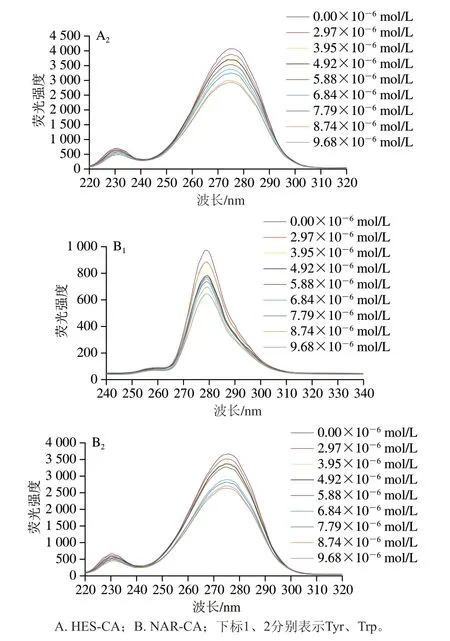
图6 HES-CA、NAR-CA相互作用的同步荧光光谱Fig.6 Synchronous fluorescence spectra of HES-CA and NAR-CA interactions
2.5 分子对接
利用AutoDock Vina软件研究β-CA与HES、NAR的相互作用。图7A1、B1为分别选取的两个最佳构象,其亲和力分别为-10.7、-10.6 kJ/mol,通过观察对接示意图,发现两个多酚与β-CA的结合位点都在疏水内腔深处,形成了相对稳定的构象[33],因此,CA有望成为HES及NAR的包埋载体。为进一步了解HES、NAR与β-CA相互作用的微环境,列出了位于结合位点周围影响较大的残基,图7A2、B2显示,有9 个(Glu132、Arg40、Gln138、Lys63、His163、Lys128、Leu154、Ser111和Gln156)和7 个(Gln138、Lys128、Leu154、Ser111、Gln156、Val110和Met108)氨基酸残基分别参与HES、NAR与CA的结合相互作用。为了观察疏水作用力和氢键对结合时的影响,利用LigPlot作图(图7A3、B3),发现HES与β-CA的氨基酸残基之间存在疏水作用力的有:
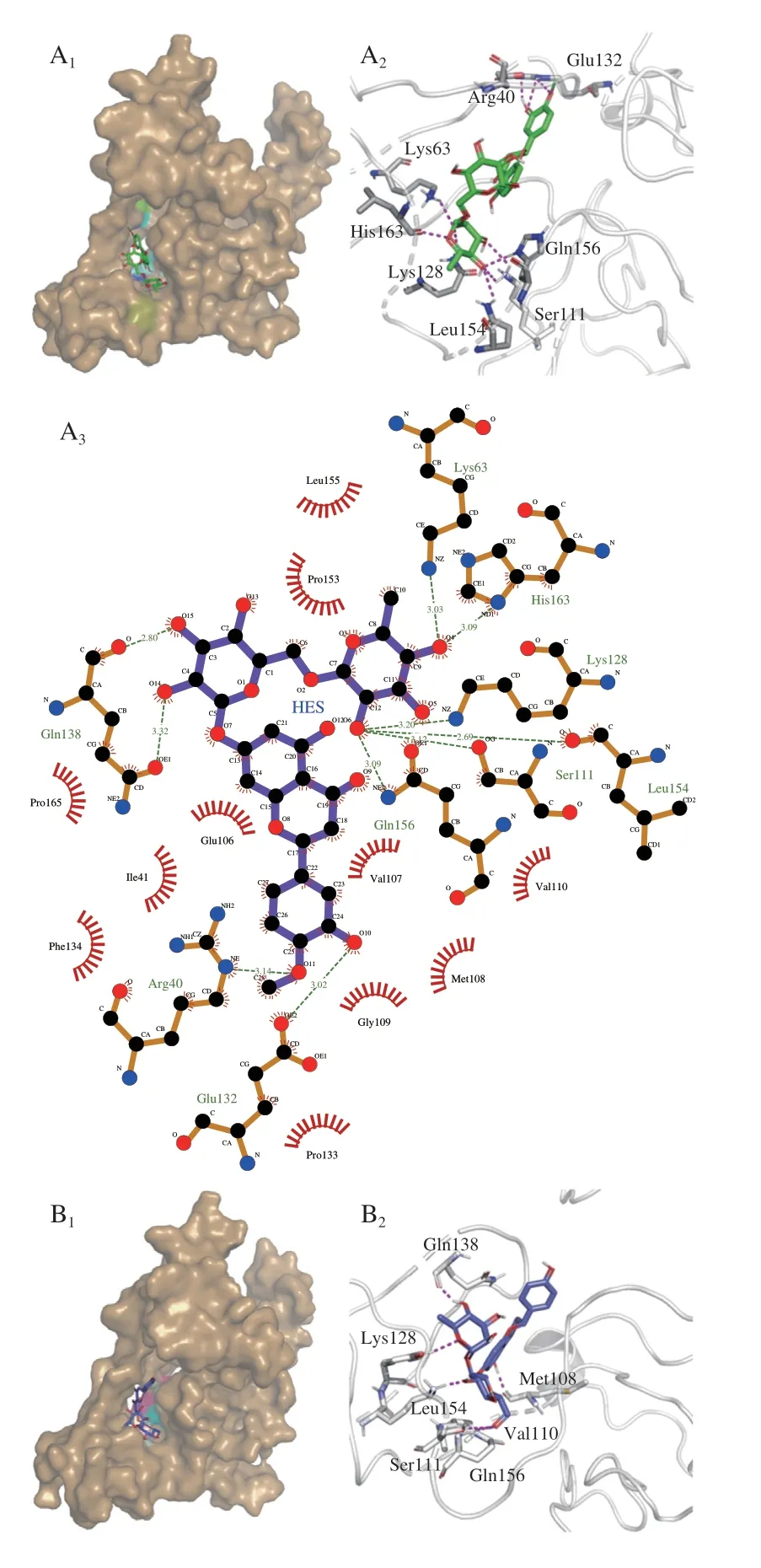
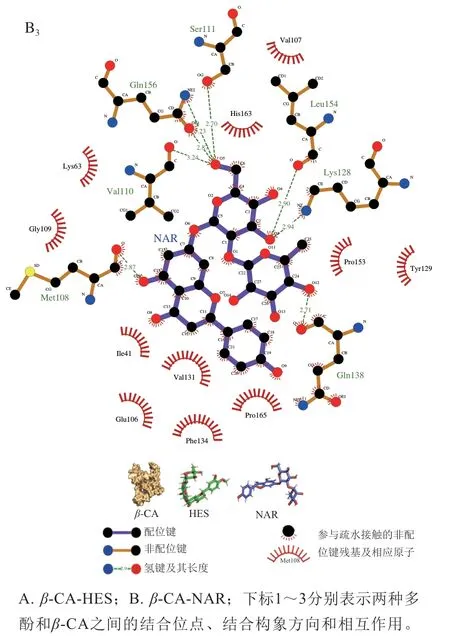
图7 HES、NAR与β-CA复合物的对接位点和相互作用Fig.7 Docking sites and interactions between HES or NAR and β-CA
Pro133、Gly109、Met108、Val107、Val110、Leu155、Pro153、Pro165、Glu106、Ile41、Phe134,同时β-CA腔内Arg40、Glu132、Gln156、Ser111、Leu154、Lys128、His163、Lys63、Gln138与HES存在氢键相互作用,键长为2.69~3.32 Å。一般情况下,键长越接近2.5 Å则氢键作用力越强,而越接近3.5 Å代表氢键作用力越弱。经测量发现,氨基酸Leu154和Gln138与HES间的键长较短,即这两种氨基酸与HES结合时产生了较强的氢键作用,而其他氨基酸因与HES间距离较远主要以疏水相互作用与HES结合。因此,HES与β-CA间以疏水作用力为主,氢键相互作用为辅的模式下发生结合并形成较为稳定的构象。在NAR与β-CA相互作用的2D图中可发现二者间存在11 个疏水作用力和8 个氢键,而HES与β-CA间有11 个疏水作用和10 个氢键,这是由于HES中C-4位置上的甲氧基,C-5的羟基都与CA残基形成了氢键,而NAR在C-4的羟基未与CA残基形成氢键。这个结果表明,羟基化位置和增加甲氧基取代都会影响HES、NAR对β-CA的亲和力[34]。由此可见,与NAR相比,HES对CA拥有更强结合亲和力。
综上,CA与HES、NAR间的相互作用主要为疏水相互作用,且CA与HES间的结合亲和力更强,这一结论与上述的热力学参数分析结论一致。
CA 与HES、NAR 结合前后的平均粒径分别为224.37、220.83、211.07 nm,表明多酚的加入抑制了CA胶束的聚集。由图8可发现,CA与HES、NAR结合后,小尺寸的峰值(约58 nm)增大,大尺寸峰值(约300 nm)减小。有文献表明β-CA胶束的尺寸小于100 nm[35],因此58 nm左右出现的峰值很可能是β-CA胶束或含有多酚的β-CA胶束,峰值增大表明β-CA与HES、NAR的结合增强了胶束的形成,这说明HES、NAR和β-CA相互作用形成了新的复合物,使蛋白质一级结构发生变化;而300 nm左右峰值减小表明形成了一种比胶束更松散的CA结构[36]。总之,多酚的加入明显抑制了CA胶束的聚集,造成平均粒径减小。
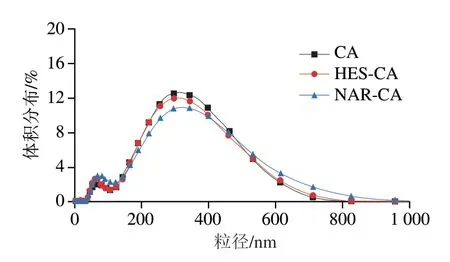
图8 CA与HES、NAR结合前后粒径分布图Fig.8 Particle size distribution of CA before and after combination with HES or NAR
2.6 抗氧化性分析
由图9所示,发现HES-CA、NAR-CA复合物可表现出相较于CA更好的抗氧化性。未加HES、NAR的CA还原力为0.081,而与多酚后相互作用后,HES-CA复合物的总还原力介于0.117~0.183之间,NAR-CA复合物的总还原力介于0.104~0.136之间。实验证明,HES、NAR的加入可使CA的抗氧化能力明显上升且随着多酚添加量的增加而增加,这也证明了CA作为HES、NAR载体的可行性。而HES组的抗氧化活性略强于NAR组,同样可能是因为不同位置的酚羟基抗氧化活性不同造成。
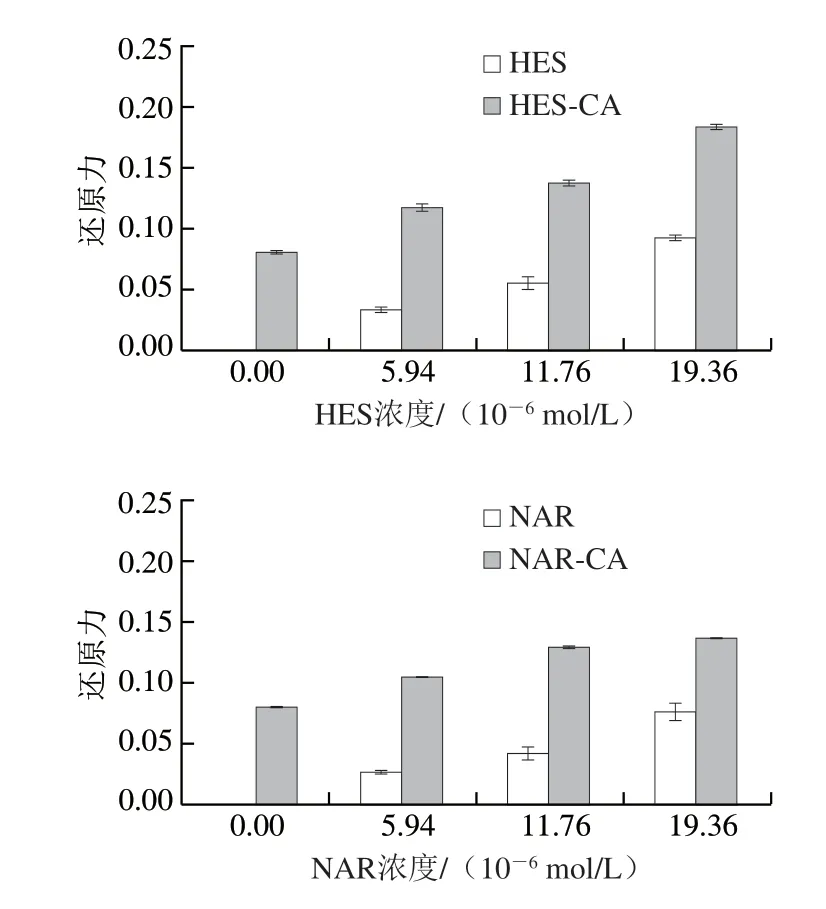
图9 FRAP法测定CA与HES、NAR结合前后的还原力Fig.9 Reducing power measured by FRAP method for CA before and after binding to HES or NAR
3 结论
采用荧光光谱、同步荧光光谱的影响,并结合热力学分析、分子模拟较为全面地比较研究了HES、NAR与CA的相互作用、相互作用的差异及作用机制。结果表明:两种多酚都猝灭了CA的固有荧光,但HES对CA的荧光猝灭效果强于NAR;两种多酚与CA的结合约以3∶2比例自发进行,而疏水作用力在这过程中起重要作用,但HES与CA之间的结合位点更多,结合亲和力更强;两种多酚的加入均引起了CA内Trp残基微环境疏水性的提高、极性降低;HES及NAR可与β-CA的疏水内腔稳定结合,且β-CA与HES间存在更多的氢键作用位点,形成的β-CA-HES复合物较β-CA-NAR更稳定。同时,两种多酚的加入明显抑制了CA胶束的聚集,并增强了复合物的抗氧化活性,因此本研究可为CA作为HES、NAR的可行性提供了参考依据。

