过氧化氢和活性炭脱色对百蕊草多糖结构及应用特性影响的比较分析
邵丽君,琚飞龙,钟 杨,周颖娣,李贝贝,凌依凡,孙 玥,梁 进,李雪玲
(安徽农业大学茶与食品科技学院,安徽省农产品加工工程实验室,安徽 合肥 230036)
多糖应用广泛,其可应用在食品、药品和化妆品领域,是目前研究热点之一[1-3]。国内外学者都在尝试从自然界找到对人类有益的多糖,并且众多研究也发现多糖的结构决定其功效[4]。多糖的结构受许多因素的影响,如提取条件[5]、脱色方式[6]等。其中,针对脱色方式对多糖结构的影响,课题组前期研究已验证了不同脱色处理对百蕊草(Thesium chinenseTurcz.)多糖的一级结构存在影响[7]。多糖可以开发为药品、保健品、食品添加剂及活性物质递送载体等。开发用途不同,多糖精制时采用的脱色方法可能也不同。
百蕊草多糖水溶性很好,但本身不易形成凝胶。目前卡拉胶工业化程度高、世界总产量高、应用前景广泛[8],可作为与百蕊草多糖复配的材料。课题组前期研究比较了百蕊草多糖与瓜尔豆胶、黄原胶、海藻酸钠、亚麻籽胶、卡拉胶和明胶6 种食用胶复配的效果,发现百蕊草多糖与卡拉胶的协同作用最明显[9]。然而,百蕊草多糖与卡拉胶之间的复配特性却鲜见报道。
在前期研究的基础上,本实验以百蕊草多糖为研究对象,进一步比较过氧化氢和活性炭两种脱色方式处理得到的多糖样品在结构、抑制肝癌细胞以及与κ-卡拉胶复配等方面的差异,旨在为百蕊草多糖的结构解析以及生物活性的研究提供一定理论依据,同时为多糖的脱色工艺提供科学参考。
1 材料与方法
1.1 材料与试剂
百蕊草 安徽省亳州市中药材市场;活性炭上海罗恩试剂有限公司;κ-卡拉胶 北京索莱宝科技有限公司;其他试剂皆为分析纯。
1.2 仪器与设备
H-H恒温水浴锅 江苏省金坛市金城国胜实验仪器厂;TTR-型X射线衍射(X-ray diffraction,XRD)仪 日本理学株式会社;YRE-5299旋转蒸发仪 河南省巩义市予华仪器有限责任公司;DHR-1旋转流变仪 美国TA仪器公司;Forma 3111二氧化碳培养箱 美国Thermo Electron公司;DelsaMax Pro粒度分析仪 美国贝克曼库尔特有限公司。
1.3 方法
1.3.1 多糖的制备
参考课题组前期研究的方法[7],以百蕊草为实验材料,采用水提醇沉的方式提取粗多糖,分别用过氧化氢和活性炭对百蕊草粗多糖进行脱色,过氧化氢脱色的样品记为HTP,活性炭脱色的样品记为CTP。
1.3.2 百蕊草多糖物理特性测定
1.3.2.1 XRD测定[10]
将多糖样品冷冻干燥,磨成粉末后过200 目筛,利用TTR型XRD仪进行分析。扫描范围2θ0°~60°,扫描步长0.02°,电压40 kV,电流200 mA,扫描频率8°/min。样品无损检测结束后进行回收。
1.3.2.2 热力学性质测定[11]
采用热重(thermo-gravimetric,TG)法进行分析。称取样品3~5 mg,以氮气作为载体,采用程序升温,升温速率10.0 K/min,起始温度为30 ℃。
1.3.2.3 粒径分布测定[12]
将冻干后的样品用蒸馏水配制成适宜浓度的溶液。所有样品均过0.45 μm纤维素滤膜后,使用DelsaMax Pro粒度分析仪在25 ℃测定样品的平均粒径以及粒径分布,本实验以半径表示粒径。每个样品测定5 次。
1.3.2.4 表观黏度测定[13]
利用旋转流变仪对样品的流变学行为进行测定。分别称取多糖样品配制成不同质量分数(1%、2%和4%)的多糖溶液,涡旋溶解均匀,80 ℃水浴30 min充分溶胀后取出。冷却至室温,置于4 ℃冰箱中过夜。测量前将多糖样品转移至旋转流变仪上。样品周围涂一层硅油以防止水分蒸发,测量温度25 ℃,剪切速率范围0.01~100 s-1。记录样品表观黏度随剪切速率的变化。
1.3.3 HTP、CTP与κ-卡拉胶复配凝胶样品制备及动态流变学参数测定[14]
将不同质量的多糖样品充分溶解在蒸馏水中,添加κ-卡拉胶粉末,使得整个体系中多糖与κ-卡拉胶质量比分别为0∶2.0、0.2∶1.8和0.6∶1.4。将混合溶液调节至pH 7.0,80 ℃恒温水浴30 min。将混合凝胶样品转移到已经预热至70 ℃的动态旋转流变仪平板上,并在平板周围用硅油封边,防止水分挥发对样品产生影响,70 ℃平衡5 min,松弛混合凝胶中存在的螺旋结构,首先进行降温扫描,再进行升温扫描,测定不同温度下混合凝胶的储能模量(G’)与损耗模量(G”),测定复配凝胶的胶凝温度(Tg)及溶胶温度(Tm)。设置升温扫描温度范围为25~80 ℃,降温扫描温度范围为80~25 ℃,阶跃温度为3 ℃/min,固定频率为1 Hz,仪器修边间隙设置为1050 μm,测量间隙为1000 μm。
1.3.4 HTP、CTP对人肝癌细胞株HepG2增殖的抑制活性测定
根据Pires等[15]的方法,使用DMEM培养基,在5% CO2、37 ℃条件下培养HepG2细胞。本研究中使用的细胞介于第20代和第30代之间。
使用MTT法研究不同质量浓度的多糖样品对HepG2细胞的毒性。将处于指数生长期的HepG2细胞接种到96 孔板(4×104个/孔,37 ℃)中,孵育24 h后除去培养基,多次冲洗孔板,除去多余培养基及死细胞。随后将50 μL不同质量浓度(1.0~10.0 mg/mL)的多糖样品分别添加到细胞中,孵育4 h。孵育结束后分别将20 μL 0.5 mg/mL MTT添加到每个孔中,反应1 h。最后,将生成的结晶溶解在二甲基亚砜中,并在570 nm波长处测定吸光度,通过下式计算细胞存活率:
式中:AS为多糖样品处理组吸光度;AC为不含多糖样品处理组吸光度。
1.4 数据处理
2 结果与分析
2.1 不同脱色处理对百蕊草多糖热力学性质的影响
由图1A可知,随着温度升高样品的质量减少。由图1B可知,导数热重(derivative thermogravimetry,DTG)曲线中HTP和CTP第1个失重峰发生在150 ℃前,这是由样品中水分的蒸发造成整体质量减少引起,说明HTP和CTP中含有一定量的结合水[16]。在这一阶段HTP质量损失率为8.87%,CTP质量损失率为5.43%(图1A)。随着温度的增加,两种样品的第2个失重峰分别出现在150~400 ℃(CTP)、200~400 ℃(HTP)范围内。在此温度范围内,HTP的TG值由90.91%降低至47.20%,CTP的TG值由95.57%降低至54.54%(图1A)。这说明两种样品在此期间都发生了剧烈的分解反应。此外,DTG曲线中HTP的第2个失重峰值对应的温度大于CTP,说明HTP在150~400 ℃具有更好的热稳定性。这可能与多糖本身的大分子结构有关系。CTP具有更高的分子质量、侧链多、结构松散[7]。部分外围侧链在较低温度下就会发生分解。当温度升高到500 ℃后,两种样品都发生了缓慢分解,这可能是多糖的主链开始分解;温度升至800 ℃时,两种样品的质量损失率分别为59.33%(HTP)、53.21%(CTP)(图1A),这说明HTP热分解程度大于CTP。
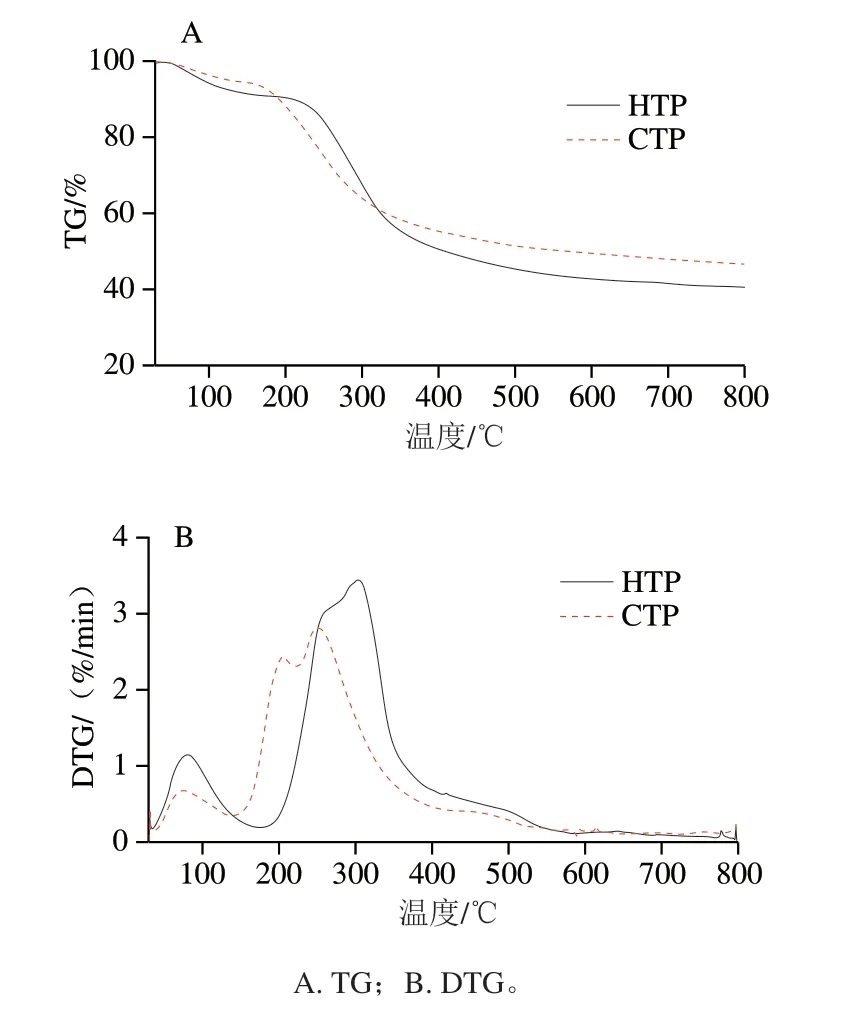
图1 HTP和CTP的TG分析图谱Fig.1 TG analysis of hydrogen peroxide-and activated carbon-treated samples
2.2 不同脱色处理对百蕊草多糖表观黏度的影响
如图2所示,HTP和CTP的表观黏度都表现出随剪切速率的增加而逐渐减小的趋势,这是典型的剪切稀释现象,说明HTP和CTP都是非牛顿流体。这是因为在剪切稀释过程中,聚合物大分子长而无序的链结构越来越趋向一致,使彼此间的交互作用减弱。这一现象也发生在其他植物多糖中[17-18]。除此之外,两种样品的黏度都表现出随多糖添加量增加而变大的现象,这是由于多糖含量增多会增加分子间的相互作用,导致多糖的聚合度增加[19]。总体上,CTP样品的表观黏度大于相同添加量的HTP样品,这可能与HTP及CTP之间结构的差异有关。聚合物分子质量大,流动性差,表观黏度高[20-21]。而CTP的摩尔质量(3.064×105g/mol)远大于HTP(8.349×104g/mol),故CTP样品的表观黏度大于相同添加量的HTP样品。
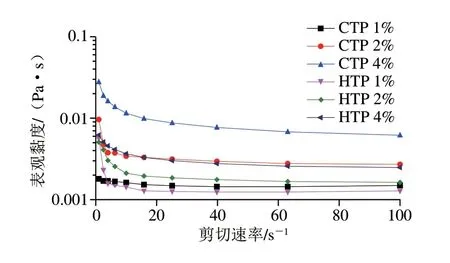
图2 不同剪切速率的HTP和CTP表观黏度Fig.2 Apparent viscosity of hydrogen peroxide-and activated carbontreated samples at different shear rates
2.3 不同脱色处理的百蕊草多糖XRD图谱分析
由图3可知,HTP是一种典型的半晶聚合物,在测量角度范围内无定形组分比晶体组分占优势;CTP在多角度具有尖锐的衍射峰,这说明CTP比HTP具有更高的结晶度[22]。这与两种样品间单糖组成、分子质量差异有关[23]。结晶度会对样品的热稳定性产生影响,CTP的热稳定性优于HTP,这两项结果也相互印证。
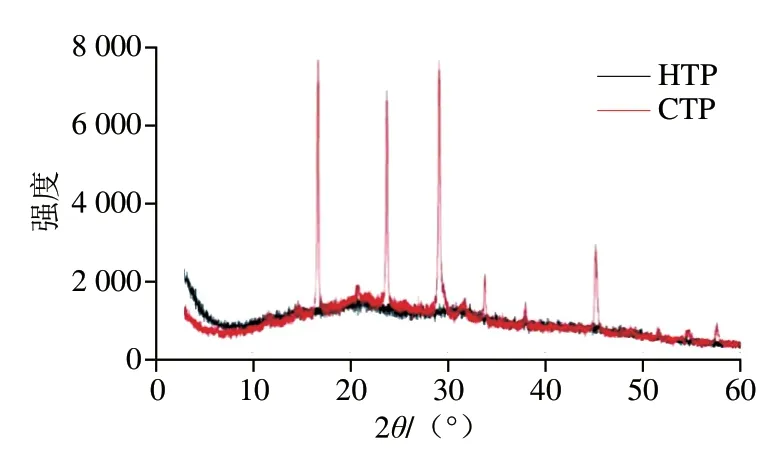
图3 HTP和CTP的XRD图谱Fig.3 XRD pattern of hydrogen peroxide-and activated carbontreated samples
2.4 不同脱色处理的百蕊草多糖粒径分布分析
如图4A所示,HTP多糖样品的粒径分布图上存在3 个峰,其各组分峰值对应的粒径大小分别是6.5、63.0、545.3 nm,其中粒径大小为63.0 nm左右的多糖分子分布较多。如图4B所示,CTP多糖样品的粒度分布图上只出现2 个峰,其峰值对应的粒径大小分别为5.5 nm和82.7 nm,粒径分布相对集中。因此,HTP和CTP多糖分子在粒径分布上存在一定差异,HTP多糖样品的粒径分布图在500 nm左右出现了一个小峰,说明HTP多糖样品中可能存在较大粒径的多糖分子聚集体,这可能与HTP多糖分子中含有较多的极性基团有关。因为,溶液中的多糖大分子做布朗运动,多糖分子之间会相互碰撞发生聚集,当聚集达到一定程度后有可能出现较大的多糖分子聚集体,从而呈现出较大的粒径分布[24]。结合前期研究发现,HTP含有更多醛基和羟基,化学性质更加活泼,更容易形成氢键,聚合成大分子。

图4 HTP(A)和CTP(B)粒径分布图Fig.4 Particle size distribution of hydrogen peroxide-(A) and activated carbon-treated (B) samples
2.5 不同脱色处理的百蕊草多糖对肝癌细胞增殖的抑制作用
天然的硫酸多糖较少,且以藻类为主[25]。已有较多报道表明,硫酸多糖或者硫酸化的多糖具有多种生物活性,如抑制癌细胞增殖、抗凝血、抗炎等[26-27]。
由图5可知,在低质量浓度(1~6 mg/mL)时,HTP和CTP对肝癌细胞抑制作用较小且剂量效应不明显;在实验设置的高质量浓度(6~10 mg/mL)范围内,CTP表现出明显的剂量效应,质量浓度为10 mg/mL时,肝癌细胞的存活率只有46.20%,此质量浓度范围内,HTP对肝癌细胞的抑制作用较小。因此,CTP和HTP对肝癌细胞的抑制作用有明显差异,推测可能是CTP和HTP的硫酸基团数量和水溶性不同所致。前期研究发现,CTP的硫酸基团含量为(14.33±0.04)%,而HTP的硫酸基团含量只有(7.03±0.03)%,且二者水溶性差异明显(HTP:(75.33±0.12)%,CTP:(99.70±0.15)%);杨东达[28]发现多糖的抗肿瘤活性与硫酸基团数量及其水溶性有极大关联性,这些与图5的结果一致。
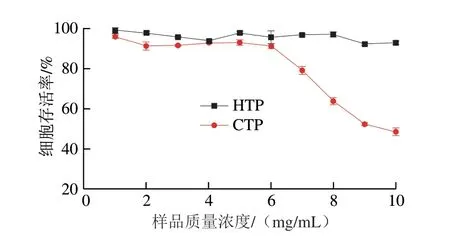
图5 不同质量浓度HTP和CTP对HepG2细胞存活率的影响Fig.5 Effects of different concentrations of hydrogen peroxide-and activated carbon-treated samples on survival rate of HepG2 cells
2.6 不同脱色处理的百蕊草多糖对卡拉胶Tg及Tm的影响
温度降温扫描过程中,G’及G”发生变化;当G’与G”出现交叉点时,该点对应的温度为Tg。升温扫描过程中,G’=G”时,该点对应的温度为Tm。温度滞后性就是Tg远低于Tm,其在食品工业生产中有重要的意义;有些制品要求在热处理过程中凝胶结构能保持相对稳定,如琼脂的很多应用就依赖于其显著的温度滞后现象[29]。
由图6和表1可知,添加了HTP及CTP复配胶的温度滞后幅度都增加,且CTP的增加幅度大于HTP。通过改变HTP及CTP添加量,可以得到满足需要的各种卡拉胶胶凝剂复配产品,如低添加量(0.2%)可以提高Tg、Tm,这对于要求在热处理过程中凝胶结构能保持相对稳定的制品较有利;而高添加量(0.6%)可以降低Tg、Tm,这对于卡拉胶应用于培养基胶凝剂有利。
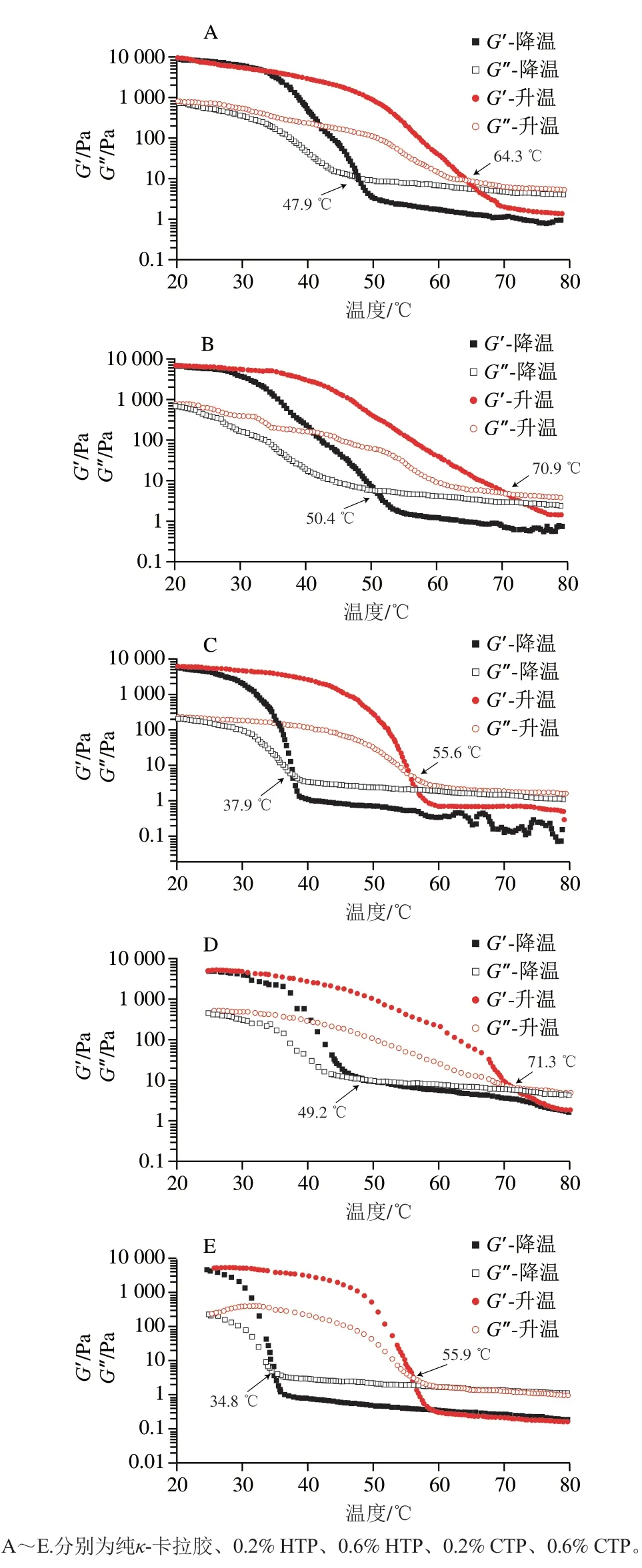
图6 不同添加量HTP和CTP对κ-卡拉胶共混凝胶G’和G”的影响Fig.6 Effects of different concentrations of hydrogen peroxide-and activated carbon-treated polysaccharides on G’ and G” of their blends with κ-carrageenan

表1 不同添加量HTP和CTP对κ-卡拉胶共混凝胶Tg和Tm的影响Table 1 Effects of different concentrations of hydrogen peroxide-and activated carbon-treated polysaccharides on Tg and Tm of their blends with κ-carrageenan
3 结论
经过氧化氢脱色制备的百蕊草多糖,分子质量小,分子中含有更多半乳糖醛酸基团,热稳定性稍差;而活性炭脱色制备的百蕊草多糖,分子质量大,分子中含有较多硫酸基团,热稳定性好。与HTP相比,CTP表现出更大的表观黏度。结构上的差异使两种多糖HTP、CTP在应用特性上也表现出不同,CTP对肝癌细胞HepG2表现出更强的抑制活性,而HTP在实验质量浓度范围内对肝癌细胞HepG2的抑制活性较低;同时,CTP对复配胶的温度滞后增加幅度大于HTP,这有利于扩大κ-卡拉胶在食品加工行业中的应用。本实验可为开发多糖时选择合适的脱色方式提供一定参考。

