多种益生菌固态湿发酵豆粕营养品质变化研究
■陈 玥 龚玉石
(广东药科大学食品科学学院,广东广州 510006)
豆粕是大豆种子提油后的副产品,粗纤维含量低(31~72 g/kg),粗蛋白含量高(440~530 g/kg)。由于豆粕易获得,富含氨基酸,具有高营养价值,并且供应充足,是十分有价值的植物蛋白质来源,也是重要的蛋白质资源,长期以来一直被认为是食品和动物饲料的重要和廉价的蛋白质来源[1-3]。但由于豆粕适口性低、蛋白质分子质量较大,并且含有大量抗营养因子(antinutritional factors,ANF),如大豆球蛋白(11S)、β-伴大豆球蛋白(7S)、胰蛋白酶抑制因子、植酸等,严重影响豆粕营养物质的消化和吸收,限制豆粕的营养价值和应用价值[4-6]。一些研究表明,益生菌固态湿发酵有助于提高营养物质的消化率和蛋白质质量[7],并且是处理ANF 和大分子营养物质的有效策略。在发酵过程中益生菌的生长会产生许多酶(如蛋白酶、纤维素酶和植酸酶等),从而增加了豆粕的功能[5]。尽管有足够研究表明发酵能够提高豆粕的质量,但不同益生菌破坏ANF和释放营养物质的机制各不相同,许多研究也认为不同益生菌发酵过程中产生的酶与底物相互作用的活性不同,是发酵豆粕品质参差不齐的主要原因[8]。鉴于少有研究对比不同益生菌降解ANF和产生各种活性酶的能力不同之处,因此本研究将探究地衣芽孢杆菌、凝结芽孢杆菌、罗伊氏乳杆菌、米曲霉、酿酒酵母、沼泽红假单胞菌等6种益生菌发酵豆粕对其营养品质的影响,以此为筛选混菌发酵的益生菌种类奠定基础,也为优化豆粕营养、充分利用加工的豆粕作为饲料蛋白,特别是为猪、家禽等非反刍动物的高品质饲料的开发提供新思路。
1 材料与方法
1.1 菌种及试验材料
饲用纯豆粕为市场采购,使用前过60目筛。
地衣芽孢杆菌(Bac-l)、凝结芽孢杆菌(Bac-c)、米曲霉(Asp)、酿酒酵母(Sac)均购置于山东伟多丰生物技术有限公司;罗伊氏乳杆菌(Lac)购于聚生原生物科技有限公司;沼泽红假单胞菌(Pho)采购于山东鑫卓源化工有限公司;红糖(纯度100%)采购于广东南字科技有限公司;十二烷基硫酸钠聚丙烯酰胺凝胶配制试剂盒、蛋白质分子量标准(Marker)、SDS-PAGE蛋白上样缓冲液均购于上海碧云天生物技术有限公司;蛋白酶、植酸酶、纤维素酶ELISA试剂盒购买于上海酶联生物科技有限公司;抗营养因子ELISA试剂盒购买于天津龙舟方科工程技术有限公司;发酵袋购置于河南鑫科包装材料有限公司;其余试剂耗材均由化学试剂供应商提供。
1.2 菌种活化最适宜条件筛选
1.2.1 不同红糖添加量对菌种活化程度的影响
在保持其他活化条件相同的情况下,在100 mL纯化水中按照红糖添加量分别为0、0.25、0.5、1.0、2.0 g配制不同浓度的红糖活化培养基,121 ℃高压灭菌20 min,然后按照5%的添加量分别将6种益生菌接入不同浓度培养基,37 ℃、150 r/min 分别培养48 h,在紫外分光光度计600 nm波长下测定OD值,选取最适宜的红糖添加量。
1.2.2 不同活化时间对益生菌活化程度的影响
在保持红糖浓度及其他活化条件不变的情况下,在100 mL纯化水中按照最适宜红糖添加量配制红糖培养基,121 ℃高压灭菌,以5%的添加量分别将6 种益生菌接入不同浓度培养基,37 ℃,150 r/min培养0、12、24、36、48、60 h,分别在紫外分光光度计600 nm波长下测定OD值,确定最适宜培养时间。
1.3 发酵试验
取20 g 豆粕置于发酵袋中,接入罗伊氏乳杆菌,装入安有单向排气阀的发酵袋中,按照5%接种量分别接种已活化的地衣芽孢杆菌(Bac-l)、凝结芽孢杆菌(Bac-c)、罗伊氏乳杆菌(Lac)、米曲霉(Asp)、酿酒酵母(Sac)、沼泽红假单胞菌(Pho),将水分活度调整到45%,每组4个平行,用灭菌玻璃棒搅拌混合均匀,罗伊氏乳杆菌发酵袋扎紧封口,其余菌种豆粕发酵袋自然敞口,放在室温灭菌操作台上培养48 h后不进行传统高温烘干,以四分法取样直接测定6组益生菌发酵豆粕的营养指标、酶活性、抗营养因子含量指标,比较不同益生菌发酵豆粕的营养品质变化以及不同菌种对豆粕营养品质改变的差异,以期筛选最优混菌发酵的益生菌菌种。
1.4 指标测定及方法
1.4.1 发酵豆粕营养指标测定方法
pH:取样品3.00 g,加入90 mL的纯化水,磁力搅拌器搅拌30 min,5 000 r/min 离心5 min,取上清液(为浸提液)测定pH。
干物质回收率(dry matter recovery rate, DMR):准确称量发酵前后物料质量,测定发酵前后物料含水量,计算发酵前后干物质质量。
粗蛋白:参照GB/T 6432—2018 的方法进行粗蛋白含量的测定。
酸溶蛋白:参照NY/T 3801—2020 及相关资料的方法进行酸溶蛋白含量的测定。
1.4.2 发酵豆粕酶活性测定
蛋白酶:使用对应体系的缓冲溶液分别提取豆粕中的酸性蛋白酶、中性蛋白酶和碱性蛋白酶[9-10],用ELISA试剂盒检测酶活性。
植酸酶和纤维素酶:取1.5 g 豆粕,加入40 mL 乙酸-乙酸钠缓冲溶液(pH 5.5),振荡0.5 h,在0~4 ℃条件下避光1 h,摇匀离心取上清液[11],采用ELISA 试剂盒分别检测豆粕中植酸酶活性和纤维素酶活性[11],操作步骤严格按照说明书进行。
1.4.3 发酵豆粕抗营养因子含量测定
1.4.3.1 SDS-PAGE凝胶电泳
按照Laemmli[12]、张梦媛[13]的方法并适当改良,提取上清液与上样缓冲液混合后进行SDS-PAGE 凝胶电泳,电泳结束后使用考马斯亮蓝染液染色,甲醇-冰醋酸溶液脱色完全后放入凝胶成像系统进行拍照和分析。
1.4.3.2 ELISA法测定
按照ELISA试剂盒方法,分别提取并检测发酵前后豆粕中大豆球蛋白、β-伴大豆球蛋白、胰蛋白酶抑制因子含量,操作步骤严格按照说明书进行。
1.5 数据统计与分析
用SPSS 22 进行单因素方差分析(one-way ANOVA),用LSD 法和Duncan’s 法进行数据间的多重比较,P<0.05 认为存在统计学差异。采用Excel 软件和Origin 9.4软件进行绘图。
2 结果与分析
2.1 培养基红糖浓度及益生菌活化时间筛选
2.1.1 最佳培养基红糖添加量的确定
将红糖分别按照0、0.25、0.5、1.0、2.0 g 配制成浓度分别为0、0.25%、0.5%、1.0%、2.0%的红糖活化培养基,将6种益生菌接入不同红糖浓度培养基培养48 h后,结果如图1 所示。随着红糖添加量的增加,地衣芽孢杆菌和米曲霉呈现先下降后上升的趋势,其余4 种益生菌菌群数量出现先上升后下降再上升的趋势,由图1 可见,在添加量为2.0 g 时红糖活化培养基有良好的活化效果,为避免培养基物质浓度对发酵豆粕结果测定产生影响,因此以2.0 g 作为最佳培养基红糖添加量。

图1 不同红糖添加量对6种益生菌活化菌数的影响
2.1.2 最佳活化时间的确定
在保持红糖添加量及其他活化条件不变的情况下,将6 种益生菌培养0、12、24、36、48、60 h,结果如图2所示。在图2中可看出,6种益生菌的菌体密度随活化时间的增加整体呈现先上升后有所下降的趋势。这是由于益生菌在达到稳定期后继续活化而进入到衰亡期。从图2 可见6 种益生菌在活化48 h 时,菌体密度均达到较为理想的水平,因此认为48 h可作为益生菌的最佳活化时间。

图2 不同活化时间对6种益生菌活化菌数的影响
2.2 不同益生菌固态湿发酵对豆粕营养成分的影响
测定益生菌发酵后豆粕中pH、DMR、粗蛋白及酸溶蛋白含量,结果如表1所示。在湿发酵过程中,Lac发酵豆粕的DMR 相较于其他5 种益生菌发酵豆粕显著提高(P<0.05),达到94%以上,其余益生菌发酵豆粕的DMR并无显著差别(P≥0.05)。与未发酵豆粕相比,Lac 和Asp 发酵豆粕的pH 明显下降(P<0.05),其中Lac下降最多(pH 4.93)。6种益生菌发酵豆粕中的粗蛋白含量均得到显著提高(P<0.05),其中Bac-l、Pho的粗蛋白含量增加明显,由未发酵豆粕的12.05%增加至30.39%与31.55%。6 种益生菌发酵豆粕的酸溶蛋白含量也均有明显提高(P<0.05),其中Sac和Pho发酵豆粕的酸溶蛋白含量提升最为显著,由6.09%提升至12.98%。

表1 不同益生菌固态湿发酵对豆粕营养成分的影响
2.3 不同益生菌固态湿发酵对豆粕酶含量的影响
2.3.1 发酵豆粕中蛋白酶活性变化
6 种益生菌发酵豆粕的酸性蛋白酶、中性蛋白酶及碱性蛋白酶活性改变如图3所示,可以看出益生菌发酵豆粕的酶活性较未发酵豆粕有显著改变(P<0.05)。其中Sac、Pho发酵豆粕的酸性蛋白酶活性均显著提升(P<0.05),Pho发酵豆粕的酸性蛋白酶活性最高,达到2 527.09 U/g;Bac-l、Lac、Sac、Pho 发酵豆粕能够影响豆粕中中性蛋白酶的活性,与未发酵豆粕相比,Sac发酵豆粕的中性蛋白酶活性提升最多,从441.61 U/g 提升至899.49 U/g;Bac-l、Bac-c、Sac都有良好的产碱性蛋白酶能力,能够有效提升发酵豆粕中碱性蛋白酶的活性(P<0.05),以Bac-l活性最高,达434.52 U/g。

图3 不同益生菌固态湿发酵对豆粕三种蛋白酶活性的影响
2.3.2 发酵豆粕中纤维素酶和植酸酶活性变化
图4、图5 分别显示发酵豆粕中纤维素酶和植酸酶的活性。由图4 可知,相较于未发酵豆粕,Bac-c、Lac、Sac、Pho发酵豆粕的纤维素酶活性提升,Sac、Pho两种益生菌对纤维素酶活性的影响最大,分别达到1 938.05 U/g和1 697.76 U/g。如图5所示,Bac-l、Lac、Sac 发酵豆粕的植酸酶活性较发酵前均有提高,Sac、Lac的植酸酶活性分别达到1 297.47 U/g和933 U/g。

图4 不同益生菌固态湿发酵对豆粕纤维素酶活性的影响
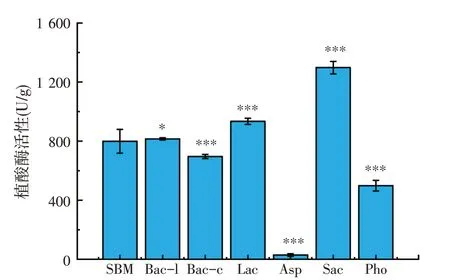
图5 不同益生菌固态湿发酵对豆粕植酸酶活性的影响
2.4 不同益生菌固态湿发酵对豆粕抗营养因子成分及含量的影响
2.4.1 不同益生菌发酵豆粕的抗原蛋白条带变化
SDS-PAGE 凝胶电泳结果见图6,Asp 发酵的豆粕大分子蛋白质基本都被降解为分子量小于15 ku的小分子蛋白质;Pho 发酵的豆粕,35 ku 以下的小分子蛋白质也有明显提升。Bac-l、Bac-c、Asp、Sac、Pho发酵的豆粕β-伴大豆球蛋白的蛋白质条带也明显减弱;Asp和Sac的大豆球蛋白条带有明显变化,尤其是Asp发酵的豆粕抗原蛋白条带基本消失,抗原蛋白的降解效率较高。

图6 不同益生菌固态湿发酵豆粕SDS-PAGE电泳结果
2.4.2 不同益生菌固态湿发酵对豆粕抗营养因子含量的影响
由表2 可知,Asp 发酵豆粕的β-伴大豆球蛋白降解率达64.71%,Bac-c、Lac、Pho对β-伴大豆球蛋白含量也有显著影响(P<0.05);6 种益生菌中只有Lac、Asp、Sac这3种益生菌发酵的豆粕大豆球蛋白含量有显著降低(P<0.05),Lac 和Asp 发酵豆粕中大豆球蛋白降解率分别达到68.61%、78.94%;6 种益生菌均能够显著降低发酵豆粕中胰蛋白酶抑制因子含量(P<0.05)。其中Bac-l和Asp发酵豆粕对豆粕原料中的胰蛋白酶抑制因子含量影响最大,胰蛋白酶抑制因子降解率分别达到97.84%和98.07%。
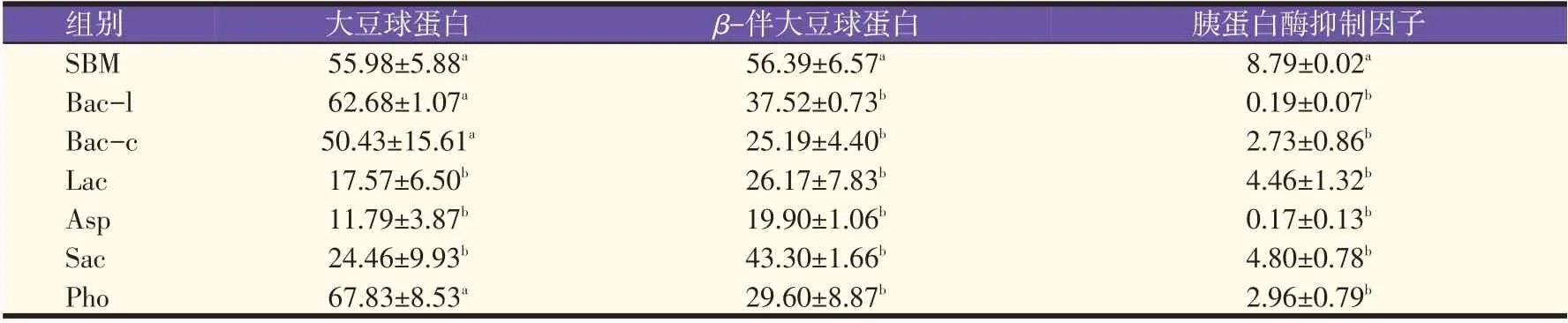
表2 不同益生菌固态湿发酵对豆粕抗营养因子含量的影响(mg/g)
3 讨论
本试验选取地衣芽孢杆菌、凝结芽孢杆菌、罗伊氏乳杆菌、米曲霉、酿酒酵母、沼泽红假单胞菌这6种益生菌用于豆粕发酵,其中沼泽红假单胞菌作为光合细菌的一种在水产养殖领域的应用较广[14],添加罗伊氏乳杆菌的饲料能够显著增加仔猪的体重,并表现出促进生长肥育猪生长性能的趋势[15],但罗伊氏乳杆菌和沼泽红假单胞菌在豆粕发酵的应用中未见或少见报道。本试验以各项营养指标的含量为基准,试图发现新的适用于豆粕固态湿发酵的益生菌,筛选适宜混合发酵的益生菌,充分优化豆粕成为高品质饲料原料。为适应实际大规模生产工艺,采用红糖(纯度100%)作为培养基碳源对益生菌菌粉进行活化。本试验对于红糖的添加量和菌粉活化的时间进行了探讨,最终确定在红糖添加量为2.0 g、活化时间为48 h时,6种益生菌菌数均达到理想状态。
固态湿发酵中益生菌的生长繁殖需要一定的能量来源,吴庆宇等[16]研究发现,豆粕经益生菌的分解作用会造成部分干物质损失,DMR 是反应发酵过程中底物营养损失程度的一个指标。在本试验使用的6 种益生菌中,罗伊氏乳杆菌发酵豆粕的DMR提升最显著。这可能与罗伊氏乳杆菌发酵豆粕pH 降低相关,pH降低限制了细胞酶的活性,能够有效减少干物质的损失,这与毛银等[17]、谢全喜等[18]的研究结果十分相似。豆粕中粗蛋白含量和酸溶蛋白的量也是评价发酵豆粕营养品质的重要指标,Dai等[19]研究发现,经枯草芽孢杆菌发酵后,豆粕中的粗蛋白和可溶性蛋白含量分别从38.25%和6.26%显著提高到44.82%和22.78%;Sharawy 等[20]研究发现,酵母菌发酵豆粕后豆粕粗蛋白含量能够提升至50%。本试验的6 种益生菌均能够有效提高豆粕的粗蛋白和酸溶蛋白含量,其中地衣芽孢杆菌和沼泽红假单胞菌的粗蛋白含量是未发酵豆粕的2.52倍和2.62倍,酸溶蛋白则未发酵豆粕的1.71倍和2.13倍。
蛋白酶酶解豆粕可以增加蛋白质的溶解度,因此能够降低大豆蛋白免疫反应性。益生菌发酵提高蛋白酶的活性可以降低直接使用酶解法降解蛋白质带来的副作用,减少对环境的影响并增加蛋白质的营养价值[21]。6种益生菌发酵豆粕对豆粕酶活性的影响也不相同,沼泽红假单胞菌发酵豆粕的酸性蛋白酶活性最高,达到2 527.09 U/g,酿酒酵母发酵豆粕的中性蛋白酶活性提升至899.49 U/g;地衣芽孢杆菌发酵的豆粕碱性蛋白酶活性达434.52 U/g。植酸是豆粕中非常重要的抗营养因子,降低植酸含量能够有效地提高豆粕营养价值。植酸酶可有效降解豆粕中植酸。纤维素酶活性提高不仅能够提高益生菌对豆粕纤维素的利用程度,也可以在底物中为植酸酶提供更多降解植酸的机会,因此也能够有助于减少植酸含量[8]。试验选取的6 种益生菌中酿酒酵母和罗伊氏乳杆菌对豆粕植酸酶和纤维素酶的活性提升作用最为明显。
豆粕中大分子蛋白质和抗营养因子的存在在一定程度上会阻碍豆粕营养物质的吸收利用。马静等[22]研究发现,益生菌发酵能够有效降低豆粕中抗营养因子的含量,Aguirre等[23]、Medeiros等[24]也发现益生菌具有蛋白质水解活性,能够降解蛋白质。观察6种益生菌发酵豆粕蛋白相对分子质量条带分布,米曲霉发酵豆粕的大分子蛋白质基本被降解为分子量小于15 ku的小分子蛋白质,沼泽红假单胞菌发酵豆粕35 ku以下的小分子蛋白质含量也明显提升。6种益生菌发酵均能够降低豆粕中β-伴大豆球蛋白的含量,其中米曲霉发酵豆粕β-伴大豆球蛋白降解率达到64.71%;罗伊氏乳杆菌和米曲霉发酵豆粕中大豆球蛋白降解率分别达到68.61%、78.94%;相比于未发酵豆粕,6种益生菌均能够显著降低发酵豆粕中胰蛋白酶抑制因子含量,其中地衣芽孢杆菌和米曲霉发酵对豆粕原料中的胰蛋白酶抑制因子降解率分别能够达到97.84%和98.07%,几乎能够完全消除。由此可见米曲霉发酵在消除豆粕中抗营养因子含量、降解大分子蛋白质方面都有非常大的优势。
4 结论
综上所述,在固态湿发酵豆粕的过程中,6种不同的益生菌对发酵豆粕营养品质的影响各不相同,各有优劣。从营养成分变化、抗营养因子含量变化和酶含量变化三个角度综合指标来看,米曲霉、沼泽红假单胞菌、罗伊氏乳杆菌能够显著优化豆粕营养品质,尤其以米曲霉固态湿发酵提升豆粕营养品质的能力最佳。因此,可以进一步探讨益生菌复合发酵方式,使不同益生菌优势互补,能够更有效地优化发酵豆粕的营养品质。

