茯茶多糖的消化特性和体外免疫调节活性比较研究
袁旭霜, 慕妍璐, 王 凡, 薛原野, 孙玉姣
(陕西科技大学 食品科学与工程学院, 陕西 西安 710021)
0 引言
多糖是一类广泛存在于多种动植物及微生物中的生物大分子,通常由10个以上的单糖通过糖苷键连接而成,具有多种生物活性[1].近年来,越来越多的研究表明,植物多糖属于非消化性多糖,即可直接通过上消化道,最终到达盲肠和结肠中被肠道微生物消化利用[2-4].因此,利用体外消化模型研究多糖的性质越来越受到关注.另外,茶多糖因具有多种生物活性而备受关注,包括抗氧化[5,6]、抗肥胖[7]、抗血糖[8]和免疫调节[9]等.免疫调节是天然多糖最重要的生物功效之一[10].近年来,许多体外和体内的研究证实了茶多糖对免疫系统刺激有潜在的调节作用[11,12].
茯茶起源于陕西泾阳,属于后发酵黑茶,由其特有的冠突散囊菌(“金花”)发酵,“金花”能够影响茯茶的滋味香气及营养[13].茯茶因具有多种保健功能和其独特的风味已被茶爱好者广泛接受.目前已鉴定出茯茶中的主要成分包括多酚、多糖、酚酸、黄酮类化合物等[14],但近年来对于茯茶的研究主要集中于多酚[15],而多糖作为另一种生物大分子活性物质研究较少.有研究报道,茯茶多糖是一种非消化性多糖[16],具有抗氧化、抗肥胖、抗炎等活性,并可通过调节肠道菌群改善溃疡性结肠炎和缓解高脂膳食引起的肥胖[17,18].前期报道发现酸提茯茶多糖、水提茯茶多糖和碱提茯茶多糖具有一定的抗氧化作用[5],并通过对比发现碱提茯茶多糖在环磷酰胺诱导的免疫抑制小鼠模型中比水提茯茶多糖拥有更优的免疫调节活性,其中肠道菌群发挥着重要作用[19].据此本研究使用酸提、水提和碱提等不同提取方法获得茯茶多糖,研究三种茯茶多糖在模拟胃液和肠液中的消化特性和对巨噬细胞RAW 264.7免疫调节活性的影响,为深入探讨茯茶多糖的免疫调节活性作用机制和对茯茶资源的深加工利用提供理论支撑.
1 材料与方法
1.1 材料与仪器
1.1.1 主要材料与试剂
茯茶,购于陕西省泾阳茯茶镇,粉碎后过60目筛,备用;RAW 264.7小鼠巨噬细胞,购自中国科学院细胞生物学研究所(中国,上海);胃蛋白酶、胰酶、胰蛋白酶、四氮唑蓝(MTT)、二甲基亚砜(DMSO)、Triton X-100、对硝基苯磷酸、中性红、脂多糖、对硝基苯磺酸,购于上海阿拉丁生化科技股份有限公司;胆盐、青链霉素混合液(100X),购于北京索莱宝科技有限公司;DEME高糖培养基,购于美国Hyclone公司;四季青胎牛血清(FBS),购于浙江天杭生物科技股份有限公司;其余试剂均为国产分析纯.
1.1.2 主要仪器
T2600系列分光光度计,上海佑科仪器有限公司;LYZ恒温摇床,上海龙跃仪器设备有限公司;BXM-30R立式高压蒸汽灭菌锅,上海圣科仪器公司;SW-CJ-1FD超净工作台,苏州净化设备有限公司;BC-J160S二氧化碳培养箱,博讯科技有限公司;Varioskan flash全波长扫描多功能读数仪,赛默飞世尔科技有限公司;CT15RT台式高速冷冻离心机,上海天美生化仪器设备工程有限公司;CKX53倒置显微镜,美国OLYMPUS公司;高效液相色谱仪配备2 414示差折光检测器,日本岛津公司;液相色谱柱TSK-gel G4000SW(7.5 mm × 30.0 cm),日本Tosoh公司.
1.2 茯茶多糖的制备
茯茶多糖(FBTPs)根据之前报道的文献[5]制备.根据之前的报道可知酸提茯茶多糖(Ac-FBTPs)、水提茯茶多糖(W-FBTPs)和碱提茯茶多糖(A-FBTPs)中性糖的含量分别是65.58%±1.66%、58.17%±0.19%和56.99%±0.34%;糖醛酸含量分别16.82%±1.36%、20.91%±1.07%和29.76%±0.83%;分子量分别为4.70×105±2.81 Da、4.78×105±1.92 Da和4.68×105±1.51 Da.
1.3 茯茶多糖的体外消化
1.3.1 茯茶多糖在体外模拟胃液中的消化
胃电解液的配制:NaCl(3.1 g/L),KCl(1.1 g/L),NaHCO3(0.6 g/L),CaCl2·2H2O(0.15 g/L),胃蛋白酶(350 mg/2L),使用1M HCl调pH至2.0.
胃液的配制:取150 mL胃电解质液加入35 mg胃蛋白酶以及1 mL CH3COONa(1 M pH5.0),最终使用0.1 M HCl调pH至2.0.
模拟胃液消化:配制15 mL 8 mg/mL的多糖母液和15 mL胃液充分混匀,于37 ℃ 150 rpm分别反应0、4 h和6 h后,迅速放置沸水浴中反应5 min以终止反应,用于测定后续实验[16].
1.3.2 茯茶多糖在体外模拟肠液中的消化
小肠电解液的配制:NaCl(5.4 g/L),KCl(0.65 g/L),CaCl2·2H2O(0.33 g/L),用0.1M NaOH调pH至7.0.
小肠液的配制:取100 g电解液加入13 mg胰酶蛋白酶、100 g胰酶(7% w/w)和200 g胆盐(4% w/w),搅拌均匀,最终使用0.1 M NaOH调pH至7.5.
模拟小肠液消化:取3.0 mL模拟小肠液与10.0 mL模拟胃液充分混匀,于37 ℃ 150 rpm分别反应0、4 h和6 h后,迅速放置沸水浴中反应5 min以终止反应,用于测定后续实验[16].
1.3.3 茯茶多糖在体外模拟消化中总糖含量、还原糖含量和糖醛酸含量的测定
采用苯酚-硫酸法测定消化液中总糖含量[20];采用3,5-二硝基水杨酸法测定消化液中还原糖含量[21];采用间羟联苯法测定消化液中糖醛酸含量[22].
1.3.4 茯茶多糖在体外模拟消化中分子量的测定
根据高效凝胶渗透色谱法(HPGPC,High-performance size exclusion chromatography)分别测定不同提取方法获得的茯茶多糖消化前和分别在胃液和肠液中消化6 h后分子量的变化情况[23].
1.4 茯茶多糖的体外免疫调节活性的研究
1.4.1 小鼠巨噬细胞RAW 264.7细胞的培养
RAW 264.7细胞使用含有10%胎牛血清和1%双抗(青霉素和链霉素)的DEME高糖培养基,于37℃、5% CO2条件下培养,隔天进行传代.
1.4.2 茯茶多糖对小鼠巨噬细胞RAW 264.7细胞活力的研究
采用MTT法[24]测定Ac-FBTPs、W-FBTPs和A-FBTPs对RAW 264.7细胞活力的影响.使用完全培养基将对数生长期细胞悬液浓度调整为1×105cell/mL,接种于无菌96孔板中培养(100 μL),于37 ℃、5% CO2条件下培养24 h.弃上清,分别加入100 μL不同浓度的FBTPs(25 μg/mL、50 μg/mL、100 μg/mL、200 μg/mL、400 μg/mL、800 μg/mL,由DEME培养基配制)作为实验组,同时分别以DEME培养基和10 μg/mL脂多糖(LPS)作为空白对照和阳性对照,孵育24 h.弃上清,每孔加入100 μL MTT溶液(0.5 mg/mL),于37℃、5% CO2条件下继续培养4 h,弃上清,每孔加入200 μL DMSO,温室振荡10 min.酶标仪于570 nm处测各孔的吸光度.细胞活力表示为:
细胞活力=样品组吸光度值/空白组吸光度值
(1)
1.4.3 茯茶多糖对小鼠巨噬细胞RAW 264.7细胞吞噬能力的研究
采用中性红吞噬实验[24]测定Ac-FBTPs、W-FBTPs和A-FBTPs对RAW 264.7细胞吞噬能力的影响.使用完全培养基将对数生长期细胞悬液浓度调整为1×105cell/mL,接种于无菌96孔板中培养(100 μL),于37℃、5% CO2条件下培养24 h.弃上清,分别加入100 μL不同浓度的FBTPs(25 μg/mL、50 μg/mL、100 μg/mL、200 μg/mL,由DEME培养基配制)作为实验组,同时分别以DEME培养基和10 μg/mL脂多糖(LPS)作为空白对照和阳性对照,孵育24 h.弃上清,每孔加入100 μL 0.1%中性红生理盐水溶液,于37 ℃、5% CO2条件下继续培养4 h,弃上清,使用PBS清洗数次至无色后,每孔加入100 μL细胞裂解液[1.0 M(冰乙酸∶乙醇=1∶1,(v/v)],继续培养1 h使细胞完全裂解.酶标仪于540 nm处测各孔的吸光度.细胞吞噬指数表示为:
细胞吞噬指数=样品组吸光度值/空白组吸光度值
(2)
1.4.4 茯茶多糖对小鼠巨噬细胞RAW 264.7酸性磷酸酶活力的影响
采用Suzuki等[25]的方法测定Ac-FBTPs、W-FBTPs和A-FBTPs对RAW 264.7细胞酸性磷酸酶活力的影响.使用完全培养基将对数生长期细胞悬液浓度调整为1×105cell/mL,接种于无菌96孔板中培养(100 μL),于37℃、5% CO2条件下培养24 h.弃上清,分别加入100 μL不同浓度的FBTPs(25 μg/mL、50 μg/mL、100 μg/mL、200 μg/mL,由DEME培养基配制)作为实验组,同时分别以DEME培养基和10 μg/mL脂多糖(LPS)作为空白对照和阳性对照,孵育24 h.弃上清,每孔依次加入25 μL 1% Triton X-100和150 μL 1 mg/mL对硝基苯磷酸溶液,于37 ℃、5% CO2条件下继续培养1 h后,每孔加入3.0 M 50 μL NaOH溶液终止反应.酸性磷酸酶活力指数表示为:
酸性磷酸酶活力指数=样品吸光度值/空白组吸光度值
(3)
1.4.5 茯茶多糖对小鼠巨噬细胞RAW 264.7分泌一氧化氮含量的影响
采用Griess法[26]测定Ac-FBTPs、W-FBTPs和A-FBTPs对RAW 264.7细胞分泌一氧化氮(Nitric Oxide,NO)含量的影响.使用完全培养基将对数生长期细胞悬液浓度调整为3×105cell/mL,接种于无菌96孔板中培养(100 μL),于37℃、5% CO2条件下培养24 h.弃上清,分别加入100 μL不同浓度的FBTPs(25 μg/mL、50 μg/mL、100 μg/mL、200 μg/mL,由DEME培养基配制)作为实验组,同时分别以DEME培养基和10 μg/mL脂多糖(LPS)作为空白对照和阳性对照,孵育24 h,收集上清.将50 μL的细胞上清液加入新的96孔板中,依次加入50 μL GriessA试剂和50 μL GriessB试剂,振荡混匀,酶标仪于540 nm处测各孔的吸光度.使用亚硝酸钠(NaNO2)溶液浓度分别为0、6.25、12.5、25、50、100 μmol/L(由DMEM培养基配制)作为标准,根据其浓度和吸光值作标准曲线,根据回归方程计算出细胞上清液中所含NO的量.
1.5 数据处理
Microsoft Excel 2019处理实验数据,独立重复实验n=5,取平均值,数据以平均值±标准差表示;SPSS 22进行统计学分析,采用LSD分析进行数据差异显著性分析,P<0.05有显著差异,并使用Origin 2019绘图.
2 结果与讨论
2.1 茯茶多糖的体外消化
2.1.1 茯茶多糖在体外模拟胃液和肠液中的消化
三种茯茶多糖在模拟胃和小肠消化过程中总糖含量、还原糖含量和糖醛酸含量的变化见表1所示.
在模拟胃液消化中,酸提茯茶多糖(Ac-FBTPs)、水提茯茶多糖(W-FBTPs)和碱提茯茶多糖(A-FBTPs)在未消化(0 h)前总糖含量分别为3.59±0.82、3.43±0.84和3.46±0.84 mg/mL,消化6 h后总糖含量分别为3.59±0.82、3.52±0.85和3.49±0.83 mg/mL;Ac-FBTPs、W-FBTPs和A-FBTPs在未消化前还原糖含量分别为0.16±0.00、0.22±0.01和0.23±0.01 mg/mL,消化6 h后还原糖含量分别为0.18±0.02、0.23±0.02和0.26±0.03 mg/mL;Ac-FBTPs、W-FBTPs和A-FBTPs在未消化前糖醛酸含量分别为0.62±0.44、0.79±0.31和1.21±0.20 mg/mL,消化6 h后糖醛酸含量分别为0.71±0.41、0.86±0.35和1.19±0.22 mg/mL.结果表明Ac-FBTPs、W-FBTPs和A-FBTPs在胃液消化前后总糖含量、还原糖含量和糖醛酸没有发生显著性变化,即三种多糖在胃中不被消化;
在模拟肠液消化中,Ac-FBTPs、W-FBTPs和A-FBTPs在未消化(0 h)前总糖含量分别为3.18±0.95、3.22±0.93和3.27±0.88 mg/mL,消化6 h后总糖含量分别为3.21±0.93、3.22±0.93和3.19±0.95 mg/mL;Ac-FBTPs、W-FBTPs和A-FBTPs在未消化前还原糖含量分别为0.14±0.01、0.19±0.01和0.21±0.01 mg/mL,消化6 h后还原糖含量分别为0.17±0.02、0.22±0.02和0.20±0.02 mg/mL;Ac-FBTPs、W-FBTPs和A-FBTPs在未消化前糖醛酸含量分别为0.63±0.44、0.80±0.33和1.18±0.21 mg/mL,消化6 h后糖醛酸含量分别为0.69±0.40、0.84±0.34和1.16±0.21 mg/mL.结果表明Ac-FBTPs、W-FBTPs和A-FBTPs在肠液消化前后总糖含量、还原糖含量和糖醛酸没有发生显著性变化,即三种多糖在小肠中同样不被消化.综上所述,Ac-FBTPs、W-FBTPs和A-FBTPs能够通过消化系统,不被模拟胃液和肠液消化,推测其可完全到达大肠,为肠道微生物利用.
2.1.2 茯茶多糖在体外模拟胃液和肠液中分子量的变化
(1)Ac-FBTPs在体外模拟胃液和肠液中分子量的变化
图1表示Ac-FBTPs在未消化前、胃液消化6 h后及肠液消化6 h后分子量的分布情况.Ac-FBTPs在消化前后只有一个单一的对称峰,随着消化时间的增加,经胃液和肠液消化后Ac-FBTPs峰的保留时间未发生偏移,表明胃液和肠液对Ac-FBTPs分子量没有影响.
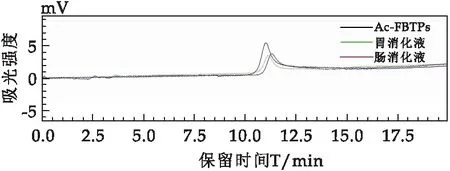
图1 Ac-FBTPs体外模拟胃液消化6 h后的HPGPC色谱图
(2)W-FBTPs在体外模拟胃液和肠液中分子量的变化
图2表示W-FBTPs在未消化前、胃液消化6 h后及肠液消化6 h后分子量的分布情况.同样,W-FBTPs在消化前后,随着消化时间的增加,胃液和肠液消化后W-FBTPs峰的保留时间没有显著性差异,表明胃液和肠液对W-FBTPs分子量没有影响.
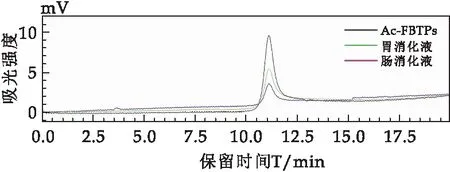
图2 W-FBTPs体外模拟胃液消化6 h后的HPGPC色谱图
(3)A-FBTPs在体外模拟胃液和肠液中分子量的变化
图3表示A-FBTPs在未消化前、胃液消化6 h后及肠液消化6 h后分子量的分布情况.与Ac-FBTPs和W-FBTPs类似,随着消化时间的增加,胃液和肠液消化后A-FBTPs峰的保留时间一致,表明胃液和肠液对A-FBTPs分子量没有影响.
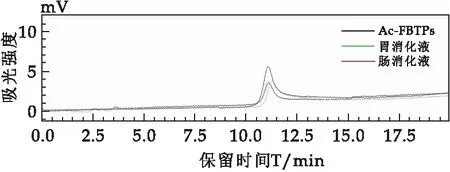
图3 A-FBTPs体外模拟胃液消化6 h后的HPGPC色谱图
综上所述,三种茯茶多糖在模拟胃液和肠液中分子量保留时间没有发生显著性变化,表明这三种多糖在消化系统中不被消化,这与前面测定结果保持一致.
2.2 茯茶多糖的体外免疫调节活性的研究
2.2.1 茯茶多糖对小鼠巨噬细胞RAW 264.7细胞活力的影响
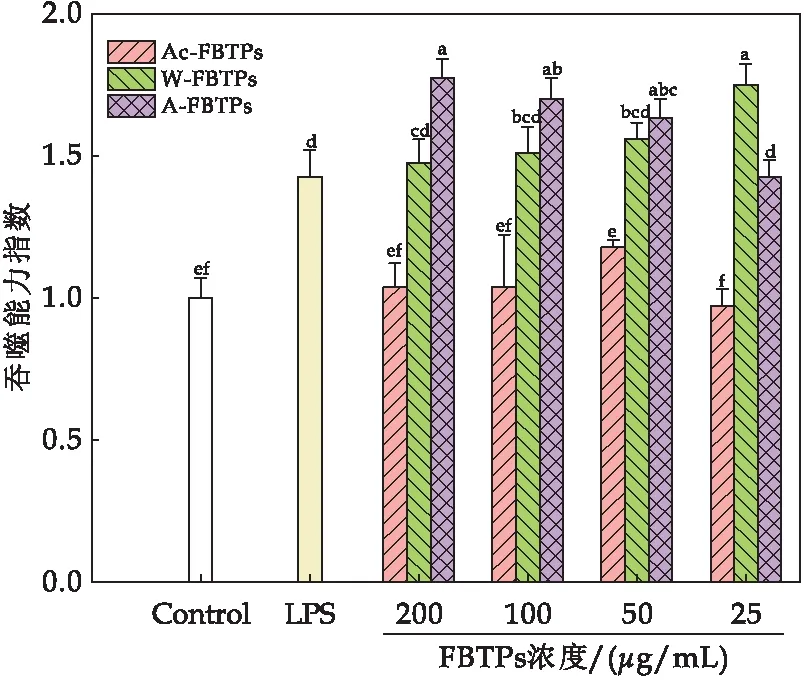
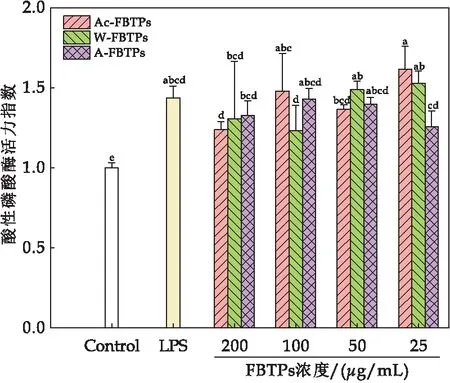
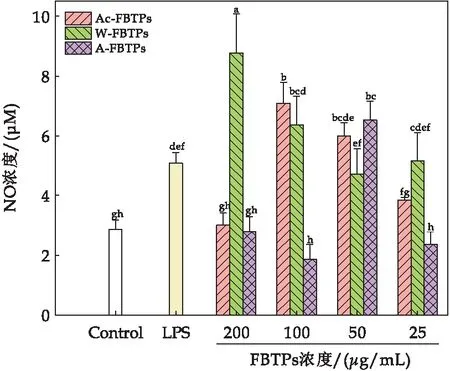
巨噬细胞的活力可以作为免疫激活的一个指标[27].如图4所示,不同浓度的Ac-FBTPs、W-FBTPs和A-FBTPs相较于空白对照,均能够显著增强巨噬细胞RAW 264.7的细胞活力.其中LPS阳性处理对照与空白对照相比,RAW 264.7的细胞活力达到1.75;Ac-FBTPs浓度为25 μg/mL、50 μg/mL、100 μg/mL、200 μg/mL、400 μg/mL和800 μg/mL时与空白对照相比细胞活力分别达到1.62、1.58、1.54、1.49、1.51和1.48;W-FBTPs浓度为25 μg/mL、50 μg/mL、100 μg/mL、200 μg/mL、400 μg/mL和800 μg/mL时与空白对照相比细胞活力分别达到1.80、1.79、1.83、1.81、1.64和1.38;A-FBTPs浓度为25 μg/mL、50 μg/mL、100 μg/mL、200 μg/mL、400 μg/mL和800 μg/mL时与空白对照相比细胞活力分别达到2.05、1.90、1.90、1.89、1.73和1.42.结果表明,Ac-FBTPs、W-FBTPs及A-FBTPs均能显著性提高巨噬细胞的细胞活力,W-FBTPs和A-FBTPs在浓度为25 μg/mL、50 μg/mL、100 μg/mL和200 μg/mL时与空白对照相比,RAW 264.7细胞活力提升效果显著(P<0.05).由此可知三种FBTPs对促进巨噬细胞RAW 264.7细胞增殖的顺序是Ac-FBTPs 图4 茯茶多糖对RAW 264.7细胞活力的影响(图中不同字母代表显著性差异(P<0.05)) 2.2.2 茯茶多糖对小鼠巨噬细胞RAW264.7细胞吞噬能力的影响 巨噬细胞在体内通过吞噬作用发挥免疫调节功能,巨噬细胞受到免疫调节药物刺激后,其吞噬功能会增强,因此测定巨噬细胞的吞噬功能可以评价药物的免疫活性[24].如图5所示,Ac-FBTPs浓度为200 μg/mL、100 μg/mL、50 μg/mL和25 μg/mL时,巨噬细胞RAW 264.7的细胞吞噬能力相对于空白对照无显著性差异(P>0.05);W-FBTPs在各浓度下均有显著提高细胞吞噬能力(P<0.05),且当浓度为25 μg/mL时,细胞吞噬能力提升0.75倍;A-FBTPs在各浓度下均能够显著性提高细胞吞噬能力(P<0.05),且浓度为50 μg/mL、100 μg/mL和200 μg/mL时,细胞吞噬能力分别提升0.63、0.70和0.78倍.本研究发现A-FBTPs对巨噬细胞吞噬能力的增强效果优于W-FBTPs.由此可知,三种FBTPs对增强巨噬细胞RAW 264.7细胞吞噬能力的顺序是Ac-FBTPs 图5 茯茶多糖对RAW 264.7细胞吞噬能力的影响(图中不同字母代表显著性差异(P<0.05)) 2.2.3 茯茶多糖对小鼠巨噬细胞RAW264.7细胞内酸性磷酸酶活力的影响 酸性磷酸酶是巨噬细胞活化的一种信号酶,由溶酶体产生.巨噬细胞中酸性磷酸酶的活性随着巨噬细胞的激活而增加[28].如图6所示,当Ac-FBTPs浓度为200 μg/mL、100 μg/mL、50 μg/mL和25 μg/mL时,巨噬细胞酸性磷酸酶活力分别增加0.24、0.48、0.37和0.62倍;当W-FBTPs浓度为200 μg/mL、100 μg/mL、50 μg/mL和25 μg/mL时,细胞酸性磷酸酶活力分别增加0.30、0.23、0.49和0.53倍;当A-FBTPs浓度为200 μg/mL、100 μg/mL、50 μg/mL和25 μg/mL时,细胞酸性磷酸酶活力分别增加0.32、0.43、0.40和0.26倍.结果表明,Ac-FBTPs、W-FBTPs和A-FBTPs均能够显著提高巨噬细胞RAW 264.7酸性磷酸酶活力(P<0.05),且与阳性对照LPS提升效果媲美(0.43倍).此外,研究发现Ac-FBTPs、W-FBTPs及A-FBTPs对增加巨噬细胞RAW 264.7酸性磷酸酶活力组间没有显著性差异. 图6 茯茶多糖对RAW 264.7细胞内酸性磷酸酶活力的影响(图中不同字母代表显著性差异(P<0.05)) 2.2.4 茯茶多糖对小鼠巨噬细胞RAW 264.7分泌NO的影响 研究表明NO水平的增加可以诱导巨噬细胞的免疫刺激活性[24].如图7所示,当Ac-FBTPs浓度为200 μg/mL、100 μg/mL、50 μg/mL和25 μg/mL时,NO的分泌量分别是3.00 μmol/L、7.09 μmol/L、5.98 μmol/L和3.83 μmol/L;当W-FBTPs浓度为200 μg/mL、100 μg/mL、50 μg/mL和25 μg/mL时,NO的分泌量分别是8.77 μmol/L、6.35 μmol/L、4.72 μmol/L和5.17 μmol/L;当A-FBTPs浓度为200 μg/mL、100 μg/mL、50 μg/mL和25 μg/mL时,NO的分泌量分别是2.79 μmol/L、1.87 μmol/L、6.52 μmol/L和2.36 μmol/L.其中浓度为100 μg/mL Ac-FBTPs、200 μg/mL和100 μg/mL W-FBTPs及50 μg/mL A-FBTPs对NO的分泌促进效果显著(P<0.05),较空白对照分别提升了147.56%、206.37%和121.91%及127.68%.结果表明三种FBTPs能够有效促进巨噬细胞分泌NO水平. 图7 茯茶多糖对RAW 267.4细胞分泌NO的影响(图中不同字母代表显著性差异(P<0.05)) 研究报道,水提茯茶多糖不能被唾液、模拟胃液和肠液所消化[16],并发现纯化后茯茶多糖组分在细胞水平上具有一定的免疫调节活性[9].本研究发现通过酸提、水提和碱提等不同方法获得的茯茶多糖同样均不被模拟胃液和肠液消化,属于非消化性多糖.通过对三种茯茶多糖在细胞水平上的免疫调节活性研究发现,低浓度的酸提茯茶多糖、水提茯茶多糖和碱提茯茶多糖均能够提升细胞活力,增强巨噬细胞吞噬能力,提高细胞内酸性磷酸酶活力及促进NO的分泌水平,综合分析发现水提茯茶多糖和碱提茯茶多糖拥有更优的免疫调节活性,可能是这二种茯茶多糖具有更高糖醛酸含量的原因[5].大量研究表明,糖醛酸的存在会更有效地提升多糖的生物活性[17,29].据此,后续将进一步研究水提茯茶多糖和碱提茯茶多糖的体外酵解中肠道菌群的组成和代谢,深入解剖茯茶多糖发挥免疫调节活性机制. 本文研究了酸提、水提和碱提等三种提取方法对茯茶多糖在模拟胃液和肠液中消化特性和细胞水平上免疫调节活性的影响.结果表明,酸提茯茶多糖、水提茯茶多糖和碱提茯茶多糖均不能被模拟胃液和肠液所消化,属于非消化性多糖;另外,酸提茯茶多糖、水提茯茶多糖和碱提茯茶多糖在细胞水平上均具有一定的免疫调节活性,主要表现在促进巨噬细胞增殖、增强细胞的吞噬能力、酸性磷酸酶活力以及提高NO分泌的能力,综合分析,水提茯茶多糖和碱提茯茶多糖对巨噬细胞免疫调节活性更优.通过研究不同提取方法对茯茶多糖消化特性和免疫调节活性的影响,为进一步探究茯茶多糖的免疫调节活性提供理论支撑,有助于茯茶资源的深入开发利用.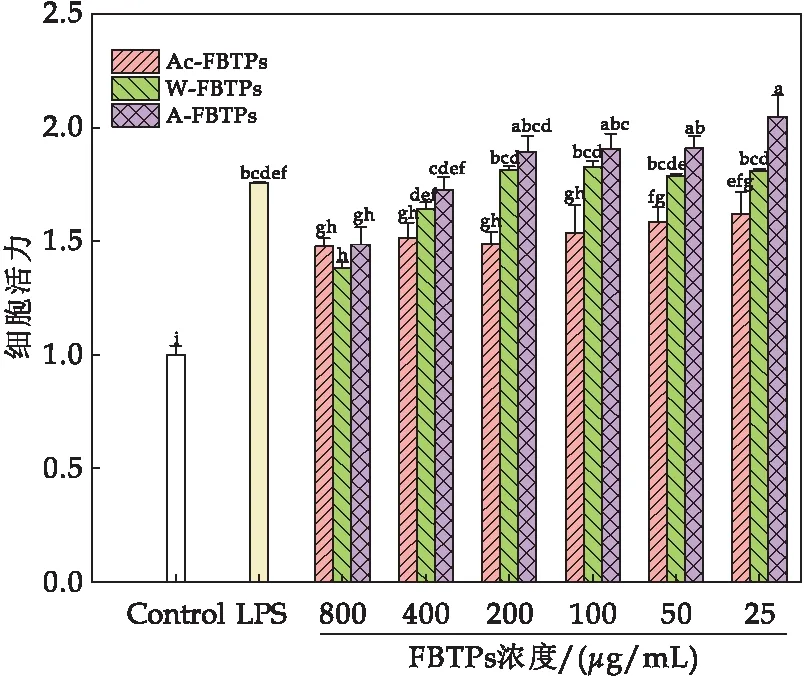
3 结论
——陕西泾阳县茯茶小镇转型观察

