原发性甲状腺样滤泡性肾细胞癌的临床病理特征及影像表现*
刘 峰 李睿弢 田昭俭,* 岳振营 吕海莲 杨新国
1.山东省东营市胜利油田中心医院放射科(山东 东营 257034)
2.山东省东营市胜利油田中心医院病理科(山东 东营 257034)
肾细胞癌(renal cell carcinoma, RCC)约占全部肾恶性肿瘤的85%,病理上,根据已知的基因突变和组织学表现分为透明细胞癌、乳头状细胞癌、嫌色细胞癌、集合管癌和未分类癌等5种亚型。Amin等[1]于2004首次描述具有甲状腺滤泡样结构且TTF-1、TG等甲状腺相关免疫组织化学(免疫组化)标记阴性的RCC,并于2009年[2]命名为肾脏原发性甲状腺样滤泡癌(primary thyroidlike follicular carcinoma of the kidney),另有学者将其称为甲状腺滤泡癌样肾肿瘤(thyroid follicular carcinoma-like tumor of the kidney)[3]和甲状腺滤泡癌样肾细胞癌(thyroid follicular carcinoma-like renal cell carcinoma)[4]。WHO(2016)泌尿系统肿瘤分类将其命名为甲状腺样滤泡性肾细胞癌(thyroid-like follicular renal cell carcinoma,TLFRCC),列为暂定的肾细胞癌亚型[5]。笔者回顾性分析本院经手术病理及免疫组化证实的2例TLFRCC的临床病理和影像表现,旨在提高对本病的认识。
1 资料与方法
1.1 病例资料收集本院2016年4月至2020年12月间经手术病理及免疫组化证实为TLFRCC患者2例,均为女性,年龄分别为66岁和54岁。2例均因查体发现肾占位而就诊,无腰痛、肉眼血尿及膀胱刺激症状。无甲状腺、卵巢肿瘤病史。实验室检查未见异常。
1.2方法
1.2.1 影像检查 2例术前均行CT平扫及三期增强扫描,1例术前行肾血流灌注+肾功能显像,1例术前行MRI扫描。
1.2.2 病理检查 手术切除标本用10%中性福尔马林固定,常规石蜡包埋,4m切片,行HE染色。免疫组织化学检测采用EliVision法(所有一抗和试剂盒均为福州迈新公司生产),所需一抗包括甲酰基辅酶 A 消旋酶(AMACR)、细胞角蛋白7(CK7)、CK18、CKl9、CK20、CK广谱、CK高、分化群10(CDl0)、CD15、CD34、CD56、CD57、CD117、嗜铬素A(CgA)、细胞核增值抗原(Ki-67)、肾细胞癌(RCC)、突触素(Syn)、甲状腺球蛋白(TG)、甲状腺转录因子-1(TTF-1)、波形纤维蛋白(vimentin)、肾母细胞瘤(WT-1)、转录因子 E3( TFE-3)、 酸性钙结合蛋白(S-100)、CEA、Galectin-3、GATA-3、AE1/AE3、E-Cadherin、Leu-7、PAX-8、P53等。
1.2.3 随访 通过电话及患者来院复查随访术后2例患者情况,随访截至2022年3月31日。
1.3 图像分析由放射科1名主任医师、1名副主任医师和1名主治医师分别独立对2 例TLFRCC的CT和MRI图像进行分析,记录异常表现, 意见不同时通过讨论达成一致。
2 结 果
2.1 临床表现
2.1.1 例1 女,66岁,因胆囊结石术前行常规腹部CT平扫发现右肾占位1m于2016年4月12日入院。既往无腰痛、无肉眼血尿及膀胱刺激症状。无甲状腺、卵巢肿瘤病史。
2.1.2 例2 女,54岁,查体发现左肾囊性肿物6年,肿物逐渐增大,于2020年12月23日入院。无腰腹部不适,无肉眼血尿,无腹部包块。
2.2 影像表现
2.2.1 例1 CT平扫显示右肾下极背侧类圆形结节状软组织肿块突出肾脏轮廓,病变大小约为2.2cm×2.0cm,肿块密度略高于肾实质密度,CT值为48HU(图1)。CT增强皮质期肿块呈不均匀明显强化(图2),CT值为108HU,髓质期及排泄期强化均减低,CT值分别为87HU和83HU,三期病灶强化程度均低于肾实质。肾血流灌注+肾功能显像显示双肾血流正常,显影清晰,内部放射性分布均匀,左肾GFR=57.0mL/min,右肾GFR=48.8mL/min,双侧肾图基本正常,a、b、c段未见明确异常。
2.2.2 例2 CT平扫左肾下极见类圆形等密度灶(图3), CT值为42HU,增强扫描皮质期、髓质期及排泄期(图4)病灶均未见明显强化,病灶边界清楚,大小约3.0cm×2.5cm。MRI显示左肾下极见一大小约2.8cm×2.2cm×2.5cm肿块,突出于肾轮廓之外,T2WI呈混杂高信号及颗粒状等低信号,边缘清楚见低信号环(图5),T2WI脂肪抑制序列未见明确脂肪信号(图6);T1WI呈颗粒样等信号及斑点状低信号(图7),反相位未见明确脂肪信号,DWI(b=800)呈等信号,未见明显扩散受限(图8),ADC呈高信号,ADCmean值=2.59×10-3mm2/s(图9)。
2.3 手术及病理
2.3.1 例1 行气管插管全麻腹腔镜下右肾部分切除术,术中见右肾下极背侧类圆形突起肾表面肿物,大小2.6cm×2.0cm×2.0cm,边界清。病理检查,瘤体切面灰褐色及暗红色,质软,局部伴坏死。光镜下肿瘤边界清,见完整、厚薄不均纤维包膜,肿瘤由大小不一的滤泡样结构组成,滤泡混杂分布或聚集成片,滤泡腔内含均质红染胶质样物(图10)。免疫组化:TTF-1(-),TG(-),CK7(+)(图11),CK18(3+),AE1/AE3(3+),E-Cadherin(3+),CD10(局灶弱+),CD34(血管+),Ki-67(+,约3%-4%),AMACR(-),vimentin(-),GATA-3(-),RCC(-),Leu-7(-),CK高(-),CD56(-),CgA(-),Syn(-),WT-1(-), CK19(-),P53(-)。病理诊断:(右肾)TLFRCC。
2.3.2 例2 行气管插管全麻腹腔镜下左肾部分切除术,术中见左肾下极见一囊性肿物,大小约2.5cm×2.5cm。病理检查,左肾部分肾脏及肿物切除标本,大小3.5cm×2.5cm×2.5cm,切面见一囊实性肿物,大小2.5cm×2.0cm×2.0cm,切面囊壁厚0.2cm,切面灰黄色,质韧,肿物凸向肾被膜。光镜下肿瘤边界清楚,瘤细胞中度异型,细胞质丰富、嗜酸性,核染色质均匀分布,部分细胞可见小核仁,核分裂象不易检见,瘤细胞呈滤泡状排列,滤泡腔内含红染胶样物(图12), 周围肾未见异常,各切缘均未见癌。免疫组化:TTF-1 (-),TG(-),PAX-8(+),CD10(+),CK广谱(+),TFE-3(+),Vimentin(+),Galectin-3(细胞质+),Ki-67(+,约5%),AMACR(-),CD117(-),CD15(-),CEA(-), CK7(-),RCC(-),S-100(-)。病理诊断:(左肾)TLFRCC。
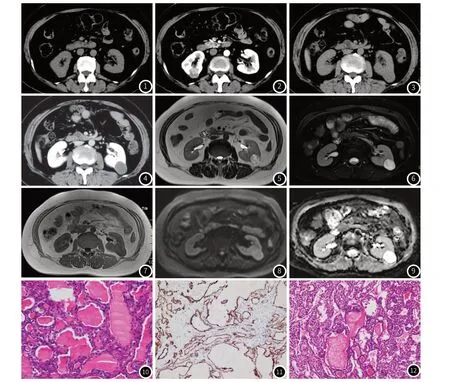
图1 CT平扫横断面示右肾下极背侧类圆形略高密度类圆形肿块突出于肾表面。图2 CT增强扫描皮质期,肿块边界清楚,呈不均匀轻度强化。图3 CT平扫示左肾下极背侧见类圆形突出于肾脏轮廓之外等密度肿块。图4 CT增强扫描排泄期,肿块未见明确强化。图5 横断面T2WI示左肾下极突出于肾脏轮廓之外类圆形混杂信号,见完整等低信号包膜,病灶内见颗粒状及条索状低信号及斑点状高信号。图6 横断面T2WI脂肪抑制序列未见明确脂肪信号。图7 横断面T1WI示肿瘤内见颗粒状等高信号及斑点状低信号。图8 横断面DWI(b=800),呈等信号,未见扩散受限。图9 横断面ADC,呈高信号,ADC mean值=2.59×10-3mm2/s。图10 肿瘤由大小不一的滤泡样结构组成,滤泡腔内含均质红染胶质样物(HE×100)。 图11 肿瘤细胞CK7呈弥漫性阳性表达(EliVision法)。图12 滤泡上皮较丰富,滤泡结构由单层扁平、立方及矮柱胞排列而成(HE×400)。
2.4 随访
2.4.1 例1 手术切除后未予化疗、放疗及靶向治疗。患者分别于2017年4月17日、2017年10月24日、2018年6月26日、2019年10月10日、2020年10月16日、2020年12月13日、2021年10月20日来院复诊行胸腹部及盆腔CT扫描,术后连续随访59个月未见肿瘤复发及转移。
2.4.2 例2 患者于2021年6月3日来院行胸腹部及盆腔CT扫描,术后连续随访15个月未见肿瘤复发及转移,目前仍在密切随访中。
3 讨 论
3.1 临床表现TLFRCC罕见,至今世界范围英文文献报道病例数不超过50例,该病发病年龄范围广,从10岁到83岁,中位年龄38岁,女性多于男性,男:女 =1:1.7[6]。临床大多数患者无明显症状和体征,多于体检时偶然发现,有时出现血尿和腰痛,易与其他类型RCC相混淆[7],本文2例均无临床症状于体检时发现。
3.2 病理特征本病为肾实质内单发结节状实性肿块,大小不一,边界清楚,部分病例有纤维性包膜或假包膜,切面灰黄、灰白色或灰红色,部分病例可有囊变、坏死及出血,个别病例肿瘤可侵犯肾盂或肾周脂肪[8]。镜下肿瘤细胞呈滤泡样排列成大小不一的甲状腺滤泡样结构,滤泡腔内充满嗜酸性甲状腺胶样物,为其特征性病理表现[9],肿瘤细胞呈单层状或立方状,细胞质嗜双色或嗜酸性,胞质空亮,核圆形、卵圆形,异型性不明显,有时可见核沟,核分裂像少见,Fuhrman分级多为2级或3级。免疫表型CK7、PAX-8呈阳性,而TTF-1、TG为阴性,对明确诊断有重要帮助[8,9]。本组2例均为女性,临床均无甲状腺和卵巢肿瘤手术史,肿瘤细胞TTF-1和TG均阴性,可排除甲状腺和卵巢肿瘤肾转移,TLFRCC诊断成立。
3.3 影像表现CT平扫多表现为单侧、孤立突出于肾轮廓之外的囊性或实性肿块,密度均匀或不均匀,少有位于皮髓交界区的报道,有时可伴有坏死或出血,边界清晰。肿瘤高于周边肾组织者称其为异位甲状腺密度[10],与甲状腺滤泡具有摄碘功能有关。CT增强扫描肿瘤不强化或轻微强化,与其他类型RCC的明显强化不同[7],是否与肿瘤含甲状腺滤泡腔的多少、大小及分布有关尚需进一步研究。肿瘤周边可有点状、片状或蛋壳样钙化灶,而其他类型RCC的钙化多位于肿瘤中央[11]。肿瘤较大时可累犯肾实质及肾盂,累及肾被膜与肾周围脂肪[12]。本文例1 CT表现为突出于肾脏轮廓略高密度肿块,皮质期不均匀明显强化,髓质期、排泄期强化程度明显减低,本文例2 CT表现为突出于肾脏轮廓等密度肿块,皮质期、髓质期及排泄期均无强化,与文献基本一致[7]。
本病MRI表现鲜有文献描述[10,11,13],肿瘤T1WI呈等、低信号或混杂信号,伴局限性高信号,T2WI呈低信号或不均匀混杂信号,T2WI脂肪抑制序列未见脂肪信号。本组例2 纤维性包膜完整,T1WI、T2WI呈环形低信号,增强后无明显强化;肿瘤T1WI呈颗粒状等高信号及斑点状低信号,T2WI呈颗粒状及条索状低信号及斑点状高信号,是否与肿瘤内甲状腺滤泡样结构及滤泡内甲状腺胶质样物质有关,尚需进一步研究,T2WI脂肪抑制及反相位未见脂肪信号,与文献一致。
3.4 鉴别诊断(1)甲状腺滤泡癌肾转移[14]:由原发于甲状腺的滤泡癌转移至肾脏,为真性甲状腺起源,而TLFRCC为非甲状腺起源。前者甲状腺有肿瘤原发灶,发生肾脏转移时多已发生肺、骨骼及淋巴结等全身转移,TTF-1、TG为阳性;后者TTF-1和TG均阴性,结合临床、实验室和影像学检查有助于两者鉴别。(2)卵巢甲状腺肿肾转移[15]:卵巢甲状腺肿为一种高度特异性畸胎瘤,是指>50%的卵巢组织被甲状腺组织所替代或甲状腺组织为卵巢肿瘤的主要组织细胞类型,卵巢甲状腺肿恶变可出现肾转移。术前影像学检查可发现卵巢原发肿瘤,其内可见不成熟牙齿、骨骼和软骨成分,免疫组织化学TTF-1、TG阳性,可资鉴别。(3)单纯性肾囊肿:极为常见,CT表现为肾皮质边缘锐利圆形水样低密度灶,常突向肾外,可单发或多发,累及一侧或双侧肾脏,增强检查病变无强化;MRI呈水样信号强度的长T1低信号和长T2高信号,增强检查无强化;易与TLFRCC鉴别。(4)肾细胞癌:肿瘤细胞可因含有细胞内脂质于MRI反相位上呈低信号,病变常见坏死、出血、囊变,CT上呈混杂密度,MRI上呈混杂信号,增强CT扫描皮质期不均匀明显强化,有“速升速降”的特点[16],TLFRCC多无强化或强化不明显,与前者“速升速降”的特点易于鉴别。
3.5 治疗与预后目前TLFRCC治疗以手术切除为主,根据肿瘤TNM分期行部分肾切除或根治性手术。TLFRCC具有相对惰性的生物学行为,术后多数患者预后良好,可长期无瘤生存,偶有转移[11]。本组2例术后分别连续随访59个月和15个月未见肿瘤复发及转移。
综上所述,虽TLFRCC具有特征性的组织形态学和免疫组化表型,但发病率极低,尚缺少大宗病例的文献报道,其临床病理特征、影像学表现及预后等仍需要进一步扩大样本和进行随访,以提高对本病的认识。

