高龄、急性心衰、气道受压狭窄紧急手术围术期管理1 例
谢健铖,吴德华,朱 涛
(上海市松江区中心医院麻醉科,上海 201600)
对胸骨后甲状腺肿伴有气道明显受压的患者的围术期管理具有较大的挑战性[1-3]。对于超过80 岁的高龄患者,术前合并慢性心力衰竭急性发作,并伴有急性心肌损伤、严重低氧、意识消失,经紧急抢救后需要紧急行颈部和胸部甲状腺肿切除术的围术期管理报道极少见。基于此,本文就此类患者1 例的临床资料进行病例报告,具体如下。
1 临床资料
患者,女性,81 岁,体质量60 kg,身高155 cm。因“反复胸闷气促1 个月,加重3 d”入院。既往高血压病史10 余年,最高血压160/100 mmHg(1 mmHg=0.133 kPa),长期口服非洛地平控制血压;慢性心力衰竭史3 年,口服地高辛治疗;甲状腺次全切除手术史30 年,长期口服甲状腺素片替代治疗。主要血液学检查示:血糖14.36 mmol/L;白细胞10.99×109/L;C-反应蛋白16.93 mg/L;hs-肌钙蛋白T、B 型脑钠肽前体和肌酸激酶MB 亚型检测值明显升高,见表1。甲状腺超声显示右叶见多枚低回声区,范围约60×62×32(mm)。胸部CT 显示心脏影增大,主动脉硬化,心包积液,纵隔占位55 mm×54 mm,气管受压左偏,考虑胸骨后甲状腺肿(见图1 和图2)。心电图显示窦性心律,心电轴左偏,ST-T 波改变。心脏彩超显示左心室多节段收缩活动稍减弱,左心室射血分数(LVEF)51%,二尖瓣后叶瓣环、主动脉瓣钙化伴轻微至轻度反流,肺动脉收缩压增高(40 mmHg),轻度三尖瓣反流,左心室舒张功能减退,少量心包积液。经心内科会诊诊断为慢性心力衰竭急性发作,心功能美国纽约心脏病学会(NYHA)分级为Ⅲ级;高血压病2 级(极高危);颈部和胸骨后甲状腺肿。先收入心内科住院控制心力衰竭,给予利尿、非洛地平、比索洛尔、己酮可可碱、奥普力农治疗,择期手术。病情好转后行冠脉造影,检查结果显示右冠近中段60%狭窄,远段斑块形成,前向心肌梗死溶栓治疗(TIMI)血流3 级,余冠脉血流通畅。转入外科拟在全身麻醉下行颈部和胸骨后甲状腺肿瘤切除术。患者在术前准备过程中,突发呼吸困难,血氧饱和度66%,意识不清,行紧急气管插管,经口插入ID 6#气管导管。同时患者血液检查B 型脑钠肽前体和hs-肌钙蛋白T 再次升高,见表1。急诊查双下肢血管彩超显示血流通畅,未见血栓形成。随后紧急送入手术室行颈部和胸骨后甲状腺肿瘤切除术。
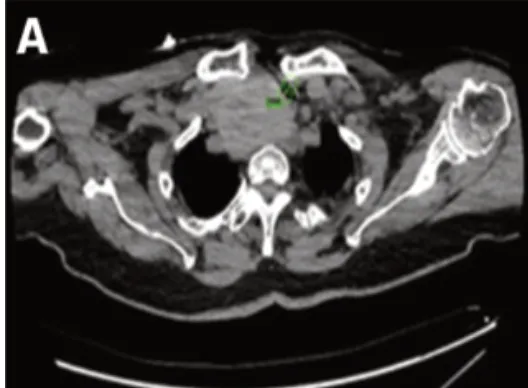
图1 患者术前CT 显示胸骨后甲状腺肿压迫气道
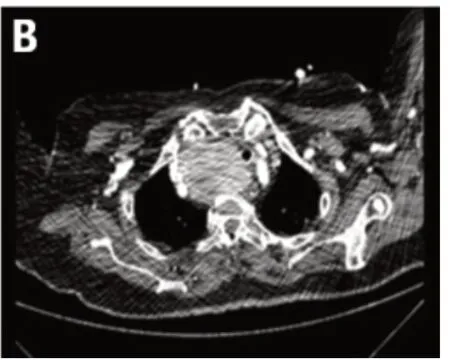
图2 气管插管后气管维持通畅
患者入室时神志已清楚,有自主呼吸,常规监护,连接麻醉机控制通气,吸入七氟烷1.5%。心率90 次/min,血压108/59 mmHg,SpO299%。开放上、下肢外周静脉,静脉注射咪达唑仑1 mg,舒芬太尼15 μg,超声引导下建立有创动脉压监测和右锁骨下静脉穿刺置管。手术开始前纤维支气管镜检查见隆突上2 cm 气管受压狭窄,局部气管支气管黏膜见红肿,充血,毛细血管扩张,将气管导管末端轻柔送过气管受压处。术中追加舒芬太尼10 μg,瑞芬太尼0.1 μg/(kg·min),顺式阿曲库铵7 mg/h 维持麻醉。术中肾上腺素0.01 μg/(kg·min)联合奥普力农0.1~0.3 μg/(kg·min)静脉注射维持心脏功能。视血压情况间断给予去氧肾上腺素20~40 μg维持收缩压在110~140 mmHg的范围,中心静脉压维持在8 cmH2O(1 cmH2O=0.098 kPa)左右,保持生命体征平稳,术中血气分析未见明显异常(见表2)。胰岛素静脉泵注控制血糖。术中液体量800 mL,术中尿量100 mL,术中采用输液加温联合保温毯,维持术中核心体温在36 ℃。手术切除颈部和胸骨后甲状腺肿块约9 cm×8 cm×5 cm。气管第四软骨软化,气管前壁予以悬吊。手术过程顺利。术后病理:甲状腺腺瘤性甲状腺肿。术后50 min 拔除气管导管,拔管后患者呼吸平稳。患者术后肌钙蛋白T、B 型钠尿肽前体和肌酸激酶MB 逐渐回落(见表1),肺部CT显示肺部渗出明显改善(见图3、图4),术后1 周顺利出院。

图3 术前右肺下叶片状渗出

图4 术后右肺下叶渗出明显好转
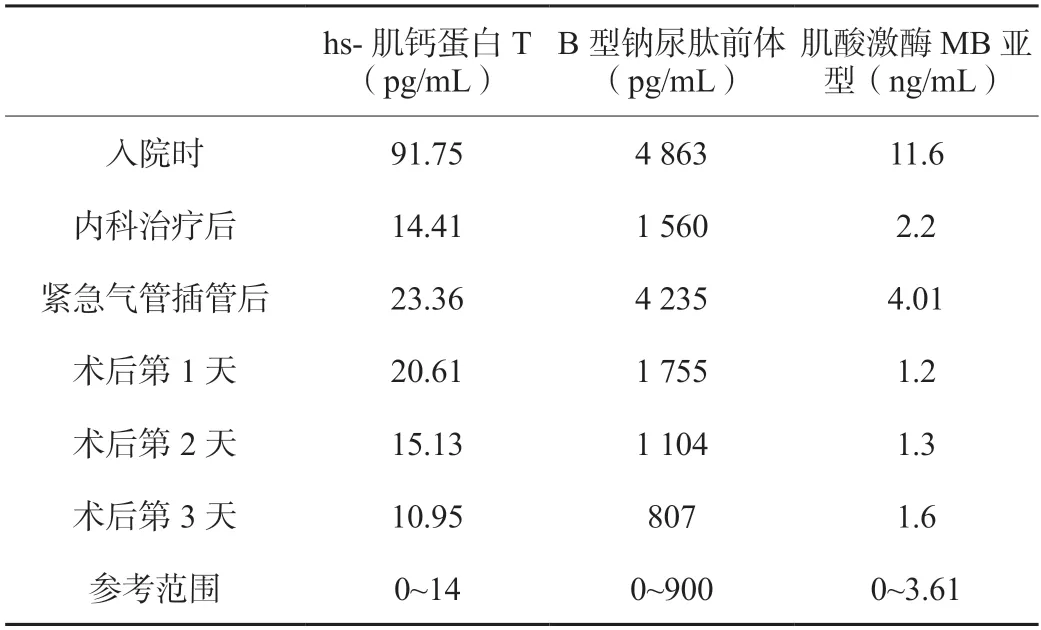
表1 患者围术期hs-肌钙蛋白、B 型钠尿肽前体、肌酸激酶MB 亚型的变化
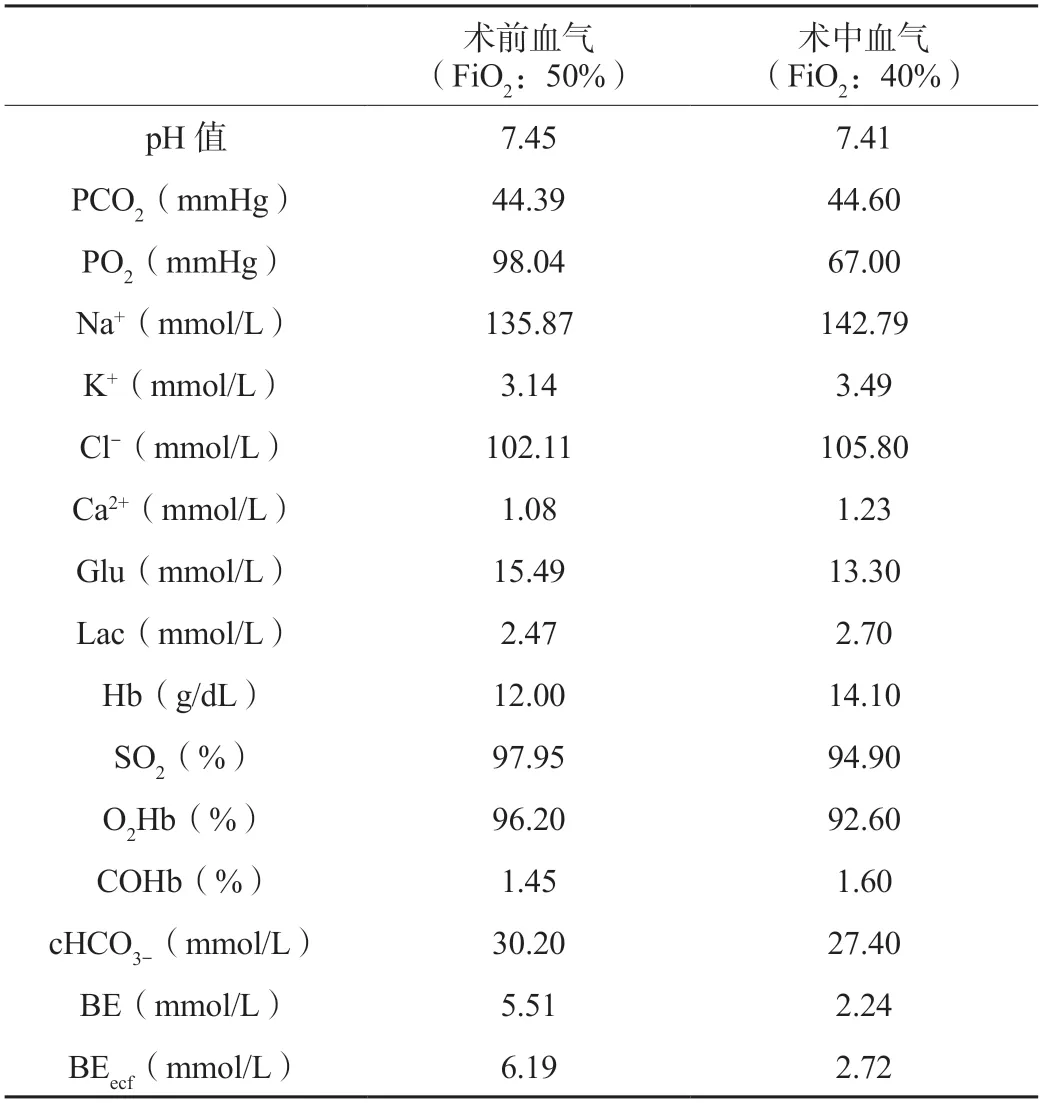
表2 患者术前、术中动脉血气、电解质、血糖、血红蛋白和氧合血红蛋白分析结果
2 讨论
2.1 本例患者的特殊性①本例患者81 岁,长期高血压合并慢性心功能衰竭病史,本次因纵膈肿瘤压迫气道导致明显气管狭窄,纵膈肿瘤紧贴纵膈内大血管,手术有大出血风险。②短时间内出现2 次心功能衰竭急性加重,考虑明显狭窄的气道导致了呼吸困难,呼吸困难又进一步加重
FiO2:吸入氧浓度百分比;pH:酸碱度;PCO2:二氧化碳分压;PO2:氧分压;Na+:钠离子;K+:钾离子;Cl-:氯离子;Ca2+:钙离子;Glu:血糖;Lac:血乳酸;Hb:血红蛋白;SO2:血氧饱和度;O2Hb:氧合血红蛋白;COHb:碳氧血红蛋白;cHCO3-:实际碳酸氢根;BE:碱剩余;BEecf:细胞外碱剩余。本已衰弱的心功能,两者相互作用,最后导致严重低氧,意识消失,需要紧急插管抢救。③患者出现2 次急性心功能衰竭时均伴有明显的心肌损伤,表现在肌钙蛋白和肌酸激酶MB 明显升高。
2.2 手术时机选择本例患者在短时间内2 次心衰急性加重考虑与本身脆弱的心功能和明显气道狭窄及二者的相互作用和促进有关,同时伴随B 型脑钠肽前体、心肌钙蛋白T 和肌酸激酶MB 亚型的再次升高,显示心衰急性发作时伴有心肌损伤。如不及时手术解除胸骨后肿瘤对气道的压迫,可能无法让患者的心脏功能得到根本好转。患者在抢救过程中已经气管插管,不存在麻醉诱导插管的风险。另外,患者入院以来已长时间卧床没有下地活动,延期手术还有可能增加静脉血栓风险[4]。因此,本例高龄患者在抢救后应及时手术解除气道压迫。
2.3 术中管理由于患者已有气管插管机械通气,气道管理难度明显降低。采用小剂量咪达唑仑、舒芬太尼联合吸入七氟烷麻醉,相对温和,对血流动力学影响小。瑞米芬太尼和顺式阿曲库铵主要代谢场所在血浆,对高龄心功能不全患者有利。麻醉后及时采用纤维支气管镜观察气管支气管情况,同时确保气管导管通过狭窄部位,以保障手术过程中的气道安全。对该患者应尽量避免采用高浓度氧,防治高浓度氧导致的肺损伤。在维持术中SpO295%以上的情况下,尽可能降低吸入氧浓度——该患者术中吸入氧浓度控制在40%左右。血流动力学的管理是另一个重要的术中管理目标。高龄患者围术期低血压可能增加患者术后并发症发生率和死亡率,有研究表明术中低血压时间累计超过10 min,就可增加术后并发症发生率[5]。对于术前有高血压的高龄患者而言,围术期低血压可带来更差的预后,全因死亡风险明显增加[6]。对本例患者及时建立了有创动脉压监测和锁骨下静脉通路。由于患者胸骨后肿瘤生长在升主动脉发出的三根分支(右无名动脉、左颈总动脉和左锁骨下动脉)之间,同时紧贴上腔静脉,外科分离肿瘤过程中有撕裂前上纵隔大血管的风险。除了建立通畅的上肢静脉和锁骨下静脉通路之外,还应该建立通畅的高流量下肢静脉通路备用,以预防上腔静脉因手术需要被阻断后,无输液通路可用。另外,患者术前已有慢性心衰急性发作,围术期各种应激因素有诱发急性心衰进一步加重的可能。本例患者除了存在急性心衰外,还存在肺动脉高压,因此术中采用小剂量肾上腺素联合奥普力农支持心功能,维持收缩压在100~140 mmHg 范围。有创动脉压监测持续到术后稳定期,同时方便行血气监测。液体管理是本例患者第3 个重要管理目标。本例高龄患者术前短时间内出现2 次慢性心衰急性发作,2 次B 型脑钠肽前体检测均大于4 000 pg/mL,因此在保证正常微循环灌注的基础上要防止液体负荷过重,防止诱发急性心衰加重。高龄患者容易出现术中体温的丢失,术中低体温可导致术后心肌损伤,维持体温正常对提升患者的舒适度、减少围术期并发症也具有重要作用[7]。
2.4 术后管理该患者术后阶段的管理同样重要。患者术前存在慢性心功能不全急性发作,术后保留气管导管呼吸机支持可能对患者的心功能恢复有利。同时,该患者纵膈肿瘤压迫气管环,术后拔管有气管塌陷的风险。因此,该患者是否尽早拔管,还是以呼吸机支持等待心功能恢复再拔管的选择,均应谨慎评估后再决定。由于外科医生术中对本例患者采用了预防性气管前壁悬吊方式,可防止术后气管塌陷。同时术中纤维支气管镜检查发现气管支气管黏膜见红肿,充血,毛细血管扩张,存在下呼吸道感染的风险。术后尽早拔出气管导管,可防止长时间保留气管导管导致肺部炎症或相关性肺部感染。高龄患者长时间气管机械通气可导致肺部并发症发生率甚至死亡率增加[8-9]。因此,经过谨慎评估后,决定尽早拔除气管导管。该患者术后50 min 完全清醒后拔管,拔管后未出现呼吸困难,术后继续心功能支持至术后第3 天,术后指导呼吸功能锻炼,逐渐过渡到下地行走,最后痊愈出院。
2.5 经验总结本例高龄患者同时存在心功能不全和胸骨后甲状腺肿压迫气道,两者相互影响诱发心衰急性发作,应及时手术解除气道压迫症状,阻断恶性循环。同时,患者处于急性心衰发作期,围术期管理具有较高的挑战性,围术期根据手术的特殊性和患者的病情特殊性给予针对性处理,包括上下肢静脉的建立、采用对血流动力学影响小的麻醉药物、术中和术后持续心功能的支持、术中血流动力学管理、液体管理和体温的管理、术后尽可能早期拔管和指导患者术后快速康复等措施,帮助患者安全度过围术期。

