双重血浆置换治疗急性期自身免疫性疾病伴肾损伤的效果分析
管 玺,刘同强,郭山脉★
(江苏省常州市第二人民医院 1. 医保办公室 2. 肾内科,江苏 常州 213004)
自身免疫性疾病(autoimmune disease,AID)是一种人体自身免疫介导的由遗传易感性与环境因素共同引发的慢性疾病。常见的AID 有系统性红斑狼疮、视神经脊髓炎谱系病、抗肾小球基底膜病等。AID 患者机体由于正常保护性应答反应丧失了识别自身抗原与外源性抗原的能力,进而导致自身的免疫系统攻击机体的正常细胞组织,使一个或多个器官组织受损[1],其中以肾损伤最为常见。急性期AID 伴肾损伤进展迅速,若不及时、有效地干预,可进展为终末期肾脏疾病,导致患者的死亡风险增加、生存质量下降[2]。近年来,双重血浆置换(double filtration plasma pheresis,DFPP)技术不断发展成熟。该技术是通过一级滤器、二级滤器对血浆进行滤过来清除体内致病性抗体的一种血液净化技术,能够依据患者体内致病抗体的分子量大小而选取合适的成分分离器孔径,从而滤过血浆中分子量相对较大的致病物质,同时保留血浆中分子量相对较小的组分,因此该血液净化技术无需依赖较多的血制品就可提高体内致病物质的清除率。既往的研究显示,DFPP 能迅速缓解危重症患者的病情[3-4],降低临床死亡率[5-6]。但目前关于DFPP 对急性期AID 伴肾损伤患者治疗效果的研究不多。本研究以25例急性期AID 伴肾损伤患者为观察对象,探讨了对此类患者进行DFPP 治疗的效果,以期为临床决策提供参考,现报道如下。
1 资料与方法
1.1 一般资料
回顾性分析我院2021 年1 月至2022 年4 月期间收治的25 例急性期AID 伴肾损伤患者的临床资料。病例纳入标准:1)病情符合AID 的诊断标准,且处于急性期;2)出现肾损伤;3)有DFPP 治疗指征,且行DFPP 治疗≥1 次;4)对研究知情,并签署入组协议。病例排除标准:1)临床资料不完整;2)中途退出本研究。入组的25 例患者中,男16 例,女9例;年龄29 ~80 岁,平均(55.50±10.63)岁;其中,系统性红斑狼疮患者11 例、抗中性粒细胞胞质抗体(ANCA)相关性血管炎患者11 例、视神经脊髓炎谱系病患者2 例、抗肾小球基底膜病患者1 例;DFPP治疗次数为1 ~5 次,治疗次数≥3 次的患者有10 例,治疗次数<3 次的患者有15 例。
1.2 方法
所有患者入院后均给予规范化的药物治疗,在此基础上均进行DFPP 治疗。血液净化装置型号为Plasauto ∑(株式会社美迪克)。血管通路选择中心静脉留置双腔导管,或直接行股静脉穿刺置管。体外循环采用枸橼酸钠抗凝,一级滤器以每分钟130 ~150mL 的血流量滤过,二级滤器以每分钟30 ~40mL 的血流量滤过,滤过血浆重新回输到患者体内。血流速度为130 ~150 mL/min。单次DFPP 治疗时间为2.5 ~3h,处理血浆量是血浆容量的1.5 ~2倍,治疗后补充10 ~30g 的白蛋白。治疗期间密切观察滤器工作、血浆颜色等情况,同时严密监测患者的生命体征及有无不良反应发生。
1.3 观察指标
所有患者均于治疗前后检测并比较以下实验室指标:1)血清免疫球蛋白A(IgA)、免疫球蛋白G(IgG)、免疫球蛋白M(IgM)和补体C3;2)血清肌酐(serum creatinine,Scr)、血 尿 素 氮(blood urea nitrogen,BUN)和尿酸(uric acid,UA);3)纤维蛋白原(fibrinogen,FIB)、血红蛋白(hemoglobin,Hb)、血小板计数、血钾和血钠。
1.4 统计学方法
采用SPSS 20.0 统计学软件分析数据,呈正态分布或近似正态分布的计量资料以均数± 标准差(±s)表示,治疗前后比较采用配对样本t检验。以P<0.05 为差异有统计学意义。
2 结果
2.1 治疗前后患者免疫球蛋白及补体C3 水平的对比
与治疗前比较,治疗后25 例患者血清IgA、IgG、IgM 和补体C3的水平均显著降低,差异有统计学意义(P<0.05)。详见表1。
表1 治疗前后患者免疫球蛋白及补体C3 水平的对比(g/L,±s)
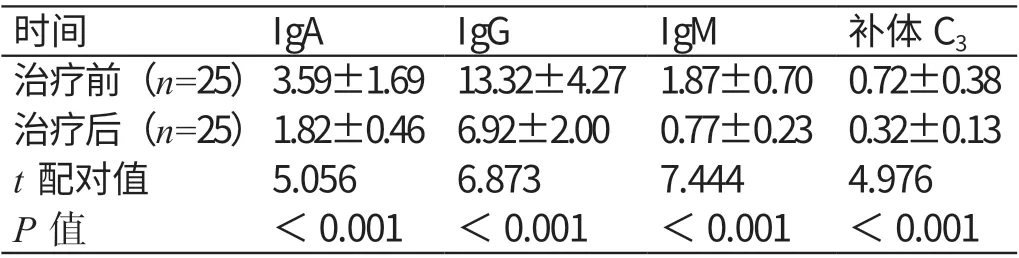
表1 治疗前后患者免疫球蛋白及补体C3 水平的对比(g/L,±s)
时间 IgA IgG IgM 补体C3治疗前(n=25)3.59±1.69 13.32±4.27 1.87±0.70 0.72±0.38治疗后(n=25)1.82±0.46 6.92±2.00 0.77±0.23 0.32±0.13 t 配对值 5.056 6.873 7.444 4.976 P 值 <0.001 <0.001 <0.001 <0.001
2.2 治疗前后患者肾功能指标的对比
与治疗前比较,治疗后25 例患者Scr、BUN、UA 的水平均显著降低,差异有统计学意义(P<0.05)。详见表2。
表2 治疗前后患者肾功能指标的对比(±s)
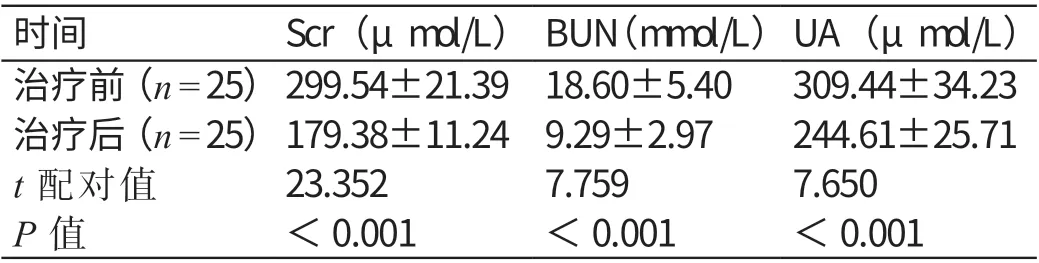
表2 治疗前后患者肾功能指标的对比(±s)
时间 Scr(μmol/L) BUN(mmol/L)UA(μmol/L)治疗前(n=25)299.54±21.39 18.60±5.40 309.44±34.23治疗后(n=25)179.38±11.24 9.29±2.97 244.61±25.71 t 配对值 23.352 7.759 7.650 P 值 <0.001 <0.001 <0.001
2.3 治疗前后患者其他血生化指标的对比
与治疗前比较,治疗后25 例患者FIB 的水平明显降低,差异有统计学意义(P<0.05)。治疗前后,25 例患者血小板计数、Hb、血钾、血钠的水平变化不明显,差异无统计学意义(P>0.05)。详见表3。
表3 治疗前后患者其他血生化指标的对比(±s)

表3 治疗前后患者其他血生化指标的对比(±s)
时间 FIB(g/L) Hb(g/L) 血小板计数(×109/L)血钾(mmol/L) 血钠(mmol/L)治疗前(n=25) 3.62±0.49 66.93±8.30 107.87±44.47 3.72±0.26 145.90±41.50治疗后(n=25) 1.88±0.64 62.44±7.36 118.53±60.85 3.68±0.25 147.31±47.92 t 配对值 5.692 1.858 0.768 1.714 0.100 P 值 <0.001 0.076 0.450 0.102 0.921
3 讨论
目前,AID 以激素和(或)免疫抑制治疗为主。AID 若治疗效果不佳,患者病情就会迅速进展,出现小血管硬化及炎性反应,损害肾滤过功能,可引起肾功能不全、肾功能衰竭甚至终末期肾病[7-9]。快速有效地清除AID 患者体内的致病性抗体,是阻止其肾功能损害的关键。DFPP 是在传统血浆分离技术的基础上发展而来的一种新的血液净化技术,其增加了一个额外的二级滤器,能选择性清除血浆中的高分子量组分(如免疫复合物、致病抗体等),同时又可使白蛋白等低分子量组分重新回输到患者体内,减少丢失。既往的研究显示,相较于传统的血浆转换技术,DFPP 技术对致病抗体的清除效率更高[10-12],能及时有效地阻断急性期AID 患者体内的“免疫风暴”,为激素和(或)免疫抑制剂起效赢得宝贵时间。本研究结果显示,与治疗前比较,治疗后25 例患者血清IgA、IgG、IgM 和补体C3的水平均显著降低,差异有统计学意义(P<0.05)。这与刘新宇等[13]、秦慧兵等[14]的研究结果相近。提示DFPP 治疗能有效清除急性期AID 患者血浆中的自身抗体及补体,调节机体的免疫状态,从而使患者的病情得到迅速缓解。本研究结果显示,与治疗前比较,治疗后25 例患者Scr、BUN、UA 的水平均显著降低,差异有统计学意义(P<0.05)。这与史应龙等[10]、陈慧娟等[15]的研究结果相仿。提示急性期AID 伴肾损伤患者行DFPP 治疗后,有助于改善肾功能,减轻肾损害。此外,本研究结果还显示,治疗前后25 例患者的Hb、血小板计数、血钾、血钠水平无明显变化,但治疗后的FIB 水平明显降低。说明对患者进行DFPP 治疗期间需密切监测其凝血功能[16-17]。
综上所述,对急性期AID 伴肾损伤患者进行DFPP 治疗可迅速清除体内的致病性抗体,从而有效缓解肾脏损伤,治疗相对安全可靠,但治疗期间需注意监测患者的凝血功能。

