墨西哥落羽杉扦插繁殖与生根机制研究
吴利雪 常丽娜 冯 缘 郭金庆 孙 明
(北京林业大学园林学院/花卉种质创新与分子育种北京市重点试验室/国家花卉工程技术研究中心 北京 100083)
墨西哥落羽杉(Taxodium mucronatum)为杉科落羽杉属树种,主要分布于我国长江以南各省份。近年来人们对于滨水绿化树种越来越重视,墨西哥落羽杉作为南方典型的彩叶滨水树种,在园林景观中具有广泛的生态价值和应用前景。而且因其生长速度快、观赏价值高、耐低温、耐水湿、耐盐碱及抗病虫害等优点,兼具生态价值和工业利用价值[1]。因此,推广并规模化繁殖墨西哥落羽杉,不仅可以满足建设低碳园林的要求,而且可以弥补北方地区滨水景观色彩单一的不足,应用前景十分广泛。
目前墨西哥落羽杉的繁殖主要利用传统的播种繁殖和嫁接育苗等繁殖方法,但这2种繁殖方法存在效率低,且因难以保持亲本优良性状等问题,严重影响了落羽杉的工厂化繁殖。扦插繁殖技术繁殖效率高,扦插材料充足,能够满足大批量的生产。相关学者对墨西哥落羽杉扦插繁殖技术进行了试验研究,但是对其生根机制的研究较少[2-3]。因此立足于生产实际的需要,本研究深入探讨植物生长调节剂等因素对墨西哥落羽杉扦插生根的影响,并对扦插过程中墨西哥落羽杉内源激素及氧化酶活性的变化进行观察与检测,明确其与愈伤组织诱导、不定根形成之间的响应机制及相关性,进一步筛选出能够促进墨西哥落羽杉插穗生根的激素处理组合,为其高效率繁殖的关键技术提供理论依据,也为北方地区墨西哥落羽杉规模化生产提供技术支撑。
1 材料与方法
1.1 试验地概况
试验地位于济南市长清区农业园基地的温室(36°38′12″N,116°46′50″E),气候类型为温带季风气候。试验于基地温室内搭建的小拱棚内进行,棚内扦插池为长方形,插床长约8 m、宽约2.5 m、高0.5 m。棚膜上方架设遮光率为80%的遮阳网,铺设地热线并设置自动喷雾设备,给排水正常。空气湿度控制在90%~95%,气温控制在30~35°C。
1.2 试验设计
在2020年6月中旬采集当年生枝条为插穗,长度8~12 cm。将制作好的插穗扦插在草炭∶珍珠岩为3∶7的基质中[2]。本试验采用3因素3水平L9(34)进行正交试验设计,共设置9个处理组和1个清水对照,每个处理重复3次,每个重复处理120根插穗(表1)。本试验用清水作为对照。扦插后每隔5 d随机拔出5根试验苗,拍照观察愈伤组织生长及生根情况,取有代表性的切片在显微镜下观察、拍照并记录,并测量与比较各处理中插穗内源激素与酶活性的变化。
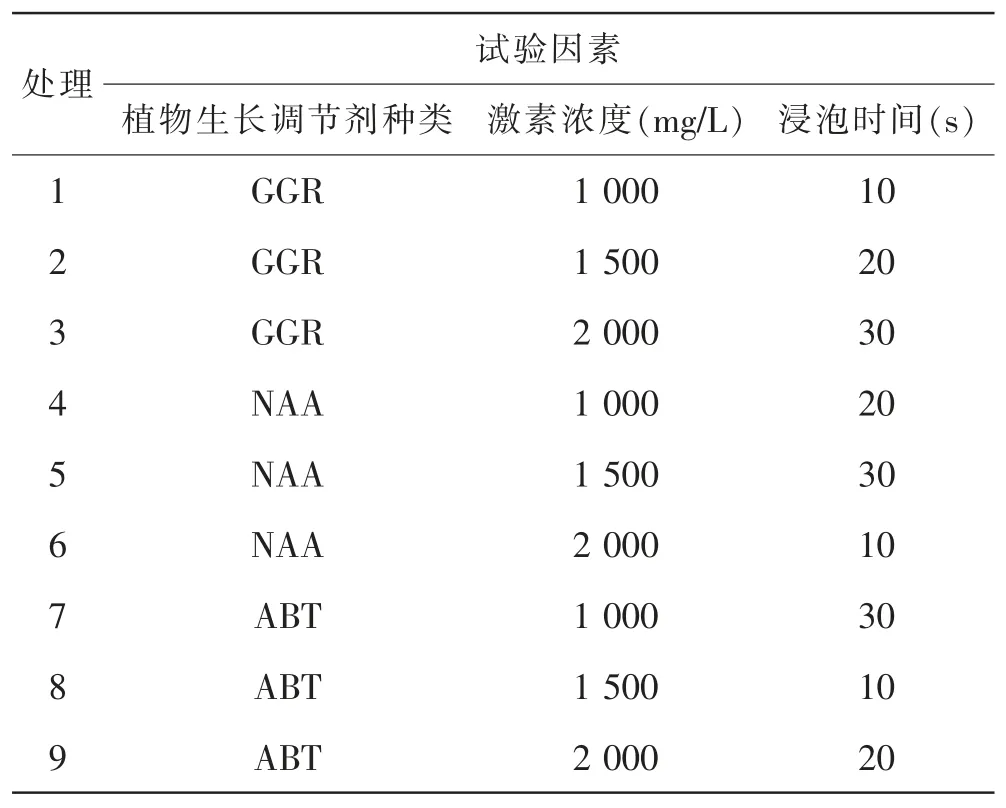
表1 植物生长调节剂处理正交试验设计
1.3 插后管理
扦插当天充分浇灌插床,为减少水分散失,前期密闭棚膜保湿。之后每周喷施1次50%多菌灵可湿性粉剂800倍液对插床及插穗杀菌消毒,及时清理腐烂、死亡的插穗。安装温湿度计,实时监测棚内温湿度。
1.4 测定方法
1.4.1 形态观察扦插后每隔5 d将破坏性试验苗随机拔出5根,观察愈伤组织生长及生根情况。
1.4.2 生根指标测定在各扦插试验后每周观察记录生根进程,并在扦插60 d后统计以下生根指标[4]。
1.4.3 生理指标测定以正交试验筛选出的最优组合作为试验组,设立清水对照,采用完全随机区组试验,各处理均保持在条件相对一致的环境中。自扦插日起60 d内每隔10 d进行取样,每次取样5根,取样时间为上午8:00-9:30。每次取样后立即清洗插穗,截取基部2 cm处的韧皮部,用液氮速冻后于超低温冰箱(-80℃)中保存备用。
对保留的整株样本采用酶联免疫法(ELISA)测定内源激素IAA、ABA和ZR的含量,分别采用愈创木酚法和氮蓝四唑光还原法来测定过氧化物酶(POD)和超氧化物歧化酶(SOD)的活性[5-6]。
1.5 数据处理
采用Microsoft Excel 2016进行数据统计与表格制作,使用SPSS21.0软件进行方差分析和多重比较。
2 结果与分析
2.1 墨西哥落羽杉插穗生根形态学观察
2.1.1 插穗生根类型分析由图1可知,墨西哥落羽杉插穗有2种生根类型,即愈伤组织生根型和皮部生根型。不同处理对生根类型的影响差异显著,经GGR处理的插穗,生根情况明显优于对照组处理,并且这些生根插穗中,愈伤组织生根型占74.13%,皮部生根型仅占12.35%。由此可知,墨西哥落羽杉以愈伤组织生根型为主,生根难度较大,这与同属树种中山杉的研究结果一致[7]。
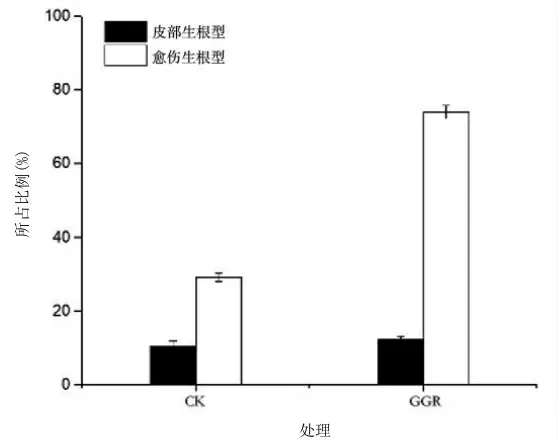
图1 墨西哥落羽杉扦插生根类型
2.1.2 扦插生根过程分析通过跟踪观察墨西哥落羽杉插穗扦插过程中的形态变化,将扦插生根过程分为4个阶段:①愈伤组织形成期。在扦插后10~20 d插穗基部的切口处开始膨大,皮部出现白色半透明状的膨大部分;扦插后20~30 d,在基部5 mm的范围内出现了白色点状凸起。②根原基诱导期。扦插后30~40 d愈伤组织的数量继续增加,连接成环,并有部分插穗的愈伤组织开始形成不定根。③不定根形成期。扦插后40~50 d,大部分插穗开始形成不定根。④不定根伸长期。扦插后50~60 d,不定根的根系增长增粗,并且有一部分插穗生成侧根。
2.2 不同处理下墨西哥落羽杉扦插生根的情况
由表2可知,不同处理对插穗的各项生根指标均达到极显著水平(P<0.01)。进一步对不同处理间生长性状进行比较,结果表明,处理后的插穗全部生根,其中处理3的生根率最高,达92.80%,产生的不定根数最多,为6.33条/株,根系效果指数最大,为0.87。处理5的插穗生根效果最差,生根率仅为42.38%。同时,生长调节剂也影响根的长度,以处理8的平均根长最长,为4.17 cm(表3)。
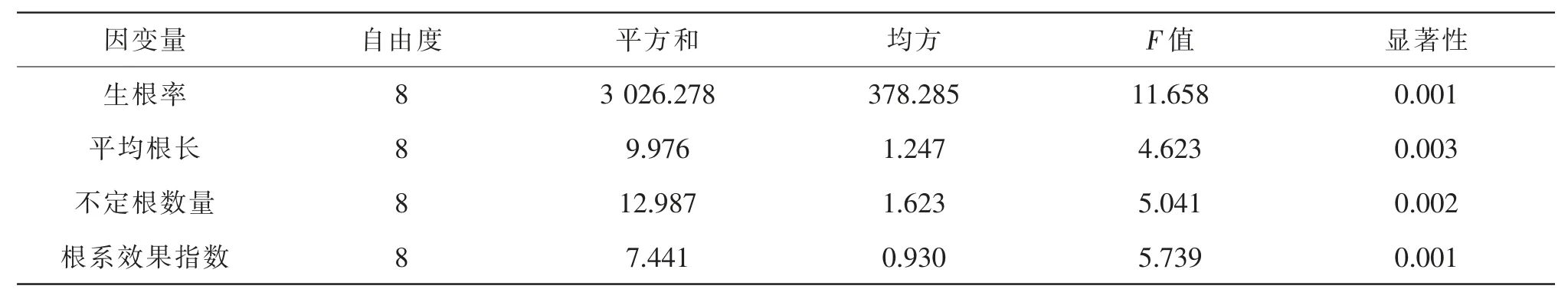
表2 不同处理组合对墨西哥落羽杉插穗生根影响的方差分析
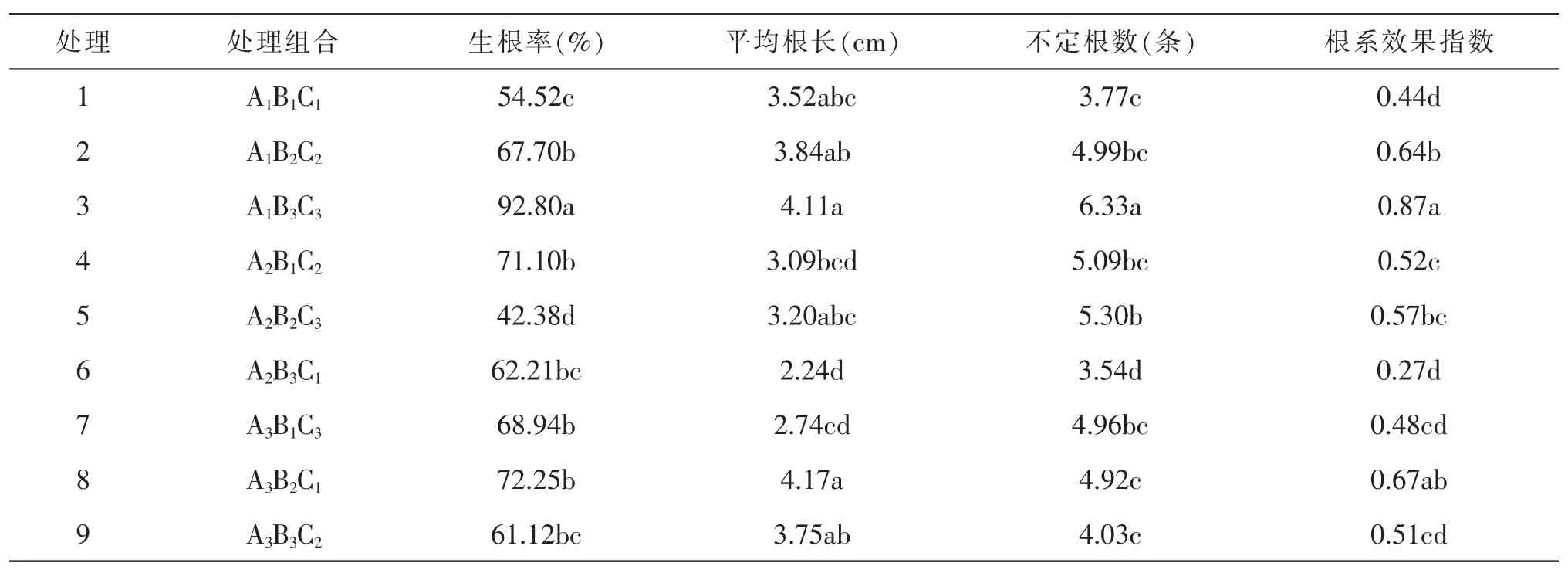
表3 不同处理组合对墨西哥落羽杉插穗生根的影响
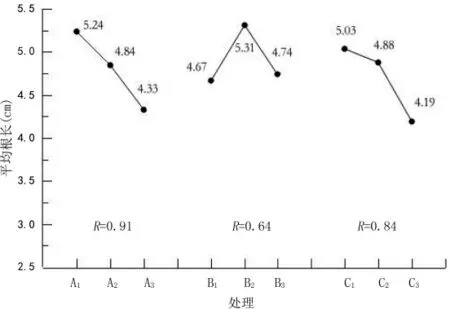
图3 各因素对墨西哥落羽杉扦插平均根长的极差分析
比较3个因素对各项生根指标的极差可知(图2~图5),3个因素的主次关系为激素种类(A)>激素浓度(B)>浸泡时间(C)。从各因素水平对生根率的影响方面分析,扦插处理最优组合为A1B3C3;从对平均根长的影响方面分析,扦插处理最优组合为A1B2C1;从对平均根数的影响方面分析,扦插处理最优组合为A3B3C3;从对根系效果的影响方面分析,扦插处理最优组合为A1B3C3。综合比较,可以确定墨西哥落羽杉嫩枝扦插优化体系为A1B3C3,即取半木质化插穗为试验材料,用2 000 mg/L的GGR处理插穗30 s为最优生根组合。

图2 各因素对墨西哥落羽杉扦插生根率的极差分析
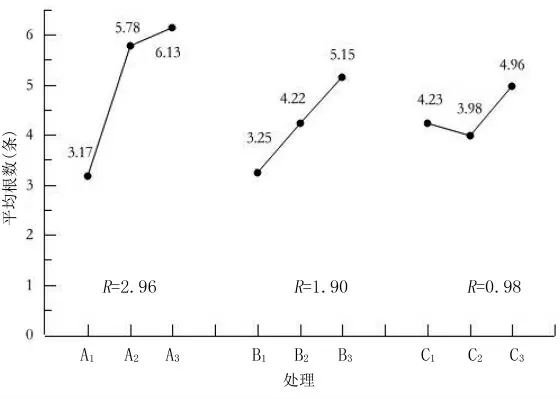
图4 各因素对墨西哥落羽杉扦插平均根数的极差分析

图5 各因素对墨西哥落羽杉扦插根系效果的极差分析
2.3 生根过程中内源激素含量变化
在生根过程中,内源激素的变化趋势与不定根的诱导和形成等关键时期有着同频共振的关系。因此,将上述试验所得到最优的植物生长激素处理组合(GGR)和对照(CK)处理下的插穗在不同时期植物的内源激素的差异以及变化规律进行了比较。由图6可知,处理组和对照组插穗IAA的含量都是先升高后下降。其中处理组和对照组在愈伤组织形成阶段(扦插后30 d)和根原基诱导阶段(扦插后40 d)一直处于上升状态,且处理组在根原基诱导阶段(扦插后40 d)结束时含量最高,随后IAA含量明显下降。而对照组变化则相对滞后,在不定根形成期(扦插后50 d)才达到最大值,于不定根伸长阶段(扦插后60 d)不断下降。而且在不同时期,处理组IAA含量均明显高于对照组的含量。不同处理下ABA含量呈现先下降再升高最后下降的趋势,而且不同时期对照组插穗ABA含量均大于处理组,在愈伤组织形成阶段两者差异达到最大(图7)。在根原基形成及不定根形成阶段,ABA含量不断下降。与前2种激素变化趋势不同的是,处理组和对照组中的ZR含量为先下降后上升的趋势(图8)。处理组在愈伤组织形成时期(扦插后30 d)含量达到最低,之后ZR含量开始回升。在不定根形成及伸长阶段,处理组中ZR的含量明显低于对照组,在不定根形成阶段差异最为显著。
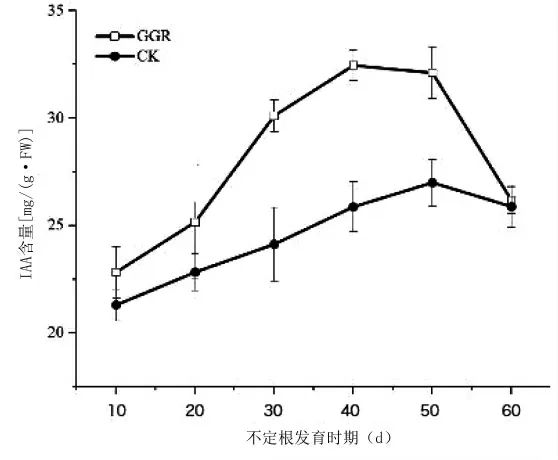
图6 GGR对墨西哥落羽杉扦插生根过程内源激素IAA的影响

图7 GGR对墨西哥落羽杉扦插生根过程内源激素ABA的影响
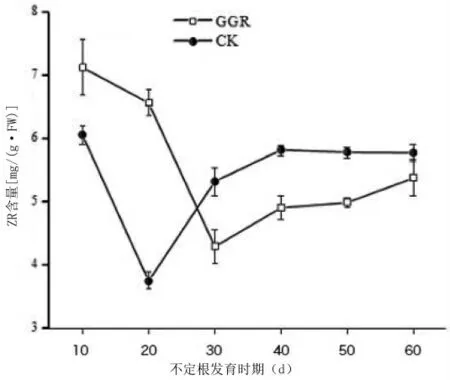
图8 GGR对墨西哥落羽杉扦插生根过程内源激素ZR的影响
2.4 生根过程中氧化酶含量变化
2.4.1 SOD活性的变化由图9可知,对照组与处理组插穗内SOD的活性变化曲线大致相同,均是先上升后下降。在愈伤组织形成期(扦插后30 d)和根原基诱导期(扦插后40 d),SOD活性逐渐上升,并在不定根形成期(扦插后50 d)达到最高水平。待不定根形成后,SOD活性有所下降。总的来看,处理组插穗SOD活性均明显高于对照组。

图9 GGR对墨西哥落羽杉扦插生根过程中SOD活性的影响
2.4.2 POD活性的变化不同处理下插穗生根过程中的POD活性整体呈先升高后降低的变化趋势(图10)。在愈伤组织形成阶段(扦插后30 d),经过GGR处理的插穗的POD活性虽然处于下降趋势,但是含量明显高于CK处理。随后在根原基形成期(扦插后40 d)活性不断上升并达到峰值,但在不定根形成及伸长阶段开始下降。而处理组的插穗,POD活性在不定根形成前不断上升,在不定根形成期达到最高水平,之后逐渐降低。整体来看,在根原基形成前处理组插穗POD的活性要明显优于对照组。但在不定根形成期,POD活性下降的速度较对照组插穗更快。
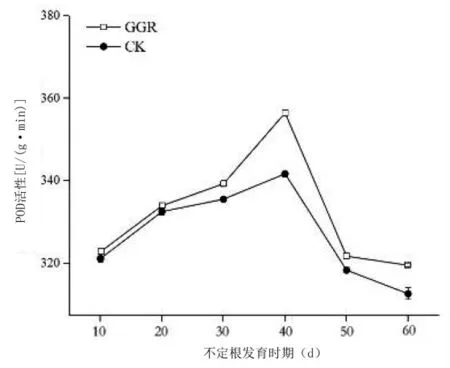
图10 GGR对墨西哥落羽杉扦插生根过程中POD活性的影响
3 讨论与结论
3.1 植物生长调节剂对墨西哥落羽杉扦插生根的影响
不定根的形成是植物营养繁殖的重要步骤。这是一个复杂的过程,受多种内源性如生长调节剂的内稳态、酚类化合物的水平、酶活性及外源性因素的影响,包括营养状况、相关应激反应、生物相互作用和遗传特征等[8]。植物生长调节剂在促进植物插穗生根方面有着重要作用,不仅可以调动内源激素的变化,还可加快植物营养物质代谢的速度并加大其强度,从而能够促进插穗不定根的分化与形成[9-11]。多项研究表明[13-15],相比于NAA、IAA等单一植物激素,ABT作为一种混合的植物生长调节剂能够多样地补充植物生根过程中所需要的激素,这与本试验研究结果相似。与ABT生根粉不同的是,GGR属于非激素型的生理活性物质,植物经GGR处理后更易生根,生根生长进程更快[16]。这可能是因为GGR中的NAA和IAA的含量比例调配更加有利于植株的生长发育[17-18]。除植物生长调节剂种类外,其浓度和浸泡的时间都会对植物扦插生根产生极大的影响。陈寒蕾等的研究发现,不同浓度生长素均可促进菜桑和果桑的生长;郭其强等的研究发现,2种西藏柏树插穗的生根对不同浓度的生长素和浸泡时间的影响明显,这与本试验研究结果相同。
3.2 植物内源激素变化对墨西哥落羽杉扦插生根的影响
植物内源激素调控着植物的发育过程,影响着植物的生长变化。茎生根受内源激素代谢的密切调节,其中内源激素包括IAA、ZR和ABA。IAA和ZR促进根形成,而ABA抑制根形成[9-10]。在本研究中,处理组的IAA含量在整个过程中都高于对照组,证实了外源激素具有增加内源性激素调节能力的作用。GGR处理后的插穗在不定根形成与伸长阶段ZR的含量都明显低于对照组,这与ZR促进根的形成相矛盾。这可能是因为墨西哥落羽杉对GGR比较敏感,对GGR表现为高抑低促的现象[19]。此外Kuroha等也有类似的发现,ZR对黄瓜(Cucumis sativus)下胚轴的不定根的形成具有负调节作用。当黄瓜的根被切断时,ZR水平会迅速下降,同时生长素积累会发生在被切断的下胚轴或茎的基部,导致ARS的形成[20]。此研究结果可以解释本研究中不同生长阶段ZR含量的变化趋势。GGR处理后的插穗在整个生根过程中,处理组ABA含量几乎都低于对照组,可见低水平的ABA有利于插穗不定根的形成,这与前人的研究结果相似,认为ABA不仅抑制IAA的合成和极性运输,而且阻止IAA从结合态释放到游离态,从而抑制不定根的形成[21-22]。因此,GGR通过抑制ABA合成来增加IAA水平显然是促进根系形成的有效途径。除ABA的峰值早于不定根的萌发外,IAA和ZR达到峰值的时间与不定根的萌发时间(扦插后40 d)同步,这可以解释为ZR在不定根萌发的早期发挥作用。由这些结果可得出,外源性激素GGR通过动态调节各内源激素的含量,加速了墨西哥落羽杉内源性激素的调节过程,从而增强了墨西哥落羽杉的生根能力[23-24]。
3.3 氧化酶活性变化对墨西哥落羽杉扦插生根的影响
植物生长调节剂能够促进插穗内酶的活性,提高植物的分化与再生的能力。其中,超氧化物歧化酶(SOD)、过氧化物酶(POD)是与植物扦插生根关系密切的2种氧化酶类。SOD的活性是植物插穗对抗外界伤害能力的指标之一,对于植物根系的形成和发育不但有促进作用,而且能够缩短整个生根过程的时间[25-26]。本研究中GGR处理组SOD的活性始终高于对照组,说明墨西哥落羽杉在生根过程需要高浓度的SOD,这可能也是其难生根的主要因素之一。本研究中,处理组POD活性在愈伤组织形成阶段始终高于对照组,是因为高POD活性有利于降解不利于愈伤形成的IAA[27-28]。相反,在不定根形成与伸长阶段对照组POD活性高于处理组,是为了减少IAA的消耗,从而能促进根的生长和伸长。
本试验首先研究了植物生长调节剂对墨西哥落羽杉生根的影响,最终墨西哥落羽杉的生根率可达到92.8%,较之前张春英等的研究提高了6.8%[3]。观察墨西哥落羽杉的生根过程后,用显微镜观察根系的解剖结构,发现其属于愈伤组织生根型。同时发现植物生长调节剂GGR可以动态调节内源激素及酶的活性,使其相互协作而处在有利于墨西哥落羽杉生根的动态平衡中。

