钠离子电池锰酸钠正极材料研究进展与发展趋势
张 凯,徐友龙
(西安交通大学,电子材料教育部重点实验室&国际电介质研究中心,陕西省先进储能电子材料与器件工程研究中心,陕西 西安 710049)
现如今,俄乌冲突引发欧洲能源价格剧增,严重威胁欧洲能源安全,欧洲对新能源需求量暴增,大大加速欧洲向新能源转型的同时,也让世界看到新能源未来发展的重要战略地位。2022年3月8日,欧盟委员会制定了REPowerEU的欧洲联合行动计划,规划欧洲在2030 年之前从俄罗斯的化石燃料中彻底独立出来。欧洲国家进一步加强对新能源的转型,其中光伏发电、风力发电等新能源需求直线上升。经过此次能源危机,全球能源独立性和新能源发展将再次提速,以降低对化石燃料的严重依赖,新能源产业发展极大促进并推动了储能领域的创新与发展,进一步巩固了储能领域的决定性地位。
根据中信建设统计,2022 年1~3 月头部组件企业向欧洲出货数据较好,部分组件公司发货量超预期[1]。图1 展示了近年来光伏市场的最新预测,从今年年初以来销量增长的现象,可以看出俄乌冲突导致了新能源需求量加倍增长,欧洲对其需求量迅速上升。

图1 中信建设新能源团队发布最新欧洲光伏市场预测[1]Fig. 1 CITIC construction new energy team releases latest European PV market forecast[1]
通过近年来的探索与发展,新能源与储能问题已经成为世界最关注的问题之一,也是当前人类社会发展的核心问题之一。可再生能源是人类能源体系非常重要的源泉,虽然近几年新冠疫情对能源市场冲击较大,但可再生能源风电、光伏发电和水力发电量均有所增加[2]。由于这些能源的利用受到地域和时间等问题的限制,不利于人类能源供给的不间断性,因此世界各国都将储能技术视为国家发展的重中之重,储能也被越来越多的国家列入国家重要发展战略,其地位得到进一步提升。中国于2020年9月明确提出2030年“碳达峰”与2060年“碳中和”目标(简称“双碳目标”),为储能领域发展颁布了多项支持政策[3]并提供了大量的资金和技术支持。
在储能领域中,电化学储能是公认的最适合、最有效、最可靠、最具前景的大规模储能方式之一。锂离子电池是当前电化学储能领域的主流产品,在新能源汽车、人工智能、电脑、手机、军事等领域得到了广泛应用,是当前社会发展最先进、占据市场份额最大的储能产物之一。图2 展示了2011—2021 年中国新能源汽车的销量和增速图,可以看出在11年里新能源汽车年销量由不足1万辆暴涨至接近300万辆,由此带动储能电池领域的需求暴涨。

图2 2011—2021年中国新能源汽车销量和增速图Fig. 2 2011—2021 Chinese new energy vehicle sales and growth rate
锂资源短缺和开发速度过慢也导致了碳酸锂价格的暴涨,图3展示了电池级碳酸锂资源从2020年2月至2022年3月的价格攀升图,可以看出两年时间内价格从每吨不足5 万元暴涨至每吨50 万元左右,价格翻涨至11 倍以上,锂资源的不利发展环境为钠离子电池的发展带来了新的契机。

图3 2020.02—2022.03电池级碳酸锂价格和增速图Fig. 3 Price and growth rate of battery-grade lithium carbonate (2020.02—2022.03)
锂在地壳中丰度低,储量仅为0.0017%[4],同时锂资源回收技术尚不成熟,过度开采极不利于绿色可持续发展,这显然不能满足大规模储能和电动汽车等领域日益发展的需求。图4 展示了2020 年全球已探明锂资源储量分布图,从全世界范围来看,锂资源整体储备量较少,相对集中在少数国家,开采难度大,因而锂资源面临过度开采(未来或将面临枯竭)、价格涨幅巨大、成本高等问题[5-8],且我国锂资源储量占比不到10%,远远无法满足储能技术、新能源汽车以及大规模储能发展的需要[5,9]。

图4 2020年全球已探明锂资源储量分布Fig. 4 Distribution of global proven lithium resources and reserves in 2020
相比之下,钠在地壳中的储量丰富,约占2.36%,资源含量比锂高1000 多倍,图5 展示了2020 年全球钠资源产量分布,可以看出钠资源分布十分广泛,我国产量占比22%,资源储备尤其丰富。

图5 2020年全球钠资源产量分布Fig. 5 Distribution of global sodium resource production in 2020
钠离子资源在盐湖盐矿中大量存在,因其易开采、价格低廉、绿色、安全、环保和可持续发展等一系列优势,钠离子电池被认为是当前锂离子电池最好且最有发展前景的互补品,也是未来发展大规模电化学储能最有希望的系统之一,表1分别对比了锂离子电池和钠离子电池的优势和劣势。同时,钠离子电池与锂离子电池原理十分相似,钠离子系统的电压、稳定性和扩散机制都与锂离子系统相当[10],因而近几十年来锂离子电池的发展为钠离子电池的发展提供了巨大的技术和方法支持。

表1 锂离子电池与钠离子电池对比Table 1 Lithium-ion battery vs. sodium-ion battery
2021 年7 月29 日,全球最大的锂离子电池公司宁德时代举行了钠离子电池发布会,将钠离子电池视为其未来发展的重大战略,首代钠离子电池将选取普鲁士白材料作为重点,其电芯单体能量密度高达160 Wh/kg,并宣布将于2023 年形成钠离子电池产业链。同时多家企业例如中科海钠、浙江钠创等公司对钠离子电池发展也都极为重视,中科海钠采用金属氧化物为正极材料,电池能量密度可以达到145 Wh/kg,实现6~12 min 的快充能力,并可在-40~80 ℃宽温区工作。仅原材料上,中科海钠就能把电池成本降低约30%。浙江钠创采用铁酸钠三元正极材料,电池循环寿命从2500 次提升至10000次。在宁德时代、中科海钠和浙江钠创的带领下,多家公司均计划于近两年实现钠离子电池量产,极大地推动了钠离子电池的进步和发展,引发了全球对钠离子电池关注的新高潮。
钠离子电池主要由工作电极(正极和负极)、隔膜(玻璃纤维、聚丙烯或聚乙烯等)以及电解液(溶解在非质子极性溶剂中的钠盐)三部分组成[11-13]。由图6可以看出,钠离子电池与锂离子电池相比,可以大大降低成本且极具优势。首先,从集流体方面来说,锂电池正极采用铝箔,负极采用铜箔,而钠电池正负极均采用铝箔,因为钠的还原电位比铝高,不易嵌入铝,因此可以采用铝箔代替铜箔(同一时期电池级铜箔的成本大约是电池级铝箔成本的3~4倍)降低成本,同时铝箔可以更好地减轻电池的重量;除此之外,Na+迁移率高于Li+,两者在相同浓度下钠离子电解液的电导率高、内阻小且倍率高,钠离子电池电解液价格比锂离子电池电解液价格更低,因而钠离子电池研究和发展备受瞩目。

图6 钠离子电池工作原理[14]Fig. 6 Working principle of sodium ion battery[14]
随着人们对钠离子电池的结构、原理及各方面性能的深入研究,对于电池容量、性能的提升和电池成本的降低来说,主要取决于正极材料体系。目前,钠离子电池正极材料的研究主要集中于过渡金属氧化物、聚阴离子化合物、普鲁士蓝类化合物等,这些材料都具有各自的优缺点[15-17],表2 对比了3种钠离子电池正极材料的优势和劣势。

表2 钠离子电池正极材料对比Table 2 Comparison of cathode materials for sodium ion batteries
针对不同的技术要求,需要选择合适的正极材料发挥出最好的性能。为了解决材料的结构缺陷、导电性能、循环性能等问题,研究人员通过元素掺杂和包覆等手段来提升材料的电化学性能[18-20]。其中锰酸钠正极材料就是过渡金属氧化物中的典型代表,之所以选用锰基材料,是因为锰资源丰富、价格低廉、安全性能优良、环境友好且易设计出不同晶型种类。锰酸钠正极材料还可以作为基元材料利用多种复杂的掺杂、包覆等手段提升其电化学性能以满足钠离子电池在不同需求和环境下的应用,因此锰酸钠正极材料对钠离子电池正极材料发展具有极其重要的意义。
本文针对锰酸钠正极材料微观以及宏观结构的研究进展进行归纳总结,着重对不同钠含量的锰酸钠材料通过3 种不同位点(钠位、锰位和氧位)掺杂以及包覆的手段进行系统深入的分析,最后对锰酸钠正极材料发展前景进行展望。
1 不同钠含量的锰酸钠正极材料微观和宏观结构
锰酸钠正极材料的微观结构和宏观结构主要由钠含量决定,在NaxMnO2正极材料中,x≤0.5 时,通常微观结构以隧道型结构为主,宏观结构以棒状结构为主,若采用溶液法等制备方法还可以制备出纳米线状宏观结构;当x>0.5时,通常微观结构以形成层状结构为主,其宏观结构以片状多面体结构为主,若采用溶液法等制备方法,还可制备出微球结构、正方体结构等宏观结构。
1.1 NaxMnO2(x≤0.5)
1.1.1 锰酸钠隧道型微观结构
当NaxMnO2中钠含量较低时(即x≤0.5),锰酸钠形成隧道型结构,且在x、y和z方向上均有Na+脱嵌的轨道。隧道型结构的锰酸钠就是其微观结构产生隧道型可供离子脱嵌通道的锰酸钠正极材料。隧道型结构一般是由不规则的多面体结构和独特的S形通道连接形成的[21],Na+可以穿插入隧道内进行脱嵌,这就是隧道型锰酸钠正极材料。Na0.44MnO2是一种典型的隧道型结构,它具有独特的S 形和五角形[22]隧道结构,隧道中含有钠的3 种不同位点(图7)。
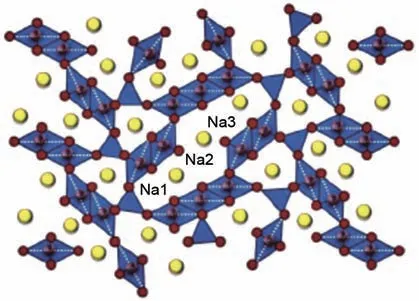
图7 正交晶型Na0.44MnO2晶体结构示意图[22]Fig. 7 Schematic diagram of the crystal structure of orthorhombic crystalline Na0.44MnO2[22]
隧道型结构为Na+的传输提供了隧道状通道,提供了非常稳定的结构支撑,不会轻易发生相变,材料稳定性优异,这样的优势在隧道型结构发展中起到了至关重要的作用。2010 年,Whitacre 等[23]使用简单固相法合成Na4Mn9O18作为水电解质储能装置的钠插层正极材料,其组装的水系全电池在0.4~1.8 V、4C条件下可逆循环1000周(图8),容量基本不发生衰减,虽然其比容量只有不到30 mAh/g,但其稳定的循环数据和速率研究表明,这种尚未开发的低成本正极材料具有良好的性能。

图8 Na4Mn9O18水系全电池在4 C的循环性能曲线[23]Fig. 8 Cycle performance curve of Na4Mn9O18 aqueous full cell at 4 C[23]
但同时隧道型结构也产生了一些劣势,首先,在相同体积下隧道型结构相比于层状结构等Na+的结合空间会大大减小,从而导致电池比容量小;其次,隧道结构的通道较为狭窄,每个通道几乎可以等同于双向通道(传输方向较为单一),使得隧道深层的Na+难以脱嵌,这就导致其充电速度较慢、充电难以释放、循环性能大大下降。若在制备过程中能将隧道通道尺寸加大、路径缩短,使得Na+能够容易脱嵌,那么凭借隧道型结构自身稳定的特点将会得到较为优异的性能效果,这是研究隧道型结构的一个重要突破点。
1.1.2 锰酸钠隧道型材料的宏观结构
若按照传统固相法制备材料,那么隧道型材料宏观结构通常表现为棒状结构。2019 年,Zhang等[24]制备了Na0.44MnO2微棒结构(图9),该结构在电压范围2.0~4.5 V、0.4 C 速率下,放电比容量为108 mAh/g。

图9 Na0.44MnO2微棒结构电镜(SEM)图[24]Fig. 9 Structural electron microscopy (SEM) image of Na0.44MnO2 microrods[24]
除固相法外很多科研人员采用溶胶-凝胶法、共沉淀法等方法制备不同形貌的宏观结构,并改变材料尺寸,增加棒状结构长径比以获得更好的电化学性能。2013 年,Liu 等[25]制备了Na0.44MnO2的纳米线结构(图10),其在0.1 C、2~4 V 条件下表现出120.4 mAh/g的比容量,该结构具有优异的稳定性,在5 C速率下,比容量为85.8 mAh/g,3300圈后容量保持率高达89%。纳米线结构相比于棒状结构来说径向尺寸更小,长径比更大,因此Na+脱嵌更加容易,改善了深层充放电困难的问题,同时由于隧道型结构自身的稳定特性,其循环稳定性得到了很大的提升,这也可以反映出在利用隧道状结构稳定性的同时,应该解决隧道深层充放电难题。

图10 Na0.44MnO2纳米线结构电镜(SEM)图[25]Fig. 10 Structure electron microscope (SEM) image of Na0.44MnO2 nanowire[25]
1.2 NaxMnO2(x>0.5)
1.2.1 锰酸钠层状微观结构
当NaxMnO2材料中钠含量较高时(x>0.5),通常形成层状结构,层状结构的锰酸钠就是其微观结构构建了层间传输通道的锰酸钠材料,主要是由八面体共边的TMO6 和钠层交替排列形成的。1980年Delmas[26]首先提出了层状结构主要分为O2、O3、P2和P3型,字母O和P分别代表钠离子所在的八面体和棱柱体位点,数字代表每个重复单元中钠层的数量,4种结构如图11所示。

图11 O2、O3、P2和P3型过渡金属氧化物晶体结构示意图[26]Fig. 11 Schematic diagram of the crystal structure of O2, O3, P2 and P3 type transition metal oxides[26]
NaxMnO2正极材料应属六方晶系,由于Mn3+的外层电子数分别是3d4、3d7,其表现为高自旋态,因而易出现Jahn-Teller畸变,NaxMnO2的空间群也会因此变为C2/m,属单斜晶系。当前最常见的两种相为P2 和O3,P2 相通常为0.67≤x<0.8 的贫钠结构,其Na+扩散通道宽阔,传输动力学性能好,空气稳定性好,但可逆容量通常略低于O3相;O3相通常为0.8≤x≤1的富钠结构,其可逆容量高,但其Na+扩散通道狭窄,传输动力学差,空气稳定性差,经两相反应易转变成O'3相,又有可能进一步转变为P'3 或P3 相,相变导致材料扭曲,甚至坍塌,影响离子传输路径,因此在循环过程中O3 型结构容量衰减过快,循环稳定性较差。2011年Ma等[27]提出了O3 型α-NaMnO2,图12 展示了其充放电曲线图,工作电压为2.0~3.8 V,在0.1 C 小电流密度下,首圈放电比容量接近185 mAh/g,但在10周时就只剩下大约150 mAh/g,放电过程中存在多个放电平台,这说明其产生了多次复杂的相变,材料结构的不稳定导致了充放电的循环性能不佳,因而人们可以通过多元素掺杂改性等方式提升材料的比容量和结构的稳定性、导电性。
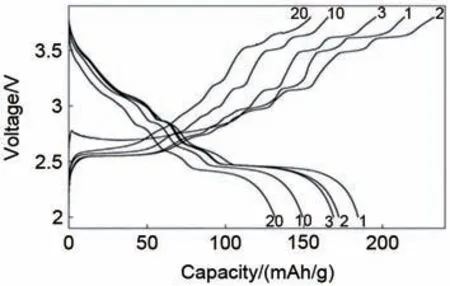
图12 NaMnO2材料在0.1 C电流密度下充放电曲线[27]Fig. 12 Charge/discharge curve of NaMnO2 material at 0.1 C current density[27]
据报道,P2结构的钠插层材料属于六方晶系,空间群是P63/mmc,比O3结构的材料显示出更好的电化学性能。O 相NaxMnO2中Na+扩散需要经历一个高能量的四面体中间态,因此,钠离子在O型八面体位点传输时势垒较大(即受到能量梯度的阻碍作用大),需要消耗较大的能量,不利于钠离子的传输,同时钠离子的驻留位点较大,在相变反应中产生不利影响[28-29];而P 相NaxMnO2结构中,相邻两层结构中的氧会发生显著的静电排斥现象,因此晶面间距较大,这会减小三棱柱不同位点的能量差,钠离子迁移势垒小,可以稳定直接地传输,只需消耗很少的能量,由于三棱柱间空间较大,Na+可以在三棱柱中稳定存在,扩散也更加容易,所以Na+扩散速率和可逆比容量得到极大的提升,因此P型结构的电化学性能更好而更加被科研人员重视。而P2 和P3 型材料在不同层的排列方式上是不同的,当前人们更多地合成的材料是P2 型的正极材料,到目前也没有明确的证据说明P2型和P3型正极材料哪种材料更好,但是从排列方式上来说,认为存在钠离子结合位点利用率的问题,理论上是具有优劣之分的,但在实际合成过程中受到现实条件影响不能够简单认为哪种结构更优。
相比于锰酸钠隧道型结构,层状结构的锰酸钠材料具有理论容量更高、循环性能更好、充电能力强、充电速度快等优势,但同时也面临一些问题,层状材料的层间构建不如隧道型结构稳定,因此易发生相变,影响了层状结构的电化学稳定性,阻碍了层状结构的进一步发展。
1.2.2 锰酸钠层状材料的宏观结构
采用传统固相法制备的钠含量x>0.5 锰酸钠正极材料通常其宏观结构表现为片状多面体结构。2018 年,Wang 等[30]合 成 了Na0.67Ni0.2Fe0.15Mn0.65O2正极材料(图13),从中可以清晰地看到材料宏观结构形成了片层状结构,尽管合成过程中有少许杂项,但整体来说仍表现为片状不规则的六边多面体结构。

图13 Na0.67Ni0.2Fe0.15Mn0.65O2正极材料宏观结构的电镜(SEM)图[30]Fig. 13 Electron microscope (SEM) image of the macroscopic structure of Na0.67Ni0.2Fe0.15Mn0.65O2 cathode material[30]
除用固相法制备得到片状多面体结构材料外,科研人员发现可以通过液相法去设计形貌更优、性能更优的宏观结构,使得正极材料结构更加稳定、比表面积大、材料与电解液接触得更加充分、缩短钠离子传输路径、加快钠离子的传输速度、利用率更高且效率更高。
2019 年,Lu 等[31]设计并制备了直径为2 μm、外壳厚度为200 nm 的Na0.7MnO2.05空心微球结构(图14),然后用聚吡咯(PPy)包覆,作为钠离子电池的正极材料。其设计的PPy包覆增强了正极材料的导电性,使得空心微球表现出更强的电化学性能,其初始容量为165.1 mAh/g,循环100次后,在0.1 A/g的情况下,容量保持率为88.6%,并且提高了钠离子电池的快充能力。
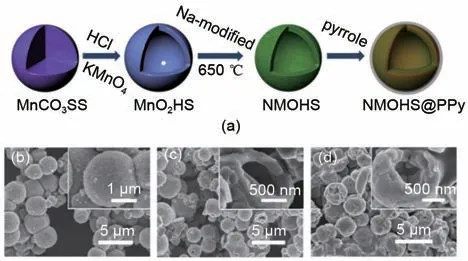
图14 (a) Na0.7MnO2.05空心微球结构和Na0.7MnO2.05@PPy聚吡咯(PPy)包覆的空心微球结构制造示意图;(b) MnO2空心微球结构的SEM图;(c) Na0.7MnO2.05空心微球结构的SEM图;(d)Na0.7MnO2.05@PPy聚吡咯(PPy)包覆的空心微球结构的SEM图[31]Fig. 14 (a) Schematic diagram of the fabricated Na0.7MnO2.05 hollow microsphere structure and Na0.7MnO2.05@PPy polypyrrole (PPy) covered hollow microsphere structure; (b) SEM image of the MnO2 hollow microsphere structure; (c) SEM image of the Na0.7MnO2.05 hollow microsphere structure;(d) Na0.7MnO2.05@PPy polypyrrole (PPy)-covered hollow microsphere structure SEM image[31]
2020 年,Lu 等[32]设计并通过高温煅烧和化学冰水浴工艺制备出了高钠含量的Na0.91MnO2多孔微立方体结构(图15)。Na0.91MnO2的高钠含量使初始容量提高到208 mAh/g,这使得钠离子全电池中导电聚合物改性后的锰酸钠正极材料表现出超高的初始容量、循环稳定性和速率能力。

图15 (a) Na0.91MnO2多孔微立方体结构和Na0.91MnO2@PPy聚吡咯包覆的多孔微立方体结构的制备过程,(b) MnCO3多孔微立方体,(c) Na0.91MnO2多孔微立方体结构的SEM图,(d, e) Na0.91MnO2@PPy聚吡咯包覆的多孔微立方体结构的SEM图、(f~i) Na0.91MnO2@PPy中Na、O、Mn和N的元素映射图像[32]Fig. 15 (a) Preparation process of Na0.91MnO2 porous microcube structure and Na0.91MnO2@PPy polypyrrole-coated porous microcube structure, (b) SEM images of MnCO3 porous microcube, (c) Na0.91MnO2 porous microcube structure, (d, e) Na0.91MnO2@PPy polypyrrole-coated porous micro cube structure SEM images, (f—i) elemental mapping images of Na, O, Mn and N in Na0.91MnO2@PPy[32]
Peng 等[33]报道了一种P2 型Na0.67Ni0.15Mn0.85O2富勒烯类空心多面体正极材料(图16),虽然其比容量不高仅有100 mAh/g,但是通过比容量的牺牲却得到了出色的循环性能,120圈循环后容量保持率高达96.8%。

图16 P2型Na0.67Ni0.15Mn0.85O2富勒烯类空心多面体通过两步自沉积策略形成流程图[33]Fig. 16 Flow diagram of P2-type Na0.67Ni0.15Mn0.85O2 fullerene-like hollow polyhedra formed by a two-step self-deposition strategy[33]
由此可见宏观结构的改变对材料的容量和循环性能的提升具有很大的影响,因此宏观结构的改造和研究也应当是正极材料研究的一个重要课题。
1.3 NaxMnO2混合相结构
NaxMnO2材料具有隧道型结构和层状结构两种微观结构,而有时也表现为隧道状和层状的混合结构。其中Na2Mn3O7就是一种典型的隧道状和层状混合结构。2017年,Adamczyk等[34]清晰地描绘了Na2Mn3O7在不同晶相分别表现出了隧道和层状结构(图17),层状相的Na2Mn3O7可以成功插入两个钠成为新的Na4Mn3O7,其在1.5~3.5 V、0.05 C速率下放电比容量为160 mAh/g。可认为混合结构中两种微观结构均起作用,其同时具有两种结构的优势,因此在未来研究中利用混合相结构来综合隧道型和层状结构优势是一个重要课题。

图17 Na2Mn3O7在(a) c轴方向上的层状结构示意图和(b) (--5,5,0)方向上的示意图[34]Fig. 17 Schematic diagram of the laminar structure of Na2Mn3O7 (a) in the c-axis direction and (b) in the(-5, 5, 0) direction[34]
2019 年,Shi 等[35]提出了一个优化的F 掺杂钠锰氧化物Na0.44MnO1.93F0.07,通过F取代可以形成层状隧道混合结构,从图18 中可以明显看出该材料形成了既有棒状结构也有片状结构的宏观结构。

图18 Na0.44MnO1.93F0.07层状隧道混合结构电镜(SEM)图[35]Fig. 18 Na0.44MnO1.93F0.07 a layer-tunnel hybrid structure electron microscopy (SEM) image[35]
微观结构与宏观结构的设计使钠离子电池锰酸钠正极材料发挥出更高的容量和更好的循环特性,提升材料的电化学性能。
2 锰酸钠正极材料不同位点元素掺杂改性
锰酸钠正极材料本身具有比容量较低、材料稳定性较差、循环稳定性弱、电压平台较低等一系列缺陷,因此科研人员们通过多元素不同比例掺杂来改变锰酸钠材料的结构特性以解决导电性、循环性等问题。但在研究中发现,元素掺杂非常复杂,将锰酸钠材料分为不同位点:钠位点、锰位点以及氧位点,掺杂元素掺杂进入不同位点产生的增益效果是不相同的。
2.1 NaxMnO2(x≤0.5)及元素掺杂
隧道型结构的最大特点是结构稳定,几乎不发生相变,要利用隧道型结构稳定性这一优势,同时对材料进行不同位点的元素掺杂以提升锰酸钠材料的电化学性能。氧位掺杂在正极材料结构构建过程中起着至关重要的作用,氧位掺杂能够降低扩散势垒,能够很好地提升离子扩散通道,抑制结构的改变,对材料的电化学性能有很大的提升。2019年,Shi 等[35]提出了一个优化的F 掺杂钠锰氧化物Na0.44MnO1.93F0.07,通过F 取代可以降低扩散势垒,形成层状隧道混合结构,该结构既具有P2 型层状结构所具有的高可逆容量的优点,也具有隧道结构出色的循环稳定性。在0.5 C 和1 C 电流密度下分别表现出149 mAh/g 和138 mAh/g 的高放电比容量。此外,在5 C时,依然具有109 mAh/g的高容量,在400圈循环后,容量保持率为79%。
在氧位掺杂的同时对锰位进行掺杂可以产生协同作用改善正极材料的缺陷。2021 年,Chae 等[36]合成了Na0.46Mn0.93Al0.07O1.79F0.21,该材料在0.3 C速率下表现出164.3 mAh/g 的高可逆容量。在5 C 速率下进行500 次循环后容量保持率为89.1%(图19)。该研究清楚地揭示了锰位掺杂Al和氧位掺杂F的有利影响,通过F掺杂,扩散势垒降低,相变反应减弱,而Al掺杂可以很好地提升材料的比容量和稳定性,通过图19 可以看出掺杂后的材料比容量和循环稳定性都得到了显著提升。
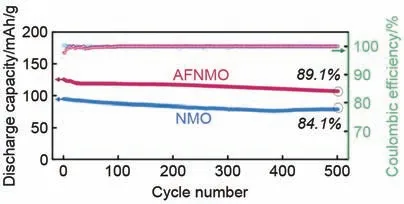
图19 Na0.46Mn0.93Al0.07O1.79F0.21与未掺杂锰酸钠材料在5 C速率下的循环性能和库仑效率[36]Fig. 19 Cycling performance and coulombic efficiency of Na0.46Mn0.93Al0.07O1.79F0.21 with undoped sodium manganate material at 5 C rate[36]
表3 列举了NaxMnO2(x≤0.5)的不同制备方法、不同掺杂元素、不同位点掺杂材料的电化学性能信息。从表3中可以发现很多性能优异的隧道型锰酸钠正极材料,例如可以通过制备纳米线宏观结构增加材料长径比来提高比容量和充放电能力[24]等。以此为基础可以进一步改变元素掺杂范围、比例和位点来加强隧道型结构的稳定性和其他电化学性能。
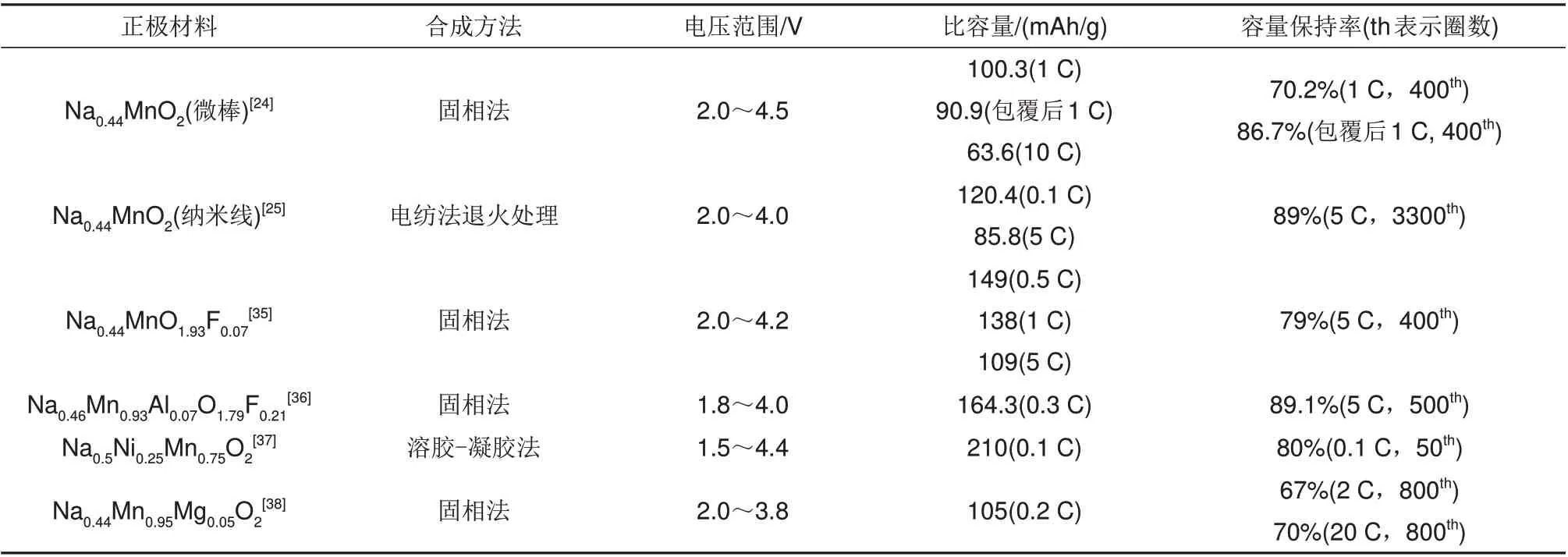
表3 NaxMnO2(x≤0.5)及元素掺杂正极材料的制备方法和电化学性能Table 3 Preparation method and electrochemical properties of NaxMnO2(x≤0.5) and element-doped cathode materials
2.2 NaxMnO2(x>0.5)及元素掺杂
2.2.1 NaxMnO2(x>0.5)
表4展示了层状锰酸钠未掺杂的正极材料的制备方法和电化学性能,从整体上看,未掺杂其他元素的x>0.5 的层状锰酸钠材料在比容量上高于x≤0.5的隧道型锰酸钠材料,但在循环保持率上x≤0.5 的隧道型结构比x>0.5 的层状锰酸钠材料更稳定。因此在比容量上层状结构更具优势,在循环稳定性上隧道型结构更具优势。本工作发现钠含量、制备方法以及材料的宏观结构对正极材料电化学性能影响很大,通过水热法等液相法制备球状等[31-32]利于离子扩散的宏观结构能够加强离子的电化学性能。

表4 NaxMnO2(x>0.5)正极材料的制备方法和电化学性能Table 4 Preparation method and electrochemical properties of NaxMnO2(x>0.5) cathode materials
2.2.2 钠位掺杂的(NaxAi)MnO2(x>0.5)
钠位掺杂顾名思义就是将元素掺杂到钠位点,式中掺杂进钠位的元素用A 表示,i表示掺杂量,通常掺杂进钠位的元素可以稳定材料结构,减少结构相变的发生,钠位点掺杂由于其对材料结构改变的特殊性以及对电化学性能提升的积极作用得到越来越多的研究。Wang 等[39]采用固相法合成了钠位点掺杂的Na0.612K0.056MnO2,由于K的掺杂更加有利于钠空位的形成,同时大尺寸的K 进一步增强了Mn—O键的强度,减少了过程中相变的发生。其在50 mA/g速率下展示了非常高的比容量240.5 mAh/g,能量密度更是达到654 Wh/kg,其100圈后容量保持率为98.2%。钠位掺杂研究带来了极其优异的性能结果,单元素的钠位掺杂对正极材料的改变和机理的探究也是未来发展多元多位掺杂的热点问题,极具有研究价值。
2.2.3 锰位掺杂的Nax(MnyMj)O2
由于钠位和氧位本身的掺杂元素种类受到结构特性限制,锰位掺杂离子半径范围更广且对掺杂离子化合价无硬性要求,因此锰位掺杂元素种类丰富且几乎不受限制,式中掺杂进锰位的元素用M 表示,j表示掺杂量;掺杂进锰位的元素一般在反应过程中发生价态的变化,既能改变材料的微观结构提升钠离子结合位点、提升材料的比容量,也能扩展Na+扩散通道,加快Na+传输速率等特性,因而科研人员对锰位掺杂尤为重视,其不仅可以单元素掺杂,也可多元素掺杂,通过选择合理的多元素掺杂,其协同作用可以更好地提升材料特性。
(1)单元素掺杂。在锰酸钠材料研究早期,人们更多地开展单元素掺杂来研究正极材料的特性改变和机理分析。单元素掺杂材料得到了广泛的研究,为之后的多元素掺杂原理分析和应用奠定了坚实的理论和实践基础。
2018年,Risthaus等[40]报道了Na2/3Ni1/3Mn2/3O2正极材料,其在1.5~4.5 V、0.05 C条件下比容量高达228 mAh/g,且同时在其2.0~4.0充放电曲线中可以明显看出(图20),通过Ni的掺杂电压平台得到了非常明显的提升。因此Ni是提升电压平台、提高比容量、稳定材料结构的一个重要的掺杂元素。
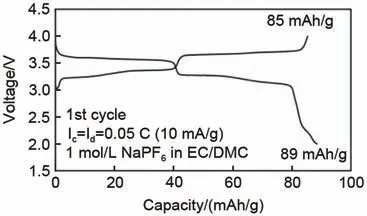
图20 Na2/3Ni1/3Mn2/3O2在2~4 V、0.05 C条件下充放电曲线图[40]Fig. 20 Charge/discharge curve of Na2/3Ni1/3Mn2/3O2 at 2—4 V, 0.05 C[40]
Mortemard De Boisse等[41]通过调整Na与Fe/Mn的原料比例,制备了O3 型Nax[FeyMn1-y]O2正极材料,Mn3+/4+氧化还原作用可以提供较高的比容量,但工作电压较低;而O3 型NaxFeO2类材料具有的Fe3+/4+拥有较高的工作电压,但是在其工作电压范围内可逆脱嵌的Na+数量较少,但制备的Nax[FeyMn1-y]O2材料兼具两者的优点。工作电压为1.5~3.8 V 时,具有大约155 mAh/g 的初始比容量,虽然材料的比容量提升不够明显,但随着Fe 比例的增加,工作电压得到了明显的提升。
关于电荷补偿机制的提出是在2004 年,Thackeray 等[42]首次提出了其中含有Li2MnO3的材料,其中Li为+1价,Mn为+4价,O为-2价,按照传统充放电机制,其中Mn 无法变价,故该材料无活性,不能作为锂离子电池充放电材料,同时该研究发现了与“传统”充放电机制不同的是该材料中是由于O 的价态由-2 到-1 的变化,或者脱氧化反应致使材料具有活性,同理“这种充放电机制”可以应用到钠离子电池材料中来。Yabuuchi等[43]合成了一种超高比容量P2型Na2/3[Mg0.28Mn0.72]O2正极材料,其拥有高达220 mAh/g 的可逆比容量(图21),且具有不错的循环特性。产生超高的可逆比容量不仅是简单钠离子脱嵌造成的,预估大的可逆比容量来源于氧离子的贡献(O2-、O1-的可逆反应和/或部分损失的氧气)。

图21 Na2/3[Mg0.28Mn0.72]O2在Na离子电池中的电化学特性(a) Na/Na2/3[Mg0.28Mn0.72]O2电池在1.5~4.4 V的电压范围内以10 mAh/g的速率循环充放电曲线;(b) 电池的放电容量和库仑效率[43]Fig. 21 Electrochemical characteristics of Na2/3[Mg0.28Mn0.72]O2 in Na ion batteries (a) Na/Na2/3[Mg0.28Mn0.72]O2 cell cyclic charge and discharge curves at a rate of 10 mAh/g in the voltage range of 1.5—4.4 V; (b) Discharge capacity and coulombic efficiency of the cells[43]
在2021 年的一篇论文中也提到了相关理论,郝一帆[44]提出了Na0.67Mg0.34Mn0.66O2的钠离子正极材料,在1.5~4.5 V的电压范围下,材料首圈的可逆比容量为205 mAh/g,经过电化学分析,极高的可逆比容量比理论容量要高很多,这些比容量应该是来源于O2-/(O2)n-的氧化还原,由于材料中存在较弱的Mg-O相互作用,可以激发材料中氧的氧化还原反应,且随着Mg 掺杂比例的提高,有更多的晶格氧参与到氧化还原过程中。Zhu 等[45]提出了Na0.67Co0.5Mn0.5O2正极材料具有非常稳定的材料结构和极其优异的电化学性能,Co 既可以提升材料的比容量,也能够起到稳定材料结构的作用。在0.1 C 速率下放电比容量为147 mAh/g 且保持良好的循环稳定性,在1 C速率下至少100次循环中具有接近100%的容量保持率(图22),当电极以超高的30 C速率循环时,放电比容量为88 mAh/g且在2000 次循环中几乎保留了一半的容量,其所做的研究工作进一步提升了钠离子电池的性能上限,形成了更高的行业标准。表5列举了锰位单元素掺杂正极材料的制备方法和电化学性能,式中M1j表示锰位单元素掺杂。

表5 Nax(MnyM1j)O2(x>0.5)正极材料的制备方法和电化学性能Table 5 Preparation method and electrochemical properties of Nax(MnyM1j)O2 (x>0.5) cathode materials
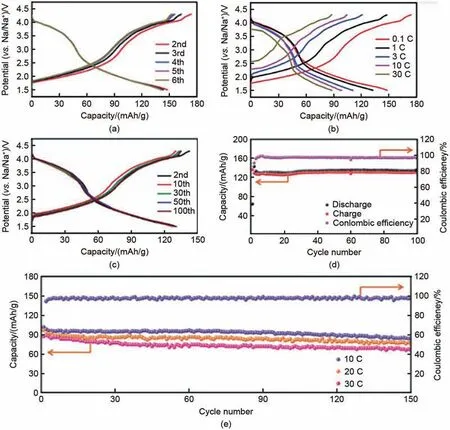
图22 (a) 0.1 C速率下充放电曲线图;(b) 0.1 C,1 C,3 C,10 C,30 C速率下首圈充放电曲线图;(c) 1 C速率下充放电曲线图;(d) 1 C速率下充放电循环性能和效率图;(e) 10 C,20 C,30 C速率下充放电循环性能和10 C的效率图[45]Fig. 22 (a) Charging and discharging curves at 0.1 C rate; (b) Charging and discharging curves for the first cycle at 0.1 C, 1 C, 3 C, 10 C, and 30 C rates; (c) Charging and discharging curves at 1 C rate; (d) Charging and discharging cycle performance and efficiency at 1 C rate; (e) Charging and discharging cycle performance at 10 C, 20 C, and 30 C rates and efficiency at 10 C[45]
(2)双元素掺杂。锰位双元素掺杂的研究也在不断深入,目的是研究两种元素在锰位掺杂时对正极材料性能的协同作用和积极影响。众多科研人员探索了多种双元素掺杂正极材料,为多种元素的掺杂提供了更加细致的理论基础。2015年,Wu等[61]合成了Na0.66Ni0.26Zn0.07Mn0.67O2正极材料,由于正极材料电压过低,所以掺杂具有高氧化还原电位的Ni2+/Ni4+,提升材料中值电压至3.6 V,同时通过引入Zn,可以有效地克服充电到较高截止电压(>4.0 V)时电压衰减的缺点,并且与未被取代的材料相比容量保持具有明显改善,且Zn 替代是限制颗粒间接触电阻增加的一个有效方法。Li等[62]使用固相法合成P2-Na7/9Cu2/9Fe1/9Mn2/3O2材料,这种材料具有超强的稳定性,其在1 C速率下150次循环后容量保持率为85%,而不发生任何相变。当其搭配硬碳(作为负极)时,该电池在0.2 C 速率下具有高达313 mAh/g的可逆比容量(图23),且能量密度高达195 Wh/kg,如此高的可逆容量使得该全电池极具研究价值。

图23 (a) 电池的充放电曲线;(b) 电池的循环效率[62]Fig. 23 (a) Charge and discharge curves of the battery; (b) cycle efficiency of the battery[62]
2019 年,Zheng 等[63]固相法合成了Na0.9Ni0.45MnxTi0.55-xO2(0≤x≤0.55)系列层状氧化物,Na0.9Ni0.45Mn0.4Ti0.15O2在1.5~4.5 V 的电压范围内提供197 mAh/g的可逆比容量,中值电压为3.27 V。增加Ti含量会导致平均电压和极化增加,但循环性能略有下降,随着Ni的加入可以大大稳定材料结构,减弱相变的发生。Park等[64]提出了一种P2型Na0.67[(Mn0.78Fe0.22)0.9Ti0.1]O2正极材料,利用过渡金属层中较强的Ti—O键抑制Mn—O 和Fe—O 的运动,通过Ti 在Mn—O—Ti—O—Fe 的排列结构中共享氧,从而抑制Mn—O 和Fe—O 的移动,它提供了180 mAh/g 的放电容量,在200次循环后容量保持率为86%。
2020年,Zhao等[65]合成了P2型Na0.59Co0.20Mn0.77Mo0.03O2正极材料,在0.1 C条件下最大放电容量为131.9 mAh/g,循环100次后,容量保持率为91.51%(大约120.7 mAh/g)。通过Mo 掺杂缩短了TM—O键,从而提高了P2型氧化物的结构稳定性;Mo掺杂增加了原始的结晶度,降低了P2 型氧化物中阳离子的无序程度;Mo—O 的键能强于Mn—O 和Co—O的键能,从而使材料的结构更加稳定。Wang等[66]报道了一种P2 型Na0.75Ni1/3Ru1/6Mn1/2O2正极材料,在充放电进程中表现出了超快的离子传输,Na+扩散系数10-10~10-11cm2/s,还表现出161.5 mAh/g的高容量以及出色的循环速率,当速率从0.2 C 增加到10 C 时,容量保持率为74%,除此之外还表现了杰出的循环性能,即使在10 C 的高速率下,500次循环后容量保持率高达79.5%,通过加入Ni和Ru 后,在充放电过程中没有发生任何相变,我们怀疑Ru能够强有力地稳定材料结构,阻止相变,使得结构极其稳定,这为钠离子快速运输的开放式框架提供了新见解。表6列举了锰位双元素掺杂正极材料的制备方法和电化学性能,式中M2j表示锰位双元素掺杂。

表6 Nax(MnyM2j)O2(x>0.5)正极材料的制备方法和电化学性能Table 6 Preparation method and electrochemical properties of Nax(MnyM2j)O2 (x>0.5) cathode materials
(3)多元素掺杂。科研人员发现,双元素的协同作用可以更好、更多地解决锰酸钠材料的缺陷,在单元素双元素掺杂研究的促进下,多元素掺杂获得了更大的关注度,并取得了更多的增益效果,使得锰酸钠正极材料有了更大的性能突破。
2018 年,Deng 等[86]报道了一种O3 型的Na[Li0.05Mn0.50Ni0.30Cu0.10Mg0.05]O2正极材料,Li 和Mg 的掺杂可以提高钠离子的电子传导性和扩散系数,从而提高正极材料的速率能力。在过渡金属层中加入Li,增加Mn4+的数量,通过氧化状态可以改善结构的稳定性。层状氧化物中加入Cu 可以改善表面结构,从而保护材料不与空气直接接触,避免在空气中氧化并且起到了抑制相变的作用。在2.0~4.0 V电压范围和0.1 C充放电速率下,它表现出172 mAh/g的可逆容量,并且在20 C 的条件下,经过1000次循环后,容量保持率高达70.4%。
2019 年,Xiao 等[87]制 备 了P2 型 正 极 材 料Na0.66Li0.18Mn0.71Mg0.21Co0.08O2,具有均匀的球形结构。在20 mA/g的条件下提供了166 mAh/g的高初始放电容量和卓越的容量保持率(循环100次后,容量保持率为82%)。Chu 等[88]合成了P2 型Na2/3Mn1/2Fe1/4Co1/8Ni1/8O2(MFCN)。引入Co 有效地抑制了材料的不可逆性,而Ni 的引入则缓解了Jahn-Teller 效应并减少Mn 的溶解。Co 和Ni 的同时引入有效地提高了电极的循环稳定性,与未掺杂Co、Ni前相比,在相同的电流密度130 mA/g下,经过100次循环,MFCN的容量保持率从51.5%提高到87.4%。同时,Ni的引入有效地提高了放电电压,中间放电电压从2.8 V 增加到3.3 V,从而提升电极的能量密度至328.6 Wh/kg。
2020年,Qiu等[89]合成了具有出色高速率性能的P2 型Na0.6Li0.07Mn0.66Co0.17Ni0.17O2(NCM),在875 mA/g(5 C)的高电流下具有87 mAh/g 的容量,并且在100次循环后容量保持率为81%。所制备的材料通过烧结为一个纳米板块,呈现出准六边形的形状,具有良好的Na+扩散性能。通过Rietveld 细化和X射线光电子能谱的结果显示,晶体结构中沿c轴方向的平面间距扩大(图24),这将促进Na+在插层/脱层过程中的扩散,平面间距的扩大可能来自于过渡金属离子的高氧化状态。

图24 P2型NCM纳米版结构示意图和纳米版NCM与非纳米板NCM-P颗粒前体的倍率性能图[89]Fig. 24 Schematic diagram of the structure of the P2-type NCM nano-plate and the multiplicative properties of the nano-plate NCM with non-nano-plate NCM-P particle precursors[89]
多元素掺杂是当今最有效、最直接的材料改进方法,多种元素通过协同作用对电化学性能进行更全面的提升。这种由超多(5 种及以上)元素掺杂的材料也被称为高熵材料,高熵掺杂策略能够很有效地提升材料的循环稳定性和倍率性能等,因此近年来高熵材料被提出后研究热度一直处于上升趋势。表7列举了锰位多元素掺杂正极材料的制备方法和电化学性能,式中Mmj表示锰位多元素掺杂。

表7 Nax(MnyMmj)O2(x>0.5)正极材料的制备方法和电化学性能Table 7 Preparation method and electrochemical properties of Nax(MnyMmj)O2 (x>0.5) cathode materials
2.2.4 钠位锰位掺杂的(NaxAi)(MnyMj)O2
研究人员发现在元素掺杂过程中元素不仅可以掺杂到锰位改变材料的结构特性,还可以同时掺杂到钠位和锰位改变正极材料的结构及性能。2018年,Wang等[99]报道了一种Mg同时掺杂入钠位和锰位的Na0.7Mg0.05[Mn0.6Ni0.2Mg0.15]O2正极材料,钠层中的镁离子是稳定层状结构的“支柱”,特别是在高压充电时,过渡金属层中的镁离子会破坏电荷的排序。更重要的是,镁离子在钠层和过渡金属层中的占据将能够在层状结构中产生“Na-O-Mg”和“Mg-OMg”配置,影响电子之间的相互作用,从而促进可逆的氧化还原反应,这种创新设计有助于使电压曲线更平滑、结构稳定性更高。2021 年,Li 等[100]提出了钠位锰位双掺杂材料Na2/3Li1/9[Ni2/9Li1/9Mn2/3]O2,中子衍射表明,引入的Li+占据了Na层和过渡金属中固有的Na+空位,因此在此结构中Li+不仅掺杂入钠位,也掺杂进入锰位(图25)。通过原位XPS 分析,Ni2+/Ni4+氧化还原对在Na+插入/抽出时有助于电荷补偿,Li+是一种很好的掺杂剂,同时在Na层中加入一些Li+离子可以中和Ni2+替代的电荷差异。因而通过钠位锰位掺杂的共同作用,该材料表现了出色的电化学性能,其初始容量为理论容量的91.6%,即使是在20 C的电流密度下,也有64 mAh/g的可逆容量(是0.1 C 电流密度时容量的58.2%)。在电压范围2.0~4.2 V 内循环1500 次后,仍然有极高的容量保持率74.5%。

图25 (a) 材料结构设计思想的示意图。同时说明了作为富镍正极代表的Li/Ni混合以及P2结构中固有的Na+空位。所制备的(b) Na2/3Ni1/3Mn2/3O2和(c) Na2/3Li1/9[Ni2/9Li1/9Mn2/3]O2材料的XRD图[100]Fig. 25 (a) Schematic representation of the material structure design idea. And illustrated the Li/Ni blend as a representative of the nickel-rich cathode and the Na+ vacancies inherent in the P2 structure. XRD plots of the prepared (b) Na2/3Ni1/3Mn2/3O2 and(c) Na2/3Li1/9[Ni2/9Li1/9Mn2/3]O2 materials[100]
Shen 等[101]报道了一种新型的P2-Na0.76Ca0.05[Ni0.23□0.08Mn0.69]O2正极材料(其中□表示空位),具有阳离子和阴离子的联合氧化活性,其中原生空位产生源于过渡金属(TM)层和Ca 离子在Na 层中铆接,在TM位点的随机空位诱发了非键合氧2p轨道的出现,以激发阴离子氧化还原作用,Ca 离子在Na位点中的结合产生了一个稳定坚固的层状结构,抑制了P2-O2相变,增强了阴离子氧化还原性。
通过对材料的钠位和锰位进行元素掺杂,可以起到稳定材料结构、平衡电荷、加强离子脱嵌、增强导电性、提高循环稳定性等作用,可以大大提高材料的电化学性能。表8列举了钠位锰位元素掺杂正极材料的制备方法和电化学性能。

表8 (NaxAi)(MnyMj)O2(x>0.5)正极材料的制备方法和电化学性能Table 8 Preparation method and electrochemical properties of (NaxAi)(MnyMj)O2 (x>0.5) cathode materials
2.2.5 锰位氧位掺杂的Nax(MnyMj) (O2-knMk)
通过锰位氧位的掺杂,可以提升材料比容量、电压、循环稳定性等,也可以抑制相变、降低势垒、提升材料充电能力,同时通过对氧位掺杂后,可以更好地提升锰位掺杂的增益效果,式中nM 表示氧位掺杂元素,k表示掺杂量。2018 年,Chen等[104]采用了阴离子掺杂策略(F 掺杂)来进一步提高Ni2+的活性,通过调控结构参数和牢固的Ni—F 键等,大大促进了Ni2+/Ni3+的活化能力和工作潜能,合成的Na0.6Mn0.95Ni0.05O1.95F0.05正极材料在2 C 条件下能够提供80.76 mAh/g的容量,在960次循环后容量保持率为75.0%。
2020年,Liu等[105]合成了一系列被F和Ni取代的Na2/3Ni1/3Mn2/3O2-xFx(x=0、0.03、0.05、0.07)正极材料,研究表明,F-取代后部分Mn4+变为Mn3+,且Mn和Ni均参与氧化还原反应,提升了正极材料的比容量,通过F取代,双相反应在低电压区域被明显抑制,结构稳定性明显提高。因此,优化后的样品Na2/3Ni1/3Mn2/3O1.95F0.05在10C 和30 ℃条件下循环2000圈后的高比容量为61 mAh/g,在10 C和55 ℃的高温下循环2000次后,容量保持率为75.6%,且用这种材料装配全电池,在1 C下循环300次后容量保持率达89.5%,这种不同温度下的电化学性能表现极具借鉴意义。
Zhou等[106]合成了P2型Na0.67Ni0.33Mn0.37Ti0.3O1.9F0.1正极材料,在2.0~4.4 V的电压范围内表现出更强的储钠性能,在2 C的电流密度下,经过300次循环后容量保持率为77.2%。同时具有很强的高低温特性和更广的使用温度范围,可以满足电池在更极端的环境下工作。在2 C 速率下,在-10 ℃和50 ℃时的可逆容量分别为82.7 和128.1 mAh/g;在-10 ℃时200 次循环后的容量保持率为94.2%。不同温度下电池性能的研究也将是未来发展的重点,将其应用于不同极地环境及扩展太空领域都是极其重要的。
2021年,Cui等[107]报道了氧位掺杂F的P2型层状Na0.67Ni0.15Fe0.2Mn0.65F0.05O1.95正极材料,由于O位点被F占据,O—O和TM—O的键能发生了变化,导致TM 的原子间距减小,层间间距增加,因而F 掺杂可以提供更宽的离子传输通道并抑制结构变形。其具有出色的电化学性能,比容量为229 mAh/g,50次循环后容量保持率为87.7%,在10 C 时的放电比容量为100 mAh/g。表9 列举了锰位氧位元素掺杂正极材料的制备方法和电化学性能。

表9 Nax(MnyMj) (O2-knMk)(x>0.5)正极材料的制备方法和电化学性能Table 9 Preparation method and electrochemical properties of Nax(MnyMj) (O2-knMk) (x>0.5) cathode materials
3 包 覆
元素掺杂具有改善电子和离子传导性、提高比容量和导电性、抑制结构相变、提高结构可逆性等优势,可以从微观结构上对材料的电化学性能进行提升,但通过元素掺杂,材料的电化学特性等方面仍然存在缺陷:氧化失氧、Mn 溶解、材料剥落、正极材料与电解液反应、导电性差等。因此可以采取包覆的手段进一步增强材料的稳定性和导电性等,在一定程度上减轻电极和电解液之间的副反应、改善循环稳定性和抑制剥落等问题。
2018 年,Kong 等[76]采用ZrO2包覆Na0.67Mn0.7Fe0.2Co0.1O2正极材料(图26),该材料采用掺入Zr4+和ZiO2的协同修饰机制,掺杂Zr4+引起的层间间距和Na—O键长度的扩大,降低了Na+迁移屏障,促进了电子导电性和Na+迁移,从而提高了速率能力。此外,Zr4+的掺杂还可以缩小厚度,Mn3+/Mn4+的比例也被降低,有利于提高结构的稳定性。而采用ZrO2包覆可以减轻电极与电解液之间的副反应,提升材料的速率能力和循环稳定性。
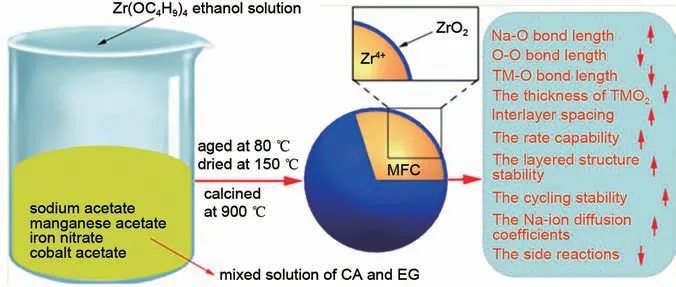
图26 材料制备的过程图和材料性能的影响[76]Fig. 26 Process diagram of material preparation and influence of material properties[76]
2019年,Yang等[47]制备了ZnO包覆的Na2/3Ni1/3Mn2/3O2正极材料,通过透射电子显微镜和能量色散光谱显示了其所制作的ZnO涂层分布均匀且厚度仅为5 nm。首先,ZnO 作为半导体材料具有极好的导电性能,作为包覆材料时可以很好地提升正极材料的导电性;其次,ZnO包覆层保护电极免受电解液的腐蚀,并有效地抑制了颗粒的剥落,使电极的形态和结构稳定;同时包覆层中少量的Zn 掺杂进入过渡金属层,减小了金属-氧之间的距离,从而更好地提升了材料的稳定性。从图27中可以看出ZnO包覆材料对性能具有较大的提升,同时合理的浓度对包覆效果会带来巨大的影响,因此在未来研究中要加强对材料和浓度的选择,同时应该对制备条件进行严格把控以获得最好的材料效果。
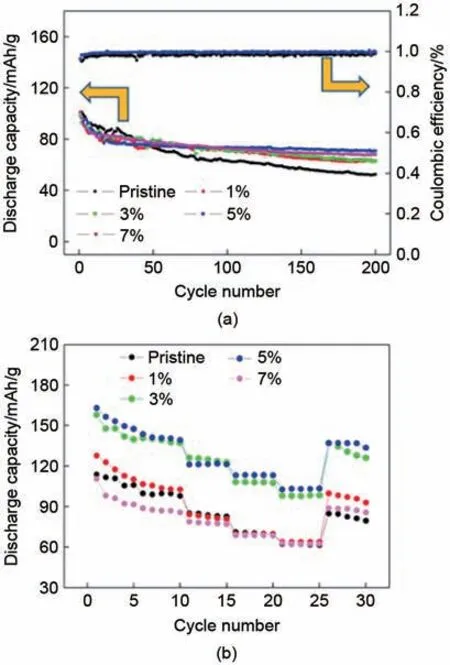
图27 (a) 原始样品和不同浓度ZnO(1%、3%、5%和7%)涂层样品在电流密度为0.5 C时的循环性能;(b) 原始样品和ZnO涂层(1%、3%、5%和7%)样品在不同电流密度(0.1、0.2、0.5、1、2 C)下的速率性能[47]Fig. 27 Cycling performance of the original sample and samples coated with different molar concentrations of ZnO (1%, 3%, 5% and 7%) at a current density of 0.5 C; (b) rate performance of the original sample and samples coated with ZnO (1%, 3%, 5% and 7%) at different current densities (0.1, 0.2, 0.5, 1, 2 C)[47]
2020 年,Kong 等[54]通过一个综合的方法来调控Na0.67Mn0.5Fe0.5O2的氧化还原反应的活性和可逆性。结合Li2SiO3包覆、Li 掺杂和Si 掺杂的优点,其初始容量、速率性能和循环稳定性都有明显改善。这种三合一的包覆思想为人们提供了包覆新思路,同时为后续单一包覆材料转变为多材料(合成材料)包覆提供了可能,可以通过将强导电的包覆材料和其他包覆材料进行结合、研究,再进行包覆,既增强材料导电性,也可以增加其他方面的电化学特性。
Wang 等[55]通过固相反应,引入Co3O4修饰来改善P2 型Na2/3Mn0.75Co0.25O2正极材料的储钠特性,通过Co3O4修饰和Co 离子掺入的协同作用显著提高了储钠特性,特别是循环性能,Co3O4包覆减弱电极与电解液的反应,抑制材料剥落,同时Co3O4具有伪电容的特性,有可能为正极材料产生电容贡献,这一点是否有效仍值得探究。从图28 可以看出使用质量分数为2%的Co3O4修饰正极材料后,在0.1 C 时达到164.1 mAh/g,在第100 次循环时容量保持率为85.6%;在1 C时达到111.4 mAh/g,在第400 次循环时保持率为72.3%;在5 C 时达到85.7 mAh/g,在第1000次循环时保持率为73.5%;在10 C时达到68.6 mAh/g,1000次循环后容量保持率为82.0%。其循环性能在1 C 下120 圈后容量保持率为90.1%,在5 C下350圈后容量保持率90.4%,在10 C下超过640圈的容量保持率为90.7%。
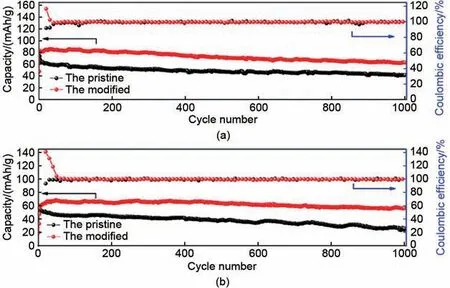
图28 在1.8~4.0 V的电压下,原始正极和包覆正极在不同的速率下的循环性能和相应的库仑效率(a) 5 C;(b) 10 C[55]Fig. 28 Cycling performance and corresponding Coulomb efficiency of the pristine and clad cathodes at different rates at 1.8—4.0 V (a) 5 C; (b) 10 C[55]
通过强导电的碳包覆可以大大提升材料的导电性,从而增强材料的比容量和速率能力。2021年,Quyen 等[56]制备了NaLi0.2Mn0.8O2(NLM)和碳包覆的NaLi0.2Mn0.8O2氧化物(NLM@C)正极材料,通过电化学测试,NLM@C 材料在0.1 C 时的比容量为160 mAh/g,比未进行碳包覆时的NLM材料高出约33%,且在1 C 充放电速率下,NLM@C 材料仍保持115 mAh/g的容量。
Zhang等[24]通过Al2O3包覆Na0.44MnO2微棒,有人认为Al2O3涂层在循环过程中可以抑制固体-电解质界面(SEI)的出现,并同时可以抑制表面失氧,这一点引起了很多研究人员的关注,但更多的Al2O3包覆研究出现在锂离子电池研究进程中,因而应该将锂离子电池的一些包覆材料同样应用于钠离子电池中研究是否具有同样的效果和优势,可供钠离子电池包覆材料借鉴的还有TiO2包覆、SiO2包覆等。Liu等[109]通过固相法制备了具有高结晶度的Na0.44MnO2微棒,然后通过沉淀法用In2O3对其进行包覆。In2O3具有与Al2O3相似的化学特性,与Al2O3相比,具有更强的惰性和对电解质的抵抗力。质量分数为1%的In2O3涂层可以显著提高Na0.44MnO2微棒的储钠能力,抑制材料表面的副反应,减少极化,并提高钠离子电池的循环稳定性和热稳定性。通过对比可以明显看出In2O3包覆后对倍率性能和循环性能有显著提升作用(图29),这也是未来包覆的一种选择,但是In2O3价格十分昂贵,很难应用于普通市场,这也是科研人员需要考虑的问题。

图29 In2O3涂层的Na0.44MnO2与未涂层材料的倍率循环图和效率图[109]Fig. 29 Multiplicative cycle diagram and efficiency diagram of In2O3 coated Na0.44MnO2 versus uncoated material[109]
4 总结与展望
本文针对锰酸钠正极材料研究进展进行系统深入的研究,发现其微观以及宏观结构对材料性能有着重要的影响,并着重对不同钠含量的锰酸钠材料通过3 种不同位点(钠位、锰位和氧位)掺杂以及包覆的手段进行深入探讨,最后对锰酸钠正极材料发展前景进行展望。本文通过对每一类问题最前沿研究进展的分析,可以看出不同元素的掺杂、不同比例的掺杂、不同位点的掺杂对材料结构的微观及宏观结构和性能产生很大的影响,通过合理的结构选择、掺杂选择和包覆选择对材料的性能能够进行极大的改善。这些改性方法为锰基钠正极材料的实用化提供了重要的指导作用。
(1)从当前研究进程来看,隧道状结构具有非常好的结构稳定性,几乎不发生相变;层状结构能够扩展Na+扩散通道,提高充放电能力,提升比容量、循环稳定性等;
(2)宏观结构的改变旨在利用不同结构使得制造出来的正极材料具有更加优异的电化学性能。对于隧道型结构来说,旨在通过增加棒状结构的长径比,制备纳米线及相关结构,解决深层离子脱嵌的难题;而对于层状结构,旨在改变片层宏观结构为空心微球、多孔立方体、富勒烯球等。改变宏观结构的目的是使结构更加稳定、比表面积大、材料与电解液接触得更加充分、缩短钠离子传输路径、加快钠离子的传输速度、利用率更高且效率更高,提升材料的充放电速率、导电性和循环稳定性;
(3)钠位掺杂通常选择尺寸特性相近的Li、K、Mg、Ca 等,可以增强结构强度,稳定材料结构,减少相变的发生,促进氧化还原反应的进行。在未来研究中可以继续扩展钠位掺杂元素例如Rb、Sr等,同时可以扩展钠位双元素及多元素掺杂以获取更多的增益效果;
(4)锰位掺杂元素种类丰富,通过不同元素的掺杂可以起到不同的增益效果,也可以利用多种元素掺杂起到协同作用,通过对该技术领域前沿的总结,大体上Li、B、Mg、Ca、Al、Co、Ti、V、Ru 等元素有提升比容量、稳定材料结构的特性,Cu、Fe、Ni 等具有提升电压工作平台的作用,上述总结是目前公认的主要作用,掺杂元素、比例、位点的选择都会对结构产生影响,进而对比容量、导电性、循环稳定性等产生影响,因此需要探究出更优的元素、比例搭配组合,在设计好结构后仍需对最终制备材料中每个元素的作用进行细致地分析;
(5)氧位掺杂通常为F等,通过负一价离子的掺杂通常可以减弱P 型材料的势垒,提高扩散速率,抑制结构相变,提升材料的稳定性,因此在未来掺杂中要多考虑Cl、Br等元素,且同时探究氧位多元素掺杂的电化学性能效果;
(6)包覆是一种很好的解决材料导电性、保护材料不与电解液发生反应、抑制材料剥落等提升材料电化学性能的可靠方式。常用的包覆材料可以选择导电性强的半导体(例如ZnO等)或强导电材料(例如碳包覆等)、多功能材料(例如Li2SiO3等)、抑制表面失氧的Al2O3和与其结构相近的In2O3等,包覆材料目前还有很多都没有被发掘出来,考虑合成新型包覆材料是未来研究的一个重要方向。
(7)高熵材料掺杂策略的提出显著影响了正极材料的循环性能和倍率性能,是一种非常有前途的正极材料掺杂思想。
在宁德时代、中科海钠、浙江钠创等公司的带领下,钠离子电池进入实用化阶段,但仍需解决电压平台低、电压平台随循环逐渐降低、锰溶解、循环性能不够强和比容量还不够高等问题。需要对材料采取微观宏观结构设计、多元素多位点掺杂和包覆等技术方法,拓宽多元素多位点掺杂协同作用,提升材料的电化学性能,系统深入地研究其倍率及高低温特性等。随着高熵化合物的开发,钠离子电池的发展将会持续迅猛地推进,有望在不久之后取得突破性进展。从本文所论述的科研成果中,可以预测在未来对锰酸钠材料的研究中,应加强对锰酸钠材料高能量密度、高倍率、高循环、高低温特性等的研究,同时应该加强对配套电解液以及负极材料等配件的不断创新与发展,加快促进钠离子电池在新能源汽车和未来大规模储能领域的现实应用。随着当今国家能源战略地位的进一步提升,给钠离子电池发展带来了巨大的动力和支持,期望在未来5年钠离子电池得到广泛应用。

