小鼠Aurora-A 蛋白的生物信息学分析*
杨可心 王 会 李会
(1.徐州医科大学生命科学学院,江苏徐州 221004;2.徐州医科大学基础医学院,江苏徐州 221004)
0 引言
极光激酶A(Aurora-A)是一种丝氨酸/苏氨酸蛋白激酶,是近年来广受关注的细胞周期调节因子。Aurora-A激酶主要定位于有丝分裂期细胞中心体和纺锤体微管,在中心体复制阶段开始表达,促进中心体的成熟、分离、纺锤体的精确组装及胞质分裂。Aurora-A 以有丝分裂激酶依赖的方式调控多种细胞的发育分化和稳态维持,主要参与调控G2/M 期的细胞周期进程[1]。多项研究表明,Aurora-A 在造血恶性肿瘤、乳腺癌、结直肠癌等多种类型的癌症中异常高表达,是多种肿瘤治疗的靶点分子[2]。
尽管Aurora-A 以有丝分裂激酶依赖的方式调控多种细胞的发育分化和稳态维持,目前有研究指出Aurora-A 也以有丝分裂激酶非依赖的方式调控细胞多种生命活动,例如,Aurora-A 调控免疫突触的微管形成介导T 细胞活化[3]、介导微管形成调控神经元轴突延伸等[4]。此外,Aurora-A 作为丝苏氨酸激酶可通过磷酸化与中心体功能无关的蛋白质,如Taga 等人发现在U20S 人骨肉瘤细胞中,Aurora-A 可诱导Akt 和mTOR 癌蛋白的磷酸化,从而促进癌细胞扩增[5]。近年来也有研究报道,Aurora-A 存在着经典的SUMO 化保守序列,体内和体外实验均证明Aurora-A 通过SUMO 化促进自身激酶活性从而确保细胞的有丝分裂正常进行[6]。
Aurora-A 以有丝分裂激酶依赖和非依赖的方式调控多种细胞的生命活动,但是Aurora-A 激酶活化的结构基础和具体作用机制目前还不清楚。研究小鼠Aurora-A 的蛋白性质和蛋白结构对研究其功能具有重要的意义,目前尚未见Aurora-A 蛋白性质和结构的相关报道。本研究利用生物信息学工具对小鼠Aurora-A 蛋白的性质和结构进行预测和分析,旨在为研究Aurora-A 蛋白在生理和病理条件下的功能和调控机制奠定基础。
1 材料与方法
1.1 材料
从NCBI 获取小鼠Aurora-A 蛋白的氨基酸序列(GenBank:AAH14711.1)。在线分析工具为 Blast、ExPASy、SOPMA、Swiss Model、NetPhos、SUMOplot、JASSA、GPS-SUMO 等生物信息学分析软件。
1.2 方法
利用生物信息学分析软件ExPASy 分析Aurora-A 蛋白的理化性质和疏水性(https://web.expasy.org/protparam,http://web.expasyweb.expasy.org/ protscale),利用SOPMA 分析Aurora-A 的二级结构(http://npsa-pbil.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html),利用Swiss Model 分析Aurora-A 的三级结构(https://swissmodel.expasy.org/),利用NetPhos3.1 对Aurora-A的磷酸化位点进行预测(https://services.healthtech.dtu.dk/services/NetPhos-3.1/),利用SUMOplot (http://www.abgent.com/sumoplot)、JASSA(http://www.jassa.fr/)和GPS-SUMO (http://sumosp.biocuckoo.org/)软件预测Aurora-A 的SUMO 化位点。
2 结果与分析
2.1 Aurora-A 理化性质分析
小鼠Aurora-A 分子式为C2083H3325N609O614S14,含417个氨基酸残基,由20 种基本氨基酸组成。小鼠Aurora-A蛋白质分子量为47172.87u,等电点为9.44,含带正电荷的氨基酸残基(赖氨酸+精氨酸)62 个,带负电荷的氨基酸残基(谷氨酸+天冬氨酸)46 个。体外小鼠Aurora-A的半衰期在哺乳动物细胞中为30h,在酵母中>20h,在大肠杆菌中>10h。Aurora-A 蛋白的不稳定指数为50.61,根据蛋白质稳定参数在40 以下判定为稳定蛋白质,推测小鼠Aurora-A 属于不稳定蛋白质。Aurora-A 的脂溶系数为76.42,亲水系数为-0.628,说明该蛋白为亲水性蛋白质[7]。ProtScale 软件分析的结果显示,绝大多数氨基酸分值为较低的负值,表明Aurora-A 是较强的亲水性蛋白质,小鼠Aurora-A 疏水性分析如图1 所示。

图1 小鼠Aurora-A疏水性分析
2.2 Aurora-A 二级结构和三级结构分析
利用SOPMA 分析Aurora-A 蛋白质二级结构,窗口参数(Window width)设置为17,相似阈值(Similarity threshold)设置为8,状态数(Number of states)设置为4。结果显示,小鼠Aurora-A 蛋白质二级结构中α-螺旋占27.10%、延伸链占11.99%、β-转角占5.28%、无规则卷曲占55.64%(见图2A)。利用Swiss Model 软件对Aurora-A三级结构进行预测,以Aurora-A 为模板(P97477.1.A)进行同源建模,预测结果如图2B 所示,GMQE 值为0.71,说明预测结构可靠。
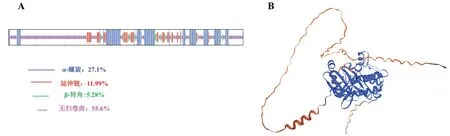
图2 小鼠Aurora-A蛋白的二级结构和三级结构
2.3 Aurora-A SUMO 化位点和磷酸化位点预测
利用NetPhos 软件对小鼠Aurora-A 蛋白质进行磷酸化位点分析,结果显示,Aurora-A 共有43 个磷酸化位点,判定标准为得分>0.5(见图3),其中丝氨酸26 个、苏氨酸14 个、酪氨酸3 个。利用SUMOplot、JASSA、GPS-SUMO三个软件对Aurora-A 蛋白的SUMO 位点进行预测,综合3个软件预测的结果(见表1),小鼠Aurora-A 的271、322、156 位赖氨酸发生SUMO 化的可能性最高,且271 位赖氨酸序列与SUMO 化特异性序列Ψ-K-X-E/D 一致。其中,Ψ代表疏水性氨基酸,K 是SUMO 分子共价结合的赖氨酸,X 为任意氨基酸,D/E 为酸性氨基酸(天冬氨酸D 或者谷氨酸E)。

表1 小鼠Aurora-A SUMO位点预测
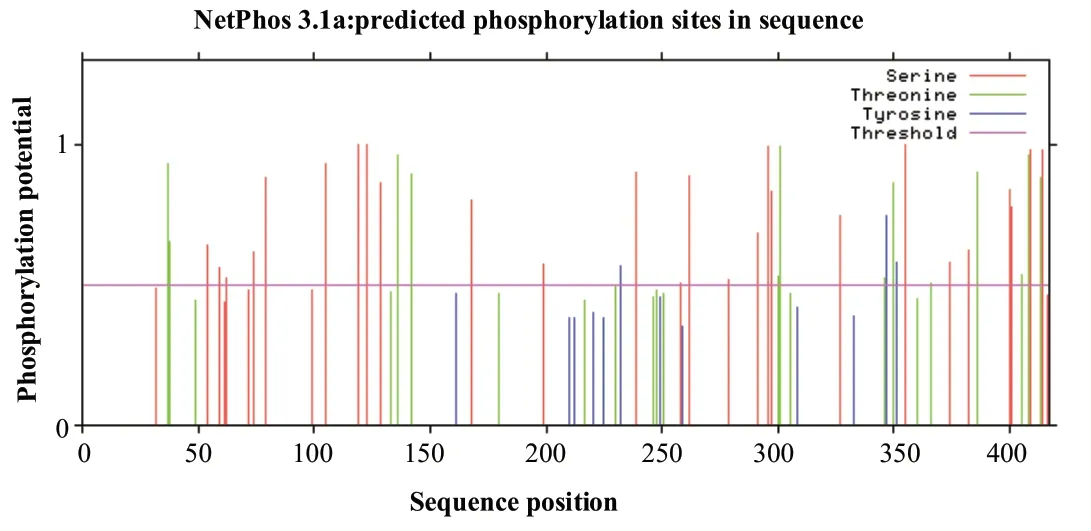
图3 小鼠Aurora-A蛋白磷酸化位点预测
3 结论
Aurora-A 是一种丝氨酸/苏氨酸蛋白激酶,是近年来广受关注的细胞周期调节因子,通过生物信息学分析软件研究发现,Aurora-A 是一种不稳定的亲水性碱性蛋白质,共有43 个磷酸化位点和一个保守的SUMO 化序列。蛋白质结构是其功能的基础。通过深入分析Aurora-A 的理化性质和蛋白质结构,为进一步研究Aurora-A 在生理和病理条件下的功能和调控机制提供实验依据。
蛋白质的理化性质是蛋白质鉴定、提纯、纯化的基本依据,本研究中蛋白质理化性质预测结果显示,小鼠Aurora-A 是一个不稳定的亲水性碱性蛋白质。蛋白质的磷酸化可以调节蛋白质的结构和功能,在细胞信号转导过程中发挥重要调控作用。激活的Aurora-A 是其磷酸化形式,其活化通常发生在有丝分裂G2/M 期[8]。尽管TPX2、BORA、BuGZ 等已被报道可激活Aurora-A[9-11],但是Aurora-A 激酶活性的调控机制仍知之甚少,本研究预测发现,Aurora-A共有43 个磷酸化位点,将为研究Aurora-A 激酶的活化提供一定的实验依据。除了磷酸化,SUMO 化修饰也可调控蛋白质的活性和功能,有研究报道小鼠精母细胞中Aurora-A在减数分裂G2/M 期发生SUMO 化[12],但是SUMO 化调节Aurora-A 的具体调控机制尚不清楚。本研究中发现Aurora-A的271、322、156 位赖氨酸发生SUMO 化的可能性最高,且271 位赖氨酸序列与SUMO 化特异性序列Ψ-K-X-E/D 一致,Aurora-A 激酶SUMO 化位点的预测为深入研究Aurora-A激酶SUMO 化的具体调控机制奠定一定的实验基础。
Aurora-A 作为一种重要的有丝分裂激酶调控多种生命活动。通过生物信息学方法分析其理化性质、蛋白结构和激酶活性位点,可为研究Aurora-A 蛋白在不同的生理和病理条件下的作用和功能提供必要的信息,也可为Aurora-A 参与的相关疾病研究和疾病治疗提供新的思路和分子靶点。

