越南伯克霍尔德氏菌B418的红色荧光蛋白标记及功能稳定性
刘敏敏,吴远征,扈进冬,李纪顺,王燕,杨合同,*
(1. 齐鲁工业大学(山东省科学院) 生物工程学院,山东 济南 250353; 2. 齐鲁工业大学(山东省科学院) 山东省科学院生态研究所 山东省应用微生物重点实验室,山东 济南 250103)
荧光蛋白标记是指利用不同颜色的荧光蛋白或荧光蛋白基因作为标记物,连接到蛋白、核酸等生物分子上,构建携带有荧光且不影响生物正常生理活性的一种标记方法[1-2]。荧光蛋白作为基因表达的报告基因、细胞发育过程中的外源标记以及活细胞体内蛋白的定位标签,已经广泛应用于生物大分子的遗传检测和示踪侵染,具有操作简便、非放射性、稳定性高、灵敏度高和选择性好等特点[3-5]。常用的荧光蛋白主要包括绿色、黄色和红色等3种颜色,其中绿色荧光蛋白(green fluorescent protein, GFP)最初从维多利亚多管发光水母Aequoreavictoria中分离,发射光谱一般在440~529 nm;黄色荧光蛋白(yellow fluorescent protein, YFP)是GFP的一种突变体,由203位苏氨酸突变为酪氨酸,发射波长为527 nm;红色荧光蛋白DsRed首先发现于珊瑚属海葵Discosomastriata,发射光谱更长,大多在560~610 nm[6]。DsRed与GFP在氨基酸水平上仅有23%的相似性,但二者的三级结构十分相似[7]。
荧光蛋白标记靶标微生物在植病生防领域展现出巨大的应用潜力,可用于植物病原菌的侵染、生防菌的定殖与互作、致病基因的表达检测及抗性植株的构建筛选等[8-9]。Wang等[10]将绿色荧光蛋白GFPuv连接到广宿主质粒pDSK上,构建了稳定、宿主范围广、高表达的质粒载体pDSK-GFPuv,并转化丁香假单胞菌,荧光观察标记后的病原菌能够实时监测细菌在宿主烟草叶面的侵染、定位和活性以及整个植物水平上的细菌病害发展。田兆丰等[11]将绿色荧光蛋白质粒pGFP4412电击转入枯草芽孢杆菌Kct99,获得稳定遗传的荧光标记菌株gfp-Kct99,对甘蓝枯萎病的防治效果可达到90%以上,发现gfp-Kct99在作物根部定殖并占领一定的生态位点和空间,从而更有效地防止病害的发生。王亚娇等[12]采用PEG-CaCl2介导的原生质体转化体系将红色荧光蛋白基因DsRed转入到列当的生防菌株Br-2中,共聚焦显微镜观察表明Br-2-DsRed能够侵染寄生植物-分枝列当的茎部表皮、厚壁细胞及维管束细胞内部,并导致茎部腐烂,而不会侵染番茄根尖内部。Villarino等[13]在弧菌启动子gpdA的驱动下利用sGFP和DsRed分别标记红青霉PO212,标记菌株的生长速率、形态培养及生防功效均未受影响,荧光观察显示两种质粒转化的PO212在番茄根尖定殖而不侵入根内组织。
越南伯克霍尔德氏菌BurkholderiavietnamiensisB418(菌种保藏号CGMCC No.1212)是本课题组从大麦根际土壤中分离到的一株多功能生防细菌,该菌株具有固氮、解磷、解钾、促进植物生长及防治真菌和线虫病害的作用,已作为生物农药和生物肥料推广应用于农业生产上[14-15]。前期田间试验表明,施用B418菌株对番茄根结线虫病的防治效率为63.42%,对茄子根结线虫病的防治效率为75.60%[16]。室内毒力测定结果显示,B418菌株发酵上清液对南方根结线虫2龄幼虫的6 h校正死亡率达70%以上,对次级代谢物的分离鉴定表明,其发酵液中含有cyclo(L-Pro-L-Leu)、cyclo(L-Pro-L-Phe)等多种环二肽[17]。此外,B418菌株还能分泌儿茶酚型铁载体,竞争螯合土壤中的铁元素,表现出显著的杀线虫活性。本研究拟利用红色荧光蛋白DsRed转化标记B418菌株,检测荧光标记菌株的功能稳定性,为探究B418菌株在植物根际的定殖及其与病原菌的互作奠定基础。
1 材料与方法
1.1 材料
1.1.1 菌株与质粒
越南伯克霍尔德氏菌BurkholderiavietnamiensisB418、尖孢镰孢菌Fusariumoxysporum和大丽轮枝菌Verticilliumdahliae均为本实验室保存;大肠杆菌E.coliJM109购自天根生化科技(北京)有限公司。质粒pCMV-C-DsRed和pGEX-4T-1购自武汉淼灵生物科技有限公司。
1.1.2 培养基
溶菌肉汤(Luria-Bertani,LB)培养基:胰蛋白胨10 g,酵母粉5 g,氯化钠10 g,无菌水1 L,pH 7.2~7.4,固体培养基添加1.5%琼脂粉。胰蛋白胨酵母粉(tryptone yeast extract,TY)培养基:胰蛋白胨10 g,酵母粉1 g,CaCl20.2 g,无菌水1 L,pH 7.2~7.4,固体培养基添加1.5%琼脂粉。B418专用固体培养基:K2HPO40.5 g,MgSO4·7H2O 0.2 g,NaCl 0.02 g,CaCl20.2 g,NaMoO4·2H2O 0.002 g,EDTA-FeNa 0.006 g,谷氨酸钠0.05 g,葡萄糖5 g,琼脂粉15 g,无菌水1 L,pH 7.2~7.4。马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基:马铃薯200 g,葡萄糖20 g,琼脂18 g,无菌水1 L,pH自然。抗生素:氨苄青霉素,工作质量浓度100 μg/mL。
1.1.3 试剂
氨基纳米黏土参考文献[18]所述由本实验室合成。DNA marker、Premix TaqTM、限制性内切酶及T4 DNA连接酶购自宝生物工程(大连)有限公司。质粒提取试剂盒和DNA胶回收试剂盒购自天根生化科技(北京)有限公司。引物合成、序列测定由生工生物工程(上海)股份有限公司合成。
1.2 方法
1.2.1 重组质粒pGEX-4T-1-DsRed的构建
以含红色荧光蛋白DsRed的质粒pCMV-C-DsRed为模板,采用DsRed的特异性引物P1(5′-CGCGGATCCATGGACAACACCGAG-3′)和P2(5′-CCGGAATTCCTGGGAGCCGGAGTG-3′)进行聚合酶链式反应(polymerase chain reaction,PCR)扩增,反应参数为:94 ℃预变性3 min;94 ℃变性1 min,52 ℃梯度退火30 s,72 ℃延伸1 min,30个循环;72 ℃终延伸10 min。PCR产物电泳后采用凝胶回收试剂盒回收目的片段,并进行序列测定。
将回收后的DsRed片段和高拷贝表达载体pGEX-4T-1分别用限制性内切酶BamHI和EcoRI双酶切,回收线性化载体片段;载体pGEX-4T-1与DsRed片段按摩尔比1∶3的比例混合,加入T4 DNA连接酶,于16 ℃连接过夜后采用热击法转化E.coliJM109感受态细胞,在含氨苄青霉素的LB固体培养基上37 ℃培养过夜;挑取筛选阳性克隆子,提取质粒,通过双酶切和PCR扩增鉴定重组质粒pGEX-4T-1-DsRed。
1.2.2 氨基纳米黏土介导转化B418菌株
参考文献[18]的方法利用氨基纳米黏土介导将重组质粒pGEX-4T-1-DsRed导入B418菌株中。按照文献所述合成纳米黏土,用灭菌双蒸水配置100 mg/mL纳米黏土溶液,加入重组质粒pGEX-4T-1-DsRed至150 ng/mL制备纳米黏土-质粒混合液。将B418菌株接种到TY液体培养基中30 ℃振荡培养至对数期,离心收集菌体,用生理盐水洗涤2次。在1.5 mL微量离心管中分别加入500 μL B418菌悬液和等体积纳米黏土-质粒混合液,涡旋震荡30 s,取200 μL涂布含氨苄青霉素的B418固体培养基平板,30 ℃倒置培养16~24 h,挑取筛选阳性转化子,并将标记菌株命名为B418-DsRed。
1.2.3 标记菌株的荧光显微观察
用接种环挑取抗性平板上的单菌落涂布于载玻片上,置于奥林巴斯Fluoview FV3000型激光扫描共聚焦显微镜下观察,激发光波长558 nm,发射光波长583 nm,观察菌体能否在绿光下激发红色荧光。
1.2.4 标记菌株生长曲线的测定
将标记菌株B418-DsRed的单菌落接种于含5 mL TY液体培养基的试管中,于30 ℃下180 r/min振荡培养12~16 h,按1%的接种量接种到装有100 mL TY培养基的三角瓶中,于30 ℃下180 r/min摇床培养。以野生菌株B418为对照,每2 h取菌液1 mL,测定其OD600值,记录数据并绘制二者的生长曲线。
1.2.5 标记菌株遗传稳定性的测定
过夜活化标记菌株B418-DsRed,以0.1%接种于无抗生素的TY培养液中,于30 ℃下180 r/min振荡培养6 h,取样再以0.1%接种无抗生素TY培养液于同样条件培养,如此重复转接10代,最后涂布于无抗生素TY平板,随机选取200个克隆转入含抗生素的平板,以抗性菌株百分比计算工程菌株的遗传稳定性。
1.2.6 标记菌株抑菌能力的测定
采用平板对峙培养法测定标记菌株的抑菌能力:用无菌打孔器将PDA平板上培养的尖孢镰孢菌和大丽轮枝菌打成直径5 mm的菌块,将菌块转接到PDA平板中央;在距病原菌块1.5 cm处放置灭菌的滤纸片(直径0.5 cm),分别滴加10 μL活化培养的标记菌株B418-DsRed和野生菌株B418,各处理重复3次,置于28 ℃恒温培养5~7 d,至朝向滤纸片方向的病原菌菌落不再生长时(其他方向继续生长),采用十字交叉法测量病原菌菌落直径,计算抑菌率。
1.3 数据分析
采用Excel 2013和SPSS 16.0软件对试验数据进行分析并作图,应用Duncan新复极差法进行差异显著性检验。
2 结果与分析
2.1 重组质粒pGEX-4T-1-DsRed在大肠杆菌中的表达
通过PCR扩增从哺乳动物细胞表达质粒pCMV-C-DsRed中得到DsRed片段,凝胶回收后测序未发现碱基突变。将DsRed片段和表达载体pGEX-4T-1分别用BamHI和EcoRI双酶切、连接,转化JM109,提取质粒,双酶切检测获得了约4.9 kb质粒和0.7 kb片段(图1(a)),PCR扩增也有明显的0.7 kb条带(图1(b)),表明重组质粒pGEX-4T-1-DsRed构建成功。转化后的大肠杆菌在激光共聚焦显微镜下观察到很强的红色荧光(图2),表明重组质粒在大肠杆菌中得到了高效表达。

注:M1为1 kb DNA Marker; A1为BamHI和EcoRI双酶切; A2为EcoRI单酶切; M2为100 bp DNA Marker; B1~B5为阳性克隆子PCR产物; B6为阴性对照。图1 重组质粒pGEX-4T-1-DsRed的酶切及PCR鉴定Fig.1 Electrophoresis of digested plasmid pGEX-4T-1-DsRed and PCR amplification of DsRed fragment
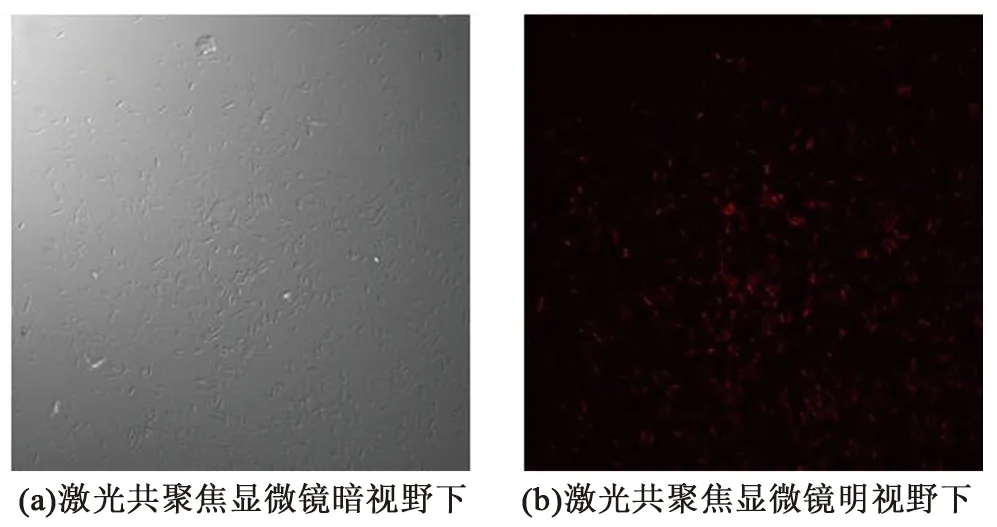
图2 大肠杆菌转化菌株的荧光观察结果Fig.2 Fluorescent observation of transmitted E.coli JM109 labeled with DsRed
2.2 DsRed标记伯克霍尔德氏菌B418的形态及荧光观察
为提高越南伯克霍尔德氏菌的转化效率,采用氨基纳米黏土介导的转化方法将重组质粒pGEX-4T-1-DsRed转入B418菌株中。带有阳离子电荷的氨基纳米黏土能够附着于细菌细胞表面,在外加摩擦力的作用下纳米黏土刺穿细胞壁,将DNA分子携带转移到细菌细胞内。将涡旋震荡后的菌体与纳米黏土混合液涂布抗性培养基,筛选得到菌落形态与原始菌株B418相似但颜色略带暗红色的菌落。转化后的阳性菌株置于激光共聚焦显微镜下,可以观察到清晰明亮的有红色荧光的菌体(图3),表明荧光蛋白DsRed在B418菌株中标记成功并获表达。

图3 伯克霍尔德氏菌B418标记菌株的荧光观察结果Fig.3 Fluorescent observation of transmitted Burkholderia vietnamiensis B418 labeled with DsRed
2.3 标记菌株B418-DsRed的生长曲线
标记菌株B418-DsRed和野生菌株B418的生长趋势基本相同,生长曲线基本重合(图4)。菌株接种初期生长比较缓慢,在培养8~30 h为对数生长期,30~48 h为稳定期,48 h后进入衰亡期,表明野生菌株B418进行红色荧光蛋白标记后,外源质粒pGEX-4T-1-DsRed的存在和红色荧光蛋白的表达对B418菌株的生长无明显影响。
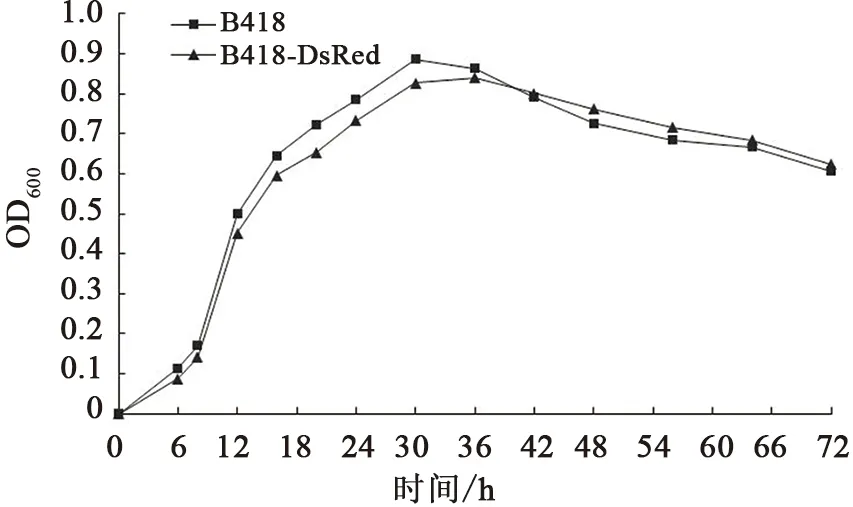
图4 标记菌株B418-DsRed和野生菌株B418的生长曲线Fig.4 The growth curve of wild strain B418 and labeled strain B418-DsRed

图5 标记菌株B418-DsRed质粒稳定性Fig.5 Stability of labeled strain B418-DsRed
2.4 标记菌株B418-DsRed中质粒的遗传稳定性
标记菌株B418-DsRed连续稀释培养的试验结果表明,在本试验条件下连续继代培养10次后抗生素抗性菌株所占百分比达91.2%(图5),说明重组质粒pGEX-4T-1-DsRed在B418菌株体内可以稳定地完成遗传复制。伯克霍尔德氏菌在实验室适宜条件下约20 min分裂一代,在自然条件下分裂一代所需时间为50~100 h,因此标记菌株B418-DsRed的质粒稳定性能够满足一般作物特定生育期甚至一年生作物全生育期研究的需要。
2.5 标记菌株B418-DsRed对病原菌的抑菌能力
采用平板对峙培养试验测定标记前后菌株对尖孢镰孢菌和大丽轮枝菌的抑菌能力,标记菌株B418-DsRed对2种病原菌的抑菌率分别为55.25%和67.55%,野生菌株B418分别为58.32%和66.47%(表1),二者间无显著性差异,说明标记后的菌株抑菌能力稳定,即重组质粒pGEX-4T-1-DsRed的导入并未影响其抑菌能力,依然具有很强的生防功能。

表1 标记菌株B418-DsRed和野生菌株B418对病原菌的抑菌能力Table 1 Inhibition rates of labeled strain B418-DsRed and wild strain B418 against Fusarium oxysporum and Verticillium dahliae
3 讨论
荧光蛋白标记技术作为快速高效的研究工具,在生防微生物定殖、微生物与环境及宿主相互作用研究等方面展示出良好的应用前景。作为生物标记的一种形式,表达性质粒标记菌株的应用已成为生物学研究方法的重要组成。本研究利用氨基纳米黏土介导的转化方法对越南伯克霍尔德氏菌B418进行了DsRed荧光标记,并对标记菌株B418-DsRed的功能稳定性开展了研究。

其次,验证了标记菌株B418-DsRed的生长速率及拮抗活性与野生型菌株相比无显著差异,而且质粒的遗传稳定性较好,说明外源质粒并未影响其生理功能与生防特性的发挥,外源质粒在细菌体内的稳定性是影响其功能表达的重要因素[21]。外源荧光蛋白的导入可能会对转化菌株造成额外的代谢负担,进而影响转化菌株的功能与特性,导致转化菌株在自然界中与其他微生物生存竞争时处于不利地位[22]。因此,转化完成后对转化菌株稳定性的评估至关重要。本研究为进一步阐明该生防菌在植物体及其根际的定殖及与病原菌在土壤环境中的互作奠定了基础。

