哈茨木霉T-aloe防治小麦赤霉病潜能及发酵条件优化
庞丽 宋昊跃 王春迪 赵薛红 安慧敏 库园冉 王彩芳 张建夫 葛红莲 张福丽

摘要:对哈茨木霉T-aloe促进小麦生长和防治小麦赤霉病的潜能进行分析,并对其液体发酵条件进行优化。通过平板对峙试验发现,T-aloe能够抑制小麦赤霉病原菌PH-1生长,抑菌率为72.38%。通过温室试验发现,T-aloe可以促进小麦幼苗生长,提高小麦的抗病性。在无小麦赤霉病菌胁迫下,T-aloe提高小麦幼苗的株高、根长和叶片含水量,其中叶片含水量提高1.01倍,株高和根长分别提高16.7%和16.2%。在小麦赤霉病菌胁迫下,T-aloe提高小麦体内抗氧化酶POD和CAT活性28.17%和39.33%,同时降低了MDA和游离脯氨酸含量34.26%和25.71%。通过田间试验发现,T-aloe对小麦赤霉病的防治效果达到了68.42%,且高于阳性对照[XCZ1.tif]霉灵。通过正交试验发现,糖蜜-酵母膏培养基为T-aloe液体发酵产孢的最优培养基,最佳培养基条件为:培养温度32 ℃、接种量5%、转速 180 r/min,产孢量可达1.82×108 CFU/mL,比优化前提高64.91%。综上所述,哈茨木霉T-aloe是1株既能促进小麦生长又能防治小麦赤霉病的优势菌株。为了哈茨木霉T-aloe进一步商业化应用,对发酵条件进行优化,提高哈茨木霉T-aloe的产孢量,为哈茨木霉T-aloe的应用提供理论依据和奠定基础。
关键词:哈茨木霉;生物防治;小麦赤霉病;液体发酵;产孢量;培养基优化
中图分类号:S435.121.4+5 文献标志码:A
文章编号:1002-1302(2023)23-0132-08
小麦(Triticum aestivum L.)是全球三大谷物之一,种植面积大且分面范围最为广泛,也是我国重要的经济粮和储藏粮,并在国民经济中起着重要作用[1]。小麦赤霉病是由多种镰刀菌引起的小麦重要病害,其中由禾谷镰刀菌(Fusarium graminearum)引起的尤为严重。近年来,由于全球气候变暖、气温升高,很多地方尤其是高温、高湿地区的小麦赤霉病流行成灾,危害程度不断加深[2]。在我国,小麦赤霉病一般发生在长江中下游和淮河以南地区,这种病害一般可导致小麦产量损失10%~30%,重灾时可达70%,甚至颗粒无收[3]。小麦赤霉病除造成小麦减产外,还会在小麦感病籽粒里产生多种镰刀菌毒素,如脱氧雪腐镰刀菌烯醇(deoxynivalenol,DON)和玉米赤霉烯酮(zearalenone,ZEA)。人类和牲畜一旦误食了含有这些毒素的小麦,就会产生一系列的中毒反应,严重时甚至死亡[4]。
目前,人们通常使用化学防治、生物防治和农业防治等手段防治小麦赤霉病,主要以化学防治为主。但是随着化学农药的过量使用,病原菌株的抗药性不断增强,使化学农药防效逐渐降低[5]。近年来,生物制剂开始逐渐替代化学农药,成为农作物病害管理的重要措施,同时解决了化学杀菌剂对其他非目标生物产生的不利影响[6]。木霉(Trichoderma spp.)作为重要的生防真菌,可以快速生长、产孢并在植物根系定殖,提高植物抵抗非生物和病原菌胁迫的能力,促进根系以及整个植株的生长发育[7]。另外,很多木霉菌也具有直接拮抗或抑制植物病原菌生长的功能。同时,由于木霉对人类、动物以及其他有益生物无不良影响,不会对自然环境产生威胁,也不会在食物链中积累,因此具有巨大的作为商业生防制剂的潜力[8]。
在木霉应用的过程中,生长速度、产孢量和产生的次级代谢产物都直接影响木霉的生防效率[9]。因此,在开发木霉生物制剂的过程中,必须考虑影响木霉生长和产孢的各种参数因素,如温度、pH值、溶氧量和培养基等[10]。这些因素影响孢子萌发、菌丝生长、产孢以及木霉次级代谢产物的产量和质量[11]。目前,木霉的发酵方式主要有2种:液体发酵和固体发酵。较固体发酵而言,液体发酵被广泛应用于木霉产孢、次级代谢产物以及多种水解酶的生产[12-13]。本研究将哈茨木霉菌株T-aloe在小麦上进行应用,分析其促进小麦生长和防治小麦赤霉病的潜能,并对T-aloe液体培养基发酵条件进行优化,以期为木霉T-aloe生防制剂开发和广泛应用奠定基础。
1 材料与方法
1.1 试验材料和培养基
供试木霉菌株:哈茨木霉(T. harzianum) T-aloe,由周口师范学院微生物实验室分离并保存,GenBank登录号为KC753766。禾谷镰刀菌 PH-1,由周口师范学院植物遗传与分子育种重点实验室罗奇博士提供。供试小麦品种为周麦36。
马铃薯葡萄糖培养基[14]:去皮马铃薯200 g/L,葡萄糖 20 g/L。绿豆培养基[20]:绿豆 60 g/L,煮沸过滤。葡萄糖发酵培养基[15]:葡萄糖20 g/L,KH2PO4 1.2 g/L,MgSO4·H2O 0.6 g/L,维生素B1 0.008 g/L。玉米粉-酵母膏培养基[16]:玉米粉1.01%,酵母膏0.47%,(NH4)2SO4 0.05%,K2HPO4 0.06%,MgSO4·7H2O 0.05%,pH值5.79。糖蜜-酵母膏培養基[17]:糖蜜20 g/L,酵母膏 5 g/L,FeSO4·7H2O 0.1 g/L,MgSO4·7H2O 1.25 g/L,KH2PO4 4.0 g/L,NaNO3 7 g/L。
1.2 菌株活化和菌液制备
菌株活化:将-80 ℃保藏的木霉T-aloe和病原菌PH-1取出,吸取0.1 mL,用涂布器分别涂布于PDA培养基中,28 ℃恒温培养7 d。木霉菌株 T-aloe 发酵液的制备:在平板上刮取少量已活化的木霉菌丝接种于含有PDA培养基中,28 ℃,180 r/min 摇床培养7 d。T-aloe种子液的制备:在超净工作台中,用4层无菌纱布将T-aloe发酵液进行过滤,过滤液即为种子液,将其放置4 ℃冰箱备用。病原菌PH-1孢子悬浮液的制备:在平板上刮取少量已活化的病原菌菌丝接种于绿豆培养基中,于28 ℃、220 r/min摇床上培养5 d。
1.3 木霉菌株T-aloe有益特性分析
1.3.1 哈茨木霉T-aloe与小麦病原禾谷镰刀菌PH-1对峙培养 25 mL PDA培养基倒入直径为90 mm的培养皿中,待凝固后,在PDA培养基的两边接种直径为8 mm的木霉T-aloe菌饼和病原菌PH-1的菌饼,以只接种8 mm PH-1的PDA平板为对照,每组3个重复,于28 ℃恒温培养7 d,每天观察并测量木霉和病原菌的生长半径并拍照记录,计算抑菌率。
1.3.2 哈茨木霉T-aloe对小麦幼苗的促生作用 将哈茨木霉T-aloe发酵液,稀释成孢子浓度为 1×107 CFU/mL的溶液。将小麦种子用45 ℃的温水浸泡 3 h,然后均匀播种在花盆中,每盆20粒,在25 ℃的温室中培养5 d后,用T-aloe发酵液灌根处理幼苗,同时对照用PDB处理,每盆30 mL。待 7 d 后测量小麦幼苗的株高、根长、根数、含水量以及小麦的叶绿素含量[18]。
1.3.3 哈茨木霉T-aloe诱导小麦抗病性生理指标的测定 试验共设4个处理:对照组(CK);病原菌组(F);哈茨木霉T-aloe组(T);哈茨木霉T-aloe加病原菌组(T+F)。挑选籽粒饱满的小麦种子,45 ℃水浴3 h,然后将小麦种子放置在方形小盒(7 cm×7 cm)中,待小麦幼苗长至10 cm后,分别用30 mL PDB和浓度为3.1×107 CFU/mL的T-aloe 发酵液灌根处理,处理2 d后对幼苗进行病麦粒接种,接种方法参照王路瑶的方法[21]。病麦粒接种的第4、6天,对小麦幼苗的抗性酶活性及受损伤程度进行检测,主要对POD活性、CAT活性、MDA含量和游离的脯氨酸含量进行测定,测定方法均采用李萍等的方法[19]。
1.3.4 哈茨木霉T-aloe对小麦大田赤霉病的防治效果 本试验于2022年4月在河南省周口市周口师范学院试验田(33°6′N,114°6′E)中进行,小区长10 m,宽 3 m,面积为30 m2。在小麦扬花初期,将清水、250 mg/L霉灵和1×107 CFU/mL哈茨木霉T-aloe发酵液分别等量均匀地喷洒在小麦麦穗部并套袋保湿,24 h后再喷洒病原菌PH-1(1×105 CFU/mL),PH-1连续喷3 d,频率为1次/d,每次喷洒完后立即套袋保湿。其中清水为空白对照,霉灵为阳性对照。每种处理3组重复,每个重复取25个麦穗,分别在病原菌处理后的第10、20天统计小麦麦穗的发病情况,病情分级标准、病情指数和防效计算公式参考王路遥的方法[20]。
1.4 哈茨木霉T-aloe发酵条件优化
主要对不同培养基、温度、接种量以及转速进行筛选。
培养基:分别用PDB培养基、葡萄糖发酵培养基、玉米粉-酵母膏培养基、糖蜜-酵母膏培养基作为培养基。从4 ℃冰箱取出T-aloe种子液,用血球计数板计数,最后用无菌水将T-aloe种子液稀释成浓度为 2×107 CFU/mL,按1%的接种量接种,每250 mL锥形瓶装液量为100 mL,28 ℃、180 r/min培养8 d,每隔24 h进行计数,每种培养基3个重复。
温度:设置25、28、31、34、37 ℃等5个温度梯度。
接种量:设置2%、5%、8%、12%、15%等5个接种量。
转速:设置120、150、180、210 r/min等4个转速梯度。
1.5 正交试验
前期试验已经筛选出哈茨木霉T-aloe产孢的最适培养基为糖蜜-酵母膏培养基,在培养基确定的条件下对温度、转速和接种量进行3因素3水平的正交试验,其中因素A为温度,因素B为接种量,因素C为转速,正交试验设计如表1所示。
1.6 哈茨木霉T-aloe产孢量测定
用XB-K-25型血球计数板在显微镜下进行计数。菌悬液用蒸馏水适当稀释后,4层纱布过滤,摇匀,取样,加入到血球计数板内,静置5 min,遵循“计上不计下,计左不计右”的原则,对计数池的左上、右上、左下、右下及中间进行计数。产孢量的计算公式如下:
1.7 数据分析
采用Microsoft Excel 2016进行数据分析和图表制作。采用SPSS 25.0进行单因素方差分析。
2 结果与分析
2.1 哈茨木霉T-aloe防治小麦赤霉病的潜能分析
2.1.1 哈茨木霉T-aloe抑制了小麦病原禾谷镰刀菌PH-1生长 哈茨木霉T-aloe与禾谷镰刀菌PH-1对峙培养结果如图1所示,培养后第7天,T-aloe 菌落已占据整个生存空间,覆盖了整个病原菌落,并产生了大量的绿色孢子,T-aloe 抑制了病原菌PH-1的生长,抑制率为72.38%;同时还发现,对峙培养时,T-aloe 影响病原菌的色素分泌,这可能是因为T-aloe降低了病原菌PH-1的毒性。
2.1.2 哈茨木霉T-aloe对小麦幼苗生长的促进作用 哈茨木霉T-aloe促进了小麦幼苗的生长。T-aloe处理小麦幼苗7 d后,小麦幼苗长势如图 2-a 所示,株高明显高于对照植株。另外,小麦幼苗叶部的含水量(图2-b)、株高(图2-e)以及根长(图2-d)均显著高于对照。与对照相比,叶部含水量提高1.01倍(图2-a),株高和根长分别增加16.7%和16.2%。根部含水量(图2-b)、叶绿素含量(图2-c)和根数(图2-e)与对照无明显差异。
2.1.3 哈茨木霉T-aloe诱导了小麦幼苗抗病性提高 接种病原菌第6天,研究了哈茨木霉T-aloe对小麦幼苗抗病性提高的诱導作用(图3)。接种病原菌第6天,T组的MDA含量与CK组无显著差异,而T+F组的MDA含量比CK+F组低34.26%(图3-a)。 说明小麦受到病原胁迫时, T-aloe 可以缓解膜脂过氧化造成的细胞损伤。脯氨酸是植物在逆境环境下产生的渗透调节物质。在病原菌处理的第6天,CK+F组比CK组的脯氨酸含量增加41.14%,T+F组、T组与CK组脯氨酸含量三者之间无明显差异,但与CK+F组之间均差异显著(P<0.05),其中T+F组脯氨酸含量比CK+F低25.71%(图3-b)。说明在病原胁迫条件下T-aloe可以降低脯氨酸的含量,由此推测T-aloe可以保护植物使其免受病原菌的侵害。植物在逆境环境下,会产生大量的活性氧(ROS),而POD和CAT可以清除ROS,降低ROS引起的细胞损伤,提高植物的防御性。在无病原菌胁迫条件下,T组POD活性相比于CK组上升26.89%,而T组CAT活性与CK组无明显差异。在病原菌胁迫条件下,T+F组POD和CAT活性分别比CK+F组上升28.17%和39.33%(图3-c、图3-d)。说明在病原菌胁迫条件下,T-aloe可以提高POD和CAT活性,清除过量的ROS,在提高小麦抗病性中起重要作用。综上所述,哈茨木霉T-aloe可以通过清除ROS,在病原胁迫下降低膜脂过氧化来提高小麦幼苗的抗病性。
2.1.4 哈茨木霉T-aloe对小麦赤霉病的田间防治效果 与阴性对照清水和阳性对照霉灵相比,哈茨木霉T-aloe处理明显减轻了小麦赤霉病的发生(表3、图4)。接种病原菌后第10、20天,T-aloe处理过的小麦病情指数均低于阳性对照霉灵组,且二者之间具有显著差异(P<0.05)。T-aloe 处理组的防效在接种病原菌后第10、20天分别为68.42%和32.65%,均高于霉灵组(分别为36.84%和17.35%),分别提高85.72%和88.18%。
2.2 哈茨木霉T-aloe发酵条件优化
2.2.1 不同培养基对哈茨木霉T-aloe产孢的影响
不同培养基对哈茨木霉T-aloe产孢的影响如图5所示。T-aloe在4种培养基中均能产生孢子,其中以糖蜜-酵母膏培养基的产孢量最大,其次是PDB培养基、玉米粉-酵母膏培养基和葡萄糖发酵培养基。不同的培养基培养时,T-aloe最大产孢量出现的时间不同,在PDB培养基中培养96 h时产孢量最大,为8.19×107 CFU/mL(图5-a),在糖蜜-酵母膏培养基中培养72 h时,产孢量最大,为 1.34×108 CFU/mL(圖5-d),而在葡萄糖发酵培养基和玉米粉-酵母膏培养基中培养24 h,产孢量最大,分别为9.67×104、3.83×106 CFU/mL(图5-b、图5-c),24 h后孢子数量呈下降趋势。显微镜观察发现部分孢子已经开始萌发产生菌丝,但是葡萄糖发酵培养基和玉米粉-酵母膏培养基却无法诱导菌丝产生孢子,所以在72 h后产孢量基本没有发生明显的变化。综合以上试验结果,以培养时间 72 h、PDB培养基为基准,T-aloe在糖蜜-酵母膏培养基中的产孢量比PDB培养基提高109.70%;T-aloe 在葡萄糖发酵培养基、玉米粉-酵母膏培养基中的产孢量分别比PDB降低99.91%、99.45%。因此,本试验选择糖蜜-酵母膏作为培养基进一步研究不同温度、接种量、转速对哈茨木霉T-aloe产孢的影响,并于72 h分别进行取样。
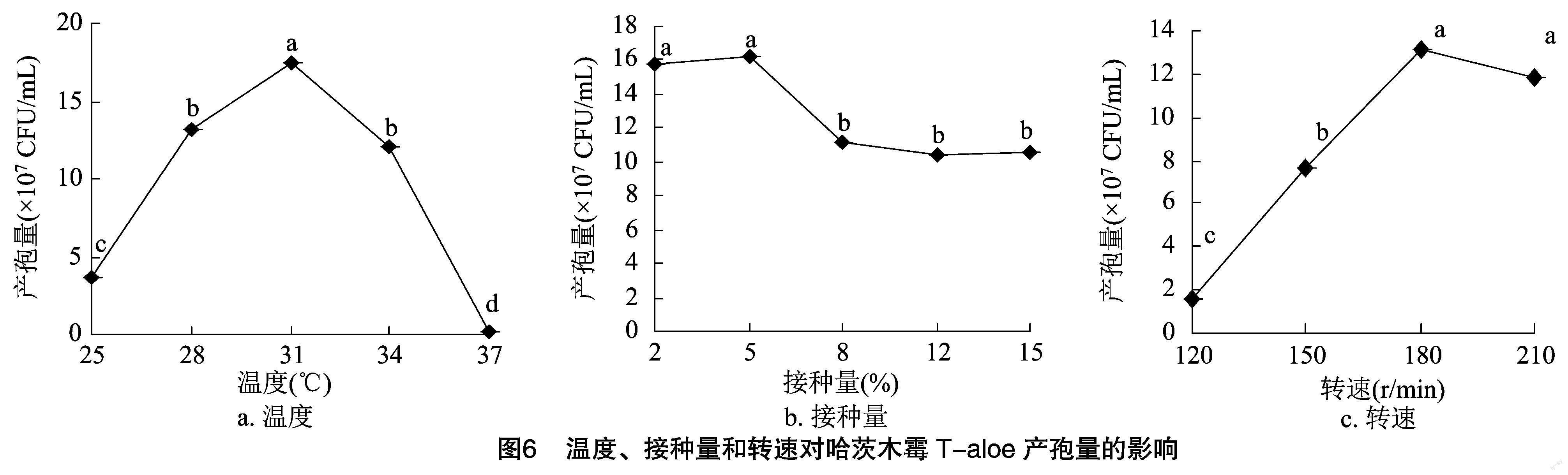
2.2.2 温度、接种量和转速对哈茨木霉T-aloe产孢的影响 在糖蜜-酵母膏培养基中,不同温度对哈茨木霉T-aloe产孢量的影响如图6-a所示。T-aloe 在不同温度下均可生长,其产孢量随着温度的升高呈现先增加后降低的趋势。其中,31 ℃时,T-aloe 的产孢量最大,可达1.747×108 CFU/mL。在糖蜜-酵母膏培养基中,不同接种量对哈茨木霉T-aloe产孢的结果如图6-b所示,接种量对T-aloe的产孢量有显著影响(P<0.05)。当接种量为5%时,T-aloe的产孢量最高,可达1.623×108 CFU/mL。在糖蜜-酵母膏培养基中,不同转速对哈茨木霉T-aloe产孢量仍具有显著性影响(P<0.05)(图6-c),随着转速的增加,T-aloe的产孢量呈现先增加后降低的趋势。当转速为180 r/min时,T-aloe的产孢量最高,可达1.32×108 CFU/mL。总之,培养温度31 ℃、接种量5%、转速180 r/min是哈茨木霉发酵培养产孢的较优条件。
2.3 正交试验优化各因素对哈茨木霉T-aloe发酵产孢的影响
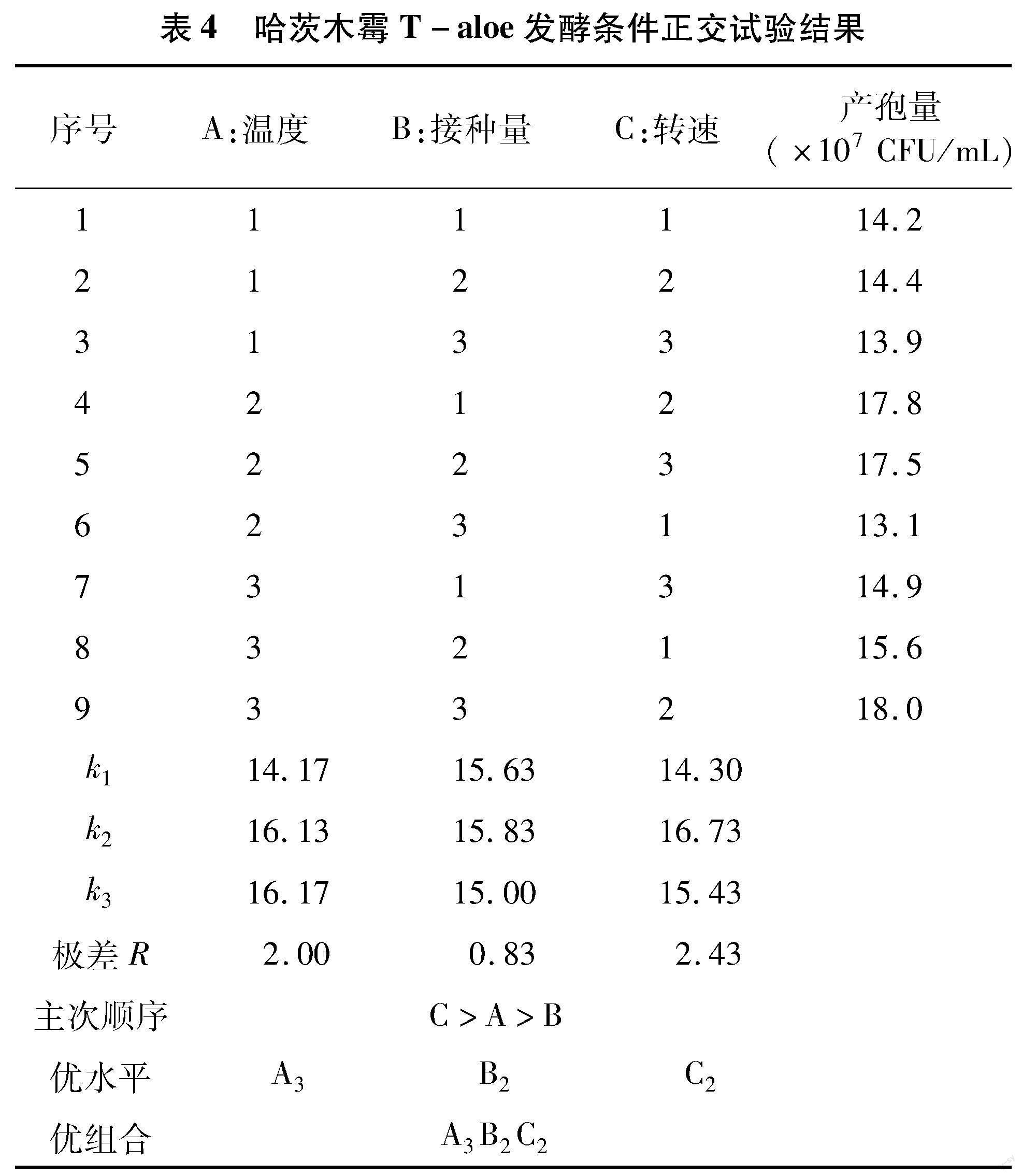
由单因素试验结果可知,温度、接种量、转速对哈茨木霉T-aloe的产孢量均具有显著性影响,为筛选出T-aloe发酵的最佳培养条件,对温度、接种量、转速进行3因素3水平的正交试验(表2)。正交试验结果如表4所示,由极差R的大小可知,温度、接种量、转速对T-aloe产孢量的影响从大到小依次为转速>温度>接种量,即C>A>B,3个因素的最佳组合为A3B2C2,由此得到T-aloe最佳培养条件为:温度32 ℃、接种量5%、转速180 r/min。在此条件下培养哈茨木霉 T-aloe,产孢量达到1.82×108 CFU/mL,比糖蜜-酵母膏培养基(培养72 h、温度28 ℃、接种量1%、转速180 r/min)产孢量提高35.82%;比PDB培养基(培养72 h、温度28 ℃、接种量1%、转速 180 r/min)产孢量提高184.99%。
3 结论与讨论
木霉是重要的植物生防菌之一,它可以通过竞争、重寄生和分泌抗生性的次级代谢产物来拮抗多种植物病原菌[21]。竞争作用是木霉的一种重要的拮抗机制,木霉在与病原微生物的对峙过程中,可以迅速生长产孢占领营养和生存空间[22]。本研究发现哈茨木霉T-aloe可以通过迅速占领空间的竞争作用来抑制小麦赤霉病菌禾谷镰刀菌PH-1的生长,抑菌率可达72.38%(图1)。
另外,木霉可以和植物建立共生关系,定殖在植物根系表皮细胞,刺激植物激素和防御化合物的产生,进而促进多种农作物的生长,如大豆、小麦、番茄和萝卜等[23]。Joshi等发现,哈茨木霉可以提高辣椒和黄瓜幼苗的生长,株高、叶面积、植株干质量以及叶绿素含量均有所提高[24]。本研究中哈茨木霉T-aloe提高了小麦幼苗的株高、根长及叶片含水量(图2),说明T-aloe可以促进小麦幼苗生长。
禾谷镰刀菌引起的小麦赤霉病是我国重要的小麦流行性病害之一[25]。在病原菌胁迫条件下,木霉可以降低病原菌的侵染能力,提高植物的防御酶活性,进而提高植物的抗病能力[26]。植物在受到病原侵害时,会产生大量的O-2·和H2O2等活性氧(ROS)来抵御和杀死病原菌,但是过量的ROS会引发细胞的膜脂过氧化,加重植物的受损伤程度[27]。其中,MDA含量是反映细胞膜脂过氧化和细胞损伤程度的重要指标,植物受损伤程度越大,MDA含量就越高[28]。除此之外,脯氨酸的积累量也可以反映植物的受胁迫程度,脯氨酸作为主要的渗透调节物质,既可以降低细胞的酸性,也可以调节细胞的内渗透,在植物逆境胁迫下起着关键作用[29]。研究发现,在病原菌胁迫条件下,脯氨酸含量会升高。当施加木霉后,木霉调控脯氨酸的方式有2种。第1种是木霉先增加脯氨酸的含量,通过脯氨酸来调节细胞的内渗透,降低细胞的损伤[30];第2种是木霉可以直接降低病原菌对植物的胁迫,从而使脯氨酸含量降低[31]。如王欣玉等的研究表明,在拟南芥中,单独用病原菌处理的脯氨酸含量高于木霉和病原菌共同处理的脯氨酸含量[31],本研究结果与之一致,推测哈茨木霉T-aloe可能是通过第2种方式来调控小麦幼苗内的脯氨酸含量。一些抗氧化防御酶也可以清除植物体内的O-2·和H2O2,维持氧化自由基的平衡,减轻植物的病害程度,比如过氧化物酶(POD)和过氧化氢酶(CAT)[32]。POD和CAT可以清除植物体内过量的H2O2,将H2O2转化为H2O和O2,避免细胞受到侵害[33]。本研究表明,在病原菌PH-1的胁迫下,小麦细胞膜的受损伤程度增强,幼苗内的MDA含量以及脯氨酸含量升高,随着病原菌胁迫时间的延长,POD和CAT活性下降,推测可能是防御酶系统遭到破坏。而先用木霉处理过的小麦,其MDA含量以及脯氨酸含量降低,POD和CAT活性升高(图3),说明哈茨木霉T-aloe可以降低小麦细胞的膜脂过氧化,提高小麦的防御酶活性,清除过量的ROS,阻止病原菌侵害小麦幼苗,从而提高小麦的抗病能力。在本研究中,病原菌PH-1侵染的第10、20天,大田防治效果分别为68.42%、32.65%,均高于阳性对照。说明哈茨木霉T-aloe对田间小麦赤霉病的防治有明显的作用(图4和表3)。
哈茨木霉T-aloe作為一株既促生又抗病的优势菌株,具有开发成商业生物菌剂的巨大潜力。为了降低生物菌剂的生产和运输成本,研究T-aloe的液体发酵产孢条件是很有必要的。在实际应用中,木霉的孢子必须达到一定的数量,才会在竞争中发挥优势[34]。本研究分析了培养基、温度、接种量和转速4个因素对T-aloe产孢的影响。液体发酵时,糖蜜、酵母膏以及其他农用废弃原料常作为木霉发酵的原料。Lewis等发现,用发酵罐发酵木霉时,以糖蜜和酵母粉为培养基可以提高产孢量[35]。本研究发现,T-aloe产孢量最大的培养基是糖蜜-酵母膏培养基,与Lewis的研究结果[35]一致。温度也是木霉生长繁殖的重要因素之一,木霉生长的最适温度是20~28 ℃。温度过高会破坏木霉胞内的酶活性,抑制木霉生长,还会使木霉中的蛋白质降解或变性,严重时导致木霉死亡,而温度过低也会抑制木霉的生长[36]。由于木霉属菌株种类较多,不同种生长的最适温度也不尽相同。尤佳琪等发现,拟康宁木霉T-51在PDA培养基上的最大产孢温度是20 ℃,而本研究中T-aloe的最大产孢温度是31 ℃。接种量也是木霉发酵过程中的重要参数[37],若接种量过大,培养基的消耗加快,造成木霉菌的营养缺乏,菌体快速进入稳定期和衰亡期,不利于发酵产物的生成;若接种量过低,则会延长菌体到达对数生长期的时间,延长发酵周期,不利于酶产物的生成[38]。洪亮等从枇杷中分离出1株内生木霉P3.9,它在液体发酵过程中的最适接种量是1.5%,而本研究中T-aloe的最适接种量为5%。溶解氧是优化次级代谢产物的重要参数,在产孢过程中起着关键作用[39-40]。Felse等发现,通过搅拌增加的溶氧量可以影响木霉的生长,并推断极端搅拌条件不利于木霉菌的产孢[41]。T-aloe发酵产孢的最适转速是180 r/min。目前,木霉的液体发酵常用于发酵各种酶及其次级代谢产物,对液体产孢条件优化的报道甚少,本研究将为木霉液体发酵产孢提供有用的实践经验。
参考文献:
[1]朱展望. 利用全基因组连锁分析和关联分析定位小麦赤霉病抗性基因及分子标记开发[D]. 北京:中国农业科学院,2020:1-2.
[2]Dweba C C,Figlan S,Shimelis H A,et al. Fusarium head blight of wheat:pathogenesis and control strategies[J]. Crop Protection,2017,91(2017):114-122.
[3]苏培森. 小麦赤霉病抗病机制研究进展[J]. 生物技术进展,2021,11(5):599-609.
[4]张承启. 新型杀菌剂氰烯菌酯对禾谷镰刀菌的作用机制研究[D]. 杭州:浙江大学,2016:3-4.
[5]李梦婷. 小麦赤霉病菌对丙硫菌唑的抗药性评价[D]. 合肥:安徽农业大学,2021:14-15.
[6]Sood M,Kapoor D,Kumar V,et al. Trichoderma:the “secrets” of a multitalented biocontrol agent[J]. Plants,2020,9(6):762-786.
[7]Sharon E,Chet I,Spiegel Y. Biological control of plant-parasitic nematodes:building coherence between microbial ecology and molecular mechanisms[M]. Heidelberg:Springer Science & Business Media,2011,183-201.
[8]Saba H,Vibhash D,Manisha M,et al. Trichoderma—a promising plant growth stimulator and biocontrol agent[J]. Mycosphere,2012,3(4):524-531.
[9]孙 虎,杨丽荣,全 鑫,等. 木霉生防机制及应用的研究进展[J]. 中国农学通报,2011,27(3):242-246.
[10]Zehra A,Dubey M K,Meena M,et al. Effect of different environmental conditions on growth and sporulation of some Trichoderma species[J]. Journal of Environmental Biology,2017,38(2):197-203.
[11]Shahid M,Singh A,Srivastava M,et al. Effect of temperature,pH and media for growth and sporulation of Trichoderma longibrachiatum and self life study in carrier based formulations[J]. Annals of Plant Protection Science,2011,19(1):147-149.
[12]隋永辉. 绿色木霉孢子的高密度发酵及其对植物生长的调控研究[D]. 济南:齐鲁工业大学,2021:9-10.
[13]池玉杰,伊洪伟,吉海龙. 长枝木霉菌株T05液态发酵产孢和菌丝生物量条件的筛选[J]. 东北林业大学学报,2016,44(1):110-113.
[14]陈建爱,贾梦莹,陈为京. PDA中水含量对固体培养黄绿木霉T1010分生孢子生长发育的影响[J]. 中国农学通报,2020,36(15):106-114.
[15]魏洪璇,陳向东,汪 辉,等. 哈茨木霉的分离纯化、鉴定及发酵液活性的初步研究[J]. 药物生物技术,2017,24(3):206-210.
[16]粟 静,罗志威,吕 黎,等. 哈茨木霉液体发酵产厚垣孢子条件的优化[J]. 山西农业科学,2014,42(2):169-173.
[17]刘 梅,乔 敏,徐 同,等. 哈茨木霉液体发酵工艺研究[J]. 云南农业大学学报,2000,15(3):279-281.
[18]何启平,陈 莹. 校园常见植物叶绿素提取方法比较及其含量测定[J]. 黑龙江农业科学,2015,2015(10):117-120.
[19]刘 萍,李明军. 植物生理学实验技术[M]. 北京:科学出版,2007:144-146.
[20]王路遥. 小麦禾谷镰孢病害的生物防治及其机理研究[D]. 南京:南京农业大学,2018:69-70.
[21]Chen J L,Sun S Z,Miao C P,et al. Endophytic Trichoderma gamsii YIM PH30019:a promising biocontrol agent with hyperosmolar,mycoparasitism,and antagonistic activities of induced volatile organic compounds on root-rot pathogenic fungi of Panax notoginseng[J]. Journal of Ginseng Research,2016,40(4):315-324.
[22]徐 文. 木霉-黄瓜互作过程中抗病信号传递途径分析[D]. 天津:河北工业大学,2017:2-3.
[23]Stewart A,Hill R. Biotechnology and biology of Trichoderma[M]. Amsterdam:Elsevier,2014:415-428.
[24]Joshi B B,Bhatt R P,Bahukhandi D. Antagonistic and plant growth activity of Trichoderma isolates of Western Himalayas[J]. Journal of Environmental Biology,2010,31(6):921-928.
[25]Goswami R S,Kistler H C. Heading for disaster:Fusarium graminearum on cereal crops[J]. Molecular Plant Pathology,2004,5(6):515-525.
[26]廉 华,陈玉蓉,李 梅,等. 木霉分生孢子和厚垣孢子对黄瓜幼苗生理特性及枯萎病防效的影响[J]. 干旱地区农业研究,2021,39(2):227-235.
[27]王光涛,冯素伟,丁位华,等. 根际pH值对冬小麦叶片抗氧化酶活性和内源激素含量的影响[J]. 江苏农业科学,2021,49(10):71-75.
[28]谢琳淼. 哈茨木霉对镉胁迫下两种草坪草生长及生理特性的影响[D]. 哈尔滨:东北林业大学,2018:2-3.
[29]张 净,王锦霞,郭萌萌,等.甜菜幼苗对干旱胁迫的适应机制[J]. 中国农学通报,2020,36(32):1-7.
[30]马光恕,张 渟,李润哲,等.拟康氏木霉菌剂对黄瓜幼苗生长、抗氧化系统及枯萎病防效的影响[J]. 干旱地区农业研究,2022,40(6):72-81,107.[HJ2mm]
[31]王欣玉. 生防木霉对拟南芥的抗病及促生机理研究[D]. 哈尔滨:东北林业大学,2018:29-33.
[32]Cheng C,Zhang Y,Zhong Y,et al. Gene expression changes in leaves of Citrus sinensis (L.) Osbeck infected by Citrus tristeza virus[J]. The Journal of Horticultural Science and Biotechnology,2016,91(5):466-475.
[33]吴雨涵,刘文辉,刘凯强,等. 干旱胁迫对燕麦幼苗叶片光合特性及活性氧清除系统的影响[J]. 草业学报,2022,31(10):75-86.
[34]Zhang J D,Yang Q. Optimization of solid-state fermentation conditions for Trichoderma harzianum using an orthogonal test[J]. Genetics Molecular Research,2015,14(1):1771-1781.
[35]Lewis J A,Papavizas G C. Production of chlamydospores and conidia by Trichoderma spp. in liquid and solid growth media[J]. Soil Biology and Biochemistry,1983,15(3):351-357.
[36]蒲丹丹,李 艳,赵丽红,等. 简青霉CEF-818固体发酵工艺优化[J]. 中国生物防治学报,2022,38(3):636-644.
[37]尤佳琪,杜 然,顾卫红,等. 拟康宁木霉T-51菌株生物学特性及其生物防治潜力[J]. 植物保护学报,2022,49(3):946-955.
[38]张文芝,郭坚华. 微生物发酵工艺优化研究进展[J]. 广东农业科学,2013,40(6):114-117.
[39]洪 亮,胡金碧,鲁海菊,等. 枇杷内生木霉P3.9菌株液体发酵条件优化筛选[J]. 湖北农业科学,2017,56(14):2670-2674.
[40]Verma M,Brar S K,Tyagi R D,et al. Antagonistic fungi,Trichoderma spp.:panoply of biological control[J]. Biochemical Engineering Journal,2007,37(1):1-20.
[41]Felse P A,Panda T. Submerged culture production of chitinase by Trichoderma harzianum in stirred tank bioreactors-the influence of agitator speed[J]. Biochemical Engineering Journal,2000,4(2):115-120.

