马勃油膏对兔大肠杆菌感染性创面NLRP3/Caspase-1炎症通路及炎症因子表达的影响*
杨爱龙,韩雪,于波,阚成国,喻少雷
(1.黑龙江中医药大学,黑龙江 哈尔滨 150000;2.黑龙江中医药大学附属第二医院,黑龙江 哈尔滨 150000;3.哈尔滨医科大学附属第四医院,黑龙江 哈尔滨 150000)
中医学认为创面愈合是一个“正邪相争,腐去肌生,煨脓长肉”的过程[1-2]。近年来诸多学者在研究应用外用中药促进创面愈合方面作了许多工作,尤其是在感染性创面愈合方面进行了大量研究。中医药在促进创面愈合方面疗效确切[3-4]。创面感染常见致病菌主要为金黄色葡萄球菌及大肠杆菌,其中大肠杆菌感染多与腹腔消化道相关,研究相对较少,但其对肛肠疾病术后创面的愈合意义重大[5]。马勃属真菌类中药,最早载于《名医别录》。马勃味辛,性平,具有清肺利咽、止血等功效,外用治疗创伤出血、恶疮效果较佳。研究证实,马勃药材对于大肠杆菌具有明确的抑制作用[6]。马勃具有明显的抗炎、抑菌、止血、抗氧化、促进创面愈合等药理活性[7],临床常用于压疮、褥疮、冻疮、糖尿病坏疽等难治性创面的修复[8]。基于此,黑龙江中医药大学附属第二医院将其制成油膏剂,用于肛肠病术后感染性创面的外敷治疗,效果显著。为进一步验证其疗效并探讨其抗炎、抑菌的作用机制,故本实验基于NLRP3/Caspase-1炎症通路探讨马勃油膏对兔大肠杆菌感染性创面愈合情况及炎症因子表达的影响。
1 材料与方法
1.1 药物与试剂 马勃药材(安徽普仁中药饮片有限公司,批号:2020142),由王爽主任药师鉴定药材为正品;紫草生肌搽剂(黑龙江中医药大学附属第二医院院内制剂,批准文号:黑药制字Z20110185)。IL-1β ELISA检测试剂盒(批号:WL210530)、TNF-α ELISA检测试剂盒(批号:WL201104)、HE染色试剂盒(批号:WL200428)均购自沈阳万类生物科技有限公司;组织裂解液(批号:202004311)、ECL化学发光检测试剂盒(批号:20210307)均购自上海翌圣生物科技股份有限公司;BCA总蛋白定量测定试剂盒(批号:20200972)购自南京建成生物工程研究所;兔抗NLRP3 抗体(批号:ab205084)、兔抗Caspase-1抗体(批号:ab205316)、HRP标记的山羊抗兔IgG二抗(批号:ab210372)均购自英国Abcam公司。
1.2 实验仪器 XDW-6J型中药超微粉碎机(济南达微机械有限公司);BKQ-Z501型高压蒸汽灭菌器(山东博科消毒设备有限公司);Labtrip RZ-40型离心机(南京贝登医疗股份有限公司);Stuart SHM2型组织匀浆器(英国Bibby-Stuart公司);DH36001型电热恒温培养箱(天津泰斯特公司);BX53型显微镜(日本OLUMPUS公司);RM2235型石蜡切片机(德国Leica公司);Multiskan FC型其酶标仪(美国BIOTEK公司);SDS-PAGE凝胶电泳仪(美国Bio-rad公司);NW10LVF型超纯水系统(香港healforce公司)。
1.3 实验动物 新西兰大白兔24只,实验动物使用许可证号:SYXK(黑)2018-003,实验动物生产许可证号:SCXK-(黑)2019-0011。6个月龄,雌雄各半,体质量为(2.50±0.25)kg,由黑龙江中医药大学实验动物中心提供。饲养条件:单笼喂养,温度为18~22 ℃,湿度为40%~70%,每12 h昼夜交替循环,自由饮水、摄食。本研究经黑龙江中医药大学实验动物伦理委员会审批通过,伦理批号:20170514-23。
1.4 马勃油膏的制备 取马勃药材适量,以中药超微粉碎机粉碎成约为300目的马勃超微粉,将凡士林隔水加热融化后倒入无菌空玻璃瓶中,在60 ℃加热状态下,少量多次加入马勃超微粉,并用搅拌匙充分搅拌,至全部药粉与凡士林油充分融合,即得马勃油膏(马勃超微粉与凡士林的质量比为1∶5),热压灭菌(115 ℃,67 kPA)30 min后进行后续研究。
1.5 感染性创面模型制备与分组 将24只兔随机分为空白对照组、模型组、马勃油膏组和紫草生肌搽剂组,每组6只。大各组给予10%水合氯醛腹腔注射麻醉,剃净兔背部毛,面积大约20 cm×15 cm,碘伏常规消毒,在距兔脊柱旁开2 cm处,用直径1.5 cm打孔器切割圆形创面3个,深达皮下深筋膜,伤口厚度约0.3 cm,压迫充分止血。空白对照组创面涂1 mL生理盐水,其余3组在创面涂配制好的大肠杆菌PBS溶液(1×109CFU/mL)1 mL,以凡士林敷料、胶带固定预防创面干燥,实验动物自由饮水、摄食,48 h后去除覆盖物,观察见疮缘周围红肿,表面脓苔附着,红外线测温仪测试局部温度明显升高,则为造模成功[9]。
1.6 给药方法 各组兔自造模成功后第2天开始用药,马勃油膏组兔每日换药时先用生理盐水清洗创面,再以马勃油膏1 mL外敷,用敷料包扎固定,每日换药1次;紫草生肌搽剂组兔每日先用生理盐水清洗创面,再以浸润紫草生肌搽剂的纱条1块外敷,用相同敷料包扎固定,每日换药1次;空白对照组和模型组兔每日仅用生理盐水清洗创面1次,用相同敷料包扎固定,每日换药1次。连续给药14 d。
1.7 观察指标
1.7.1 创面形态 每日换药时观察兔的创面大小、颜色、有无渗出、有无红肿及结痂、出血情况。
1.7.2 创面愈合率 分别于造模后第3、7、14天使用涤纶投影膜描出创面形态并裁剪创面纸,创面纸用电子分析天平称量,计算创面愈合率。创面愈合率(%)=[(原始创面纸片质量-愈合创面纸片质量)/原始创面纸片质量]×100%。
1.7.3 创面组织病理变化 于造模后第3、7、14天分别切取兔创面组织,经包埋切片、脱蜡至水、苏木素染色、盐酸酒精分化、自来水返蓝、伊红染色、梯度酒精脱水、透明、封片等步骤处理后,置显微镜下观察各组兔创面组织的病理形态变化。
1.7.4 创面组织中的白介素-1β(IL-1β)、肿瘤坏死因子-α(TNF-α)含量 造模后第3、7、14天,在1%利多卡因局部麻醉后,在无菌条件下沿兔每个创面外缘约0.1 cm处切下少量创面组织,精密称量后剪碎,放入5 mL小烧杯内,加入预冷的0.9%氯化钠溶液适量,以组织匀浆器匀浆后,3 000 r/min离心10 min,取上层匀浆液,采用ELISA法测定创面组织匀浆液中IL-1β、TNF-α含量,参照ELISA试剂盒说明书严格操作。
1.7.5 创面组织中NLRP3、Caspase-1蛋白表达 采用Western blotting检测创面组织中NLRP3、Caspase-1蛋白表达。造模后第3、7、14天分别切取兔创面组织,以PBS溶液清洗干净,剪碎,加入足量新鲜配制的组织裂解液,4 ℃下匀浆30 min使组织充分裂解,4 000 r/min离心15 min,取上清液,BCA试剂盒测定总蛋白浓度。SDS-PAGE凝胶电泳分离蛋白,湿法转至PVDF膜,5%脱脂牛奶室温封闭2 h,TBST洗涤1次×10 min,滴加稀释的NLRP3、Caspase-1一抗(1∶500),4 ℃过夜,TBST洗涤3次,10 min/次,滴加HRP标记的二抗(1∶1 000),室温孵育1 h,TBST洗涤3次,10 min/次,ECL显色、曝光、定影,采用Image J凝胶成像分析软件分析胶片,以NLRP3、Caspase-1蛋白与内参GAPDH的光密度比值表示蛋白的相对表达量。
1.8 统计学方法 应用SPSS 26.0统计软件进行数据分析,计量资料符合正态分布且方差齐,以“均数±标准差”(±s)表多组比较,采用单因素方差分析,两两比较采用LSD-t检验。重复测量计量资料采用重复测量方差分析。P<0.05为差异有统计学意义。
2 结 果
2.1 创面观察 各组兔的精神状态尚可、进食情况正常、无死亡。空白对照组兔创面红肿较轻,随时间消退最快,渗血、渗液较少,肉芽组织生长旺盛,创面结痂、愈合速度最快;模型组兔创面红肿明显,随时间消退缓慢,渗血、渗液较多,后期可见明显化脓,肉芽组织生长缓慢,创面未见结痂,愈合速度最慢;马勃油膏组和紫草生肌搽剂组兔创面红肿较轻,随时间消退较快,渗血、渗液较少,未见化脓,肉芽组织生长旺盛,创面结痂、愈合的速度较快。(见表1)

表1 各组兔创面的一般情况
2.2 各组兔创面愈合率比较 所有兔创面愈合率在不同时间点比较,差异有统计学意义(P<0.05),即存在时间效应,4组均如此;4组兔创面愈合率均呈逐渐升高趋势(P<0.05)。4组兔创面愈合率总体比较,差异有统计学意义(P<0.05),即存在分组效应;在第3、7、14天,模型组、马勃油膏组和紫草生肌搽剂组兔创面愈合率均明显低于空白对照组(P<0.05);马勃油膏组和紫草生肌搽剂组兔创面愈合率均明显高于模型组(P<0.05);马勃油膏组兔创面愈合率与紫草生肌搽剂组比较,差异无统计学意义(P>0.05)。时间因素与分组因素存在交互效应(P<0.05),各组兔的创面愈合率均随时间延长呈现增高趋势。(见表2、图1)
表2 各组兔创面愈合率比较(±s,%)
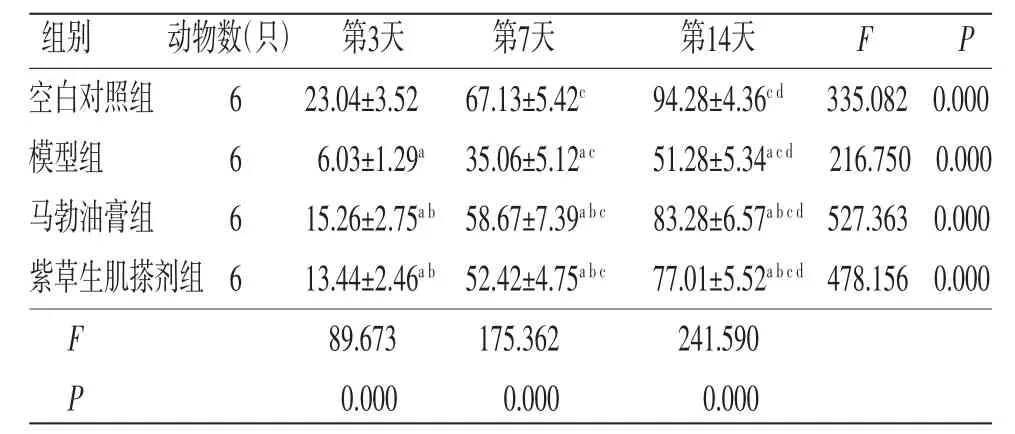
表2 各组兔创面愈合率比较(±s,%)
注:F时间主效应=10.387,P时间主效应=0.000;F分组主效应=225.176,P分组主效应=0.000;F交互效应=106.547,P交互效应=0.000;与空白对照组比较,aP<0.05;与模型组比较,bP<0.05;与第3天比较,cP<0.05;与第7天比较,dP<0.05

图1 创面愈合率交互效应轮廓图
2.3 各组兔创面组织病理学突发情况 HE染色结果显示:造模后第3天,空白对照组可见新生表皮及少量肉芽组织生长,皮下组织炎症细胞浸润较少;其余各组皮下组织均可见大量炎症细胞浸润,新生表皮及肉芽组织均不明显。造模后第7天,空白对照组可见创面新生表皮增厚及少量增生,皮下炎症细胞浸润较之前减少,创面内可见大量新生肉芽组织、纤维细胞及小血管规则排列;模型组皮下组织仍可见大量炎症细胞浸润,少量肉芽组织生成并伴小脓肿;马勃油膏组和紫草生肌搽剂组均可见表皮增厚及增生,皮下炎症细胞明显减少,肉芽组织及毛细血管生长明显,创面表面可见少量炎性渗出物。造模后第14天,空白对照组表皮基本接近正常上皮,皮下纤维细胞及小血管排列整齐;模型组皮下炎症细胞增多,表皮脓肿及渗出较之前更明显;马勃油膏组和紫草生肌搽剂组创面新生表皮较正常稍厚,皮下炎症细胞较少见,粗大纤维细胞增多。可见,随着时间的延长,模型组创面的炎症细胞浸润程度逐渐严重,其余各组均明显减轻。(见图2)

图2 各组兔创面组织HE 染色图(200×)
2.4 各组兔创面组织中IL-1β、TNF-α含量比较 所有兔创面组织中IL-1β、TNF-α含量在不同时间点比较,差异均有统计学意义(P<0.05),即存在时间效应,4组均如此;模型组兔创面组织中IL-1β、TNF-α含量呈逐渐升高趋势(P<0.05),其余3组兔创面组织中IL-1β、TNF-α含量呈先升高再降低趋势(P<0.05)。4组兔创面组织中IL-1β、TNF-α含量总体比较,差异有统计学意义(P<0.05),即存在分组效应;在第3、7、14天,模型组、马勃油膏组和紫草生肌搽剂组兔创面组织中IL-1β、TNF-α含量均明显高于空白对照组(P<0.05);马勃油膏组和紫草生肌搽剂组兔创面组织中IL-1β、TNF-α含量均明显低于模型组(P<0.05);马勃油膏组兔创面组织中IL-1β、TNF-α含量与紫草生肌搽剂组比较,差异无统计学意义(P>0.05)。时间因素与分组因素存在交互效应(P<0.05)。(见表3~4、图3~4)
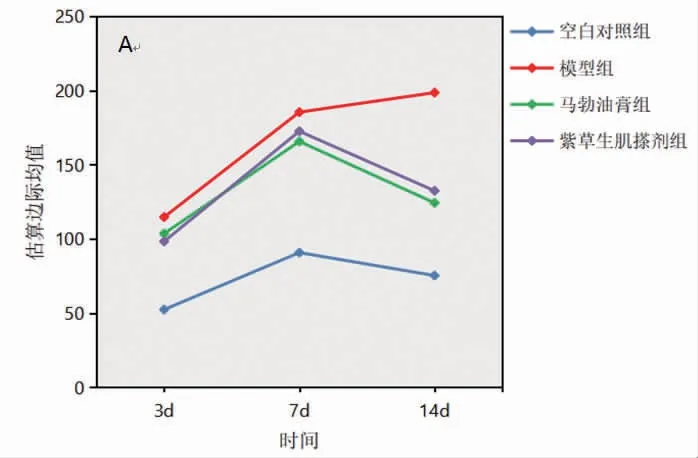
图3 创面组织中IL-1β 含量交互效应轮廓图
表3 各组兔创面组织中IL-1β 含量的比较(±s,ng/L)
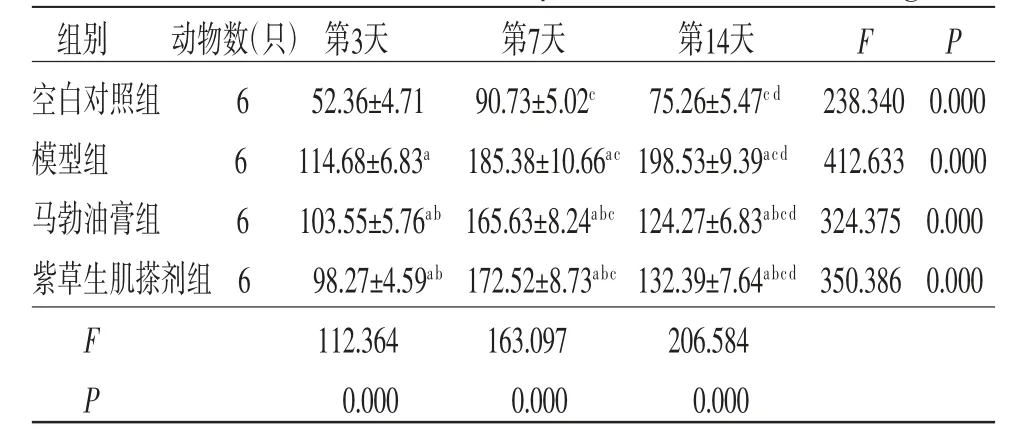
表3 各组兔创面组织中IL-1β 含量的比较(±s,ng/L)
注:F时间主效应=44.083,P时间主效应=0.000;F分组主效应=365.407,P分组主效应=0.000;F交互效应=267.152,P交互效应=0.000;与空白对照组比较,aP<0.05;与模型组比较,bP<0.05;与第3天比较,cP<0.05;与第7天比较,dP<0.05
表4 各组兔创面组织中TNF-α 含量的比较(±s,ng/L)
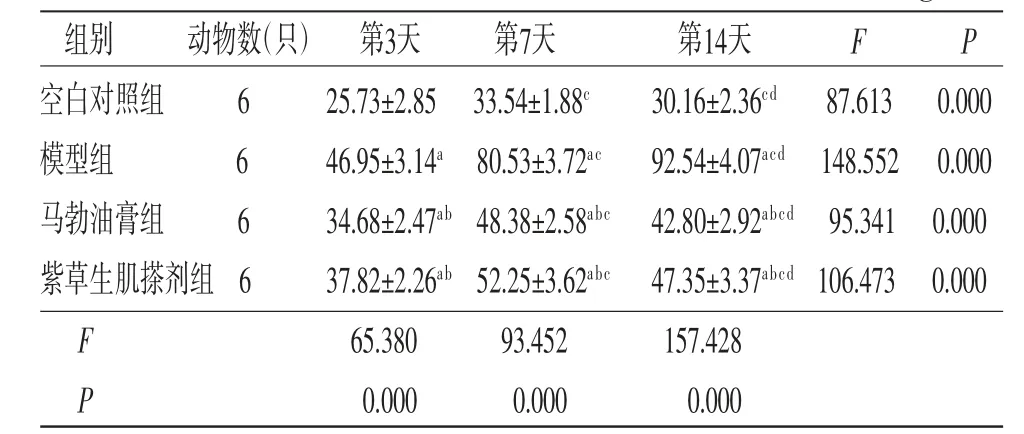
表4 各组兔创面组织中TNF-α 含量的比较(±s,ng/L)
注:F时间主效应=23.076,P时间主效应=0.000;F分组主效应=189.722,P分组主效应=0.000;F交互效应=125.301,P交互效应=0.000;与空白对照组比较,aP<0.05;与模型组比较,bP<0.05;与第3天比较,cP<0.05;与第7天比较,dP<0.05

图4 创面组织中TNF-α 含量交互效应轮廓图
2.5 各组兔创面组织中NLRP3、Caspase-1 蛋白表达比较 所有兔创面组织中NLRP3、Caspase-1蛋白表达在不同时间点比较,差异均有统计学意义(P<0.05),即存在时间效应,4组均如此;模型组兔创面组织中NLRP3、Caspase-1蛋白表达呈逐渐升高趋势(P<0.05),其余3组兔创面组织中NLRP3、Caspase-1蛋白表达呈逐渐降低趋势(P<0.05)。4组兔创面组织中NLRP3、Caspase-1蛋白表达总体比较,差异有统计学意义(P<0.05),即存在分组效应;在第3、7、14天,模型组、马勃油膏组和紫草生肌搽剂组兔创面组织中NLRP3、Caspase-1蛋白表达均明显高于空白对照组(P<0.05);马勃油膏组和紫草生肌搽剂组兔创面组织中NLRP3、Caspase-1蛋白表达均明显低于模型组(P<0.05);马勃油膏组兔创面组织中NLRP3、Caspase-1蛋白表达与紫草生肌搽剂组比较,差异无统计学意义(P>0.05)。时间因素与分组因素存在交互效应(P<0.05)。(见表5~6、图5~7)
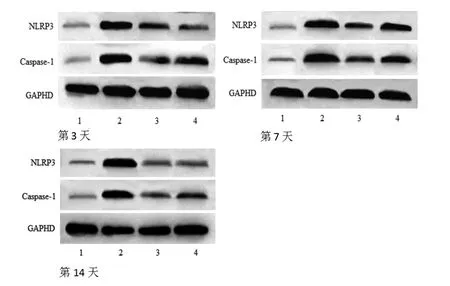
图5 各组兔创面组织中NLRP3、Caspase-1 蛋白表达Western blotting图
表5 各组兔创面组织中NLRP3 蛋白表达比较(±s)

表5 各组兔创面组织中NLRP3 蛋白表达比较(±s)
注:F时间主效应=32.405,P时间主效应=0.000;F分组主效应=283.152,P分组主效应=0.000;F交互效应=185.076,P交互效应=0.000;与空白对照组比较,aP<0.05;与模型组比较,bP<0.05;与第3天比较,cP<0.05;与第7天比较,dP<0.05

图6 创面组织中NLRP3 蛋白表达交互效应轮廓图
表6 各组创面组织中Caspase-1 蛋白表达比较(±s)

表6 各组创面组织中Caspase-1 蛋白表达比较(±s)
注:F时间主效应=37.102,P时间主效应=0.000;F分组主效应=266.052,P分组主效应=0.000;F交互效应=153.471,P交互效应=0.000;与空白对照组比较,aP<0.05;与模型组比较,bP<0.05;与第3天比较,cP<0.05;与第7天比较,dP<0.05
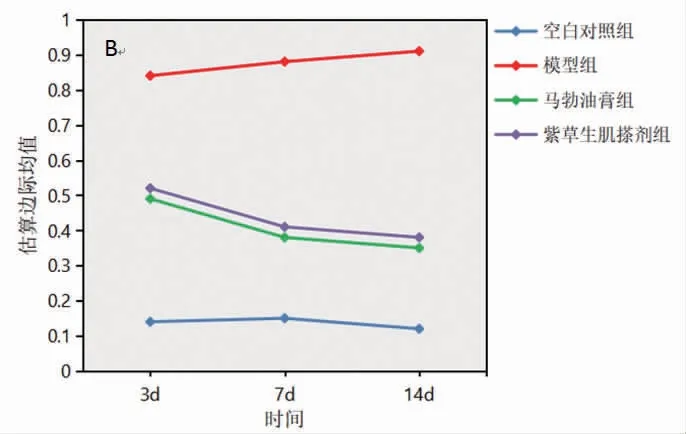
图7 创面组织中Caspase-1 蛋白表达交互效应轮廓图
3 讨 论
肛门直肠疾病在临床上多以手术为主要治疗方式,切口一般为开放性创面,加之术后肠道菌群的失衡及粪便刺激,易导致创面切口发展为慢性感染创面,影响创面的愈合[10]。在肛肠术后创面愈合的过程中,最为常见的细菌感染是大肠杆菌感染,由其引发的创面炎症反应会进一步加剧创面感染,导致切口愈合缓慢[11]。针对感染性创面,彻底清洁创面、及时给予药物治疗干预、有效抗感染,避免细菌对伤口的进一步破坏对于促进创面早日愈合尤为关键[12-13]。近年来,中药外用在促进感染性创面愈合方面越来越体现出其价值和优势[14-15]。
中医学认为,感染性创面多为外感邪毒入里化热,热盛肉腐成脓而来,正如《灵枢·痈疽》所云:“营气稽留于经脉之中,则血泣而不行,不行则卫气从之而不通,壅遏而不得行,故热。大热不止,热胜则腐肉,肉腐则为脓”。故治疗应以外治祛毒为主,兼以内治调理正气。马勃属于真菌类中药,具有清肺利咽、止血疗疮等功效。《中华人民共和国药典》中记载马勃为治疗创伤的直接外用中药之一[16]。马勃用于治疗恶疮的记载最早见于《名医别录》:“味辛,平,无毒。主恶疮、马疥。”[17]《本草从新》谓之:“外用敷诸疮、良。”[18]马勃已逐渐成为临床治疗各种外伤出血、鼻衄、咽喉肿痛、恶疮、溃疡的常用药物。临床实践证实,马勃在压疮、臁疮、冻疮的治疗中,治愈率均在90%以上[7,19-20]。其在创伤愈合方面的应用研究愈来愈受到重视。然而,马勃作为直接外用治疗创面的天然药物,其在肛肠科术后创面愈合中的作用研究较为少见,尤其是对大肠杆菌引起的感染性创面的修复作用及其作用机理研究。基于此,本研究拟制备兔大肠杆菌感染性创面模型,以马勃油膏进行干预,探讨马勃油膏治疗大肠杆菌感染性创面的效果,并基于NLRP3/Caspase-1炎症通路进一步探索其可能的作用机制。
炎症反应是感染性创面的形成与发展过程中最为重要的病理环节[21]。NOD样受体蛋白3(NLRP3)炎症小体是一种重要的细胞内多蛋白复合体,由NLRP3、凋亡相关颗粒样蛋白(ASC)及半胱氨酸蛋白水解酶前体(pro-Caspase-1)等共同构成[22-23]。在创面的持续感染下,NLRP3炎症小体可被激活,并促进Caspase-1及下游IL-1β、TNF-α等促炎性细胞因子的释放,激发机体的免疫炎症反应,造成炎症损伤的进一步扩大,导致创面久不愈合[24-25]。以NLRP3炎性小体为治疗靶点,靶向干预NLRP3、Caspase-1蛋白及其下游炎症信号因子的生成、释放,抑制其活性及过度表达,以调控炎症反应,有望成为感染性创面损伤修复的新策略[26-27]。
本实验选取兔作为研究对象,以创面组织中的NLRP3、Caspase-1蛋白表达及创面组织中IL-1β、TNF-α含量作为评价兔大肠杆菌感染性创面炎症程度的指标。每只兔身上取3个创面,可以保证实验不受单个因素免疫力的影响,减少实验结果偏倚。模型组兔造模后创面组织中的IL-1β、TNF-α含量及NLRP3、Caspase-1蛋白表达均明显高于空白对照组(P<0.05);给予马勃油膏干预后,马勃油膏组兔创面组织中的IL-1β、TNF-α含量及NLRP3、Caspase-1蛋白表达均明显低于模型组(P<0.05),且创面愈合率明显高于模型组(P<0.05)。表明马勃油膏能促进兔大肠杆菌感染性创面愈合,作用机制可能是通过抑制NLRP3/Caspase-1炎症通路激活以降低创面炎症因子表达。然而,创面愈合是一个复杂的多因素共同促进的结果,创面组织毛细血管的重建、机体的免疫系统情况等因素均可能影响马勃油膏促进创面愈合的效果。未来关于马勃油膏是否通过促进血管生成及增强机体免疫力来影响创面愈合,还需进一步的研究。
——马勃

