玉屏风颗粒对地塞米松诱导的免疫抑制及继发肺部感染的影响*
许思妍,晏扬天,邱玺瑞,王宪正,纪建建
(南京中医药大学第一临床医学院/江苏省儿童呼吸疾病(中医药)重点实验室,江苏 南京 210023)
糖皮质激素是临床上多种疾病的常用药,具有免疫抑制、抗炎等药理作用[1]。然而,药理剂量的糖皮质激素即可抑制巨噬细胞吞噬功能,降低自身免疫性抗体水平,易继发肺部感染[2]。因此,缓解激素诱导的肺部免疫抑制,对于提高患儿免疫力具有重要意义。西医主要通过匹多莫德等免疫调节剂提高机体免疫力[3]。有研究[4-5]表明,匹多莫德的治疗机制单一、依从性差,使用具有较大局限性。中医药在提高机体免疫力、防止继发感染发生方面有着独特的优势,在小儿呼吸道疾病防治中的作用愈来愈被重视[6]。玉屏风散是“扶正固本”的千古名方,具有益气固表止汗的功效[7],常用于调节机体免疫力[8]。目前的研究[9]证明,玉屏风散可通过升高脾脏中NK细胞杀伤活性、巨噬细胞吞噬指数及CD4+/CD8+比值来有效缓解免疫抑制。但有关玉屏风散对呼吸道局部免疫调节机制的研究却相对较少。呼吸道合胞病毒(respiratory syncytial virus,RSV)是婴幼儿严重急性下呼吸道感染的主要原因[10-11],故本研究探究了玉屏风颗粒对免疫抑制小鼠呼吸道免疫调节的影响及预防RSV感染的效果,旨在为临床应用玉屏风提高免疫力并防治呼吸系统疾病提供实验依据。
1 材料与方法
1.1 实验动物 3~4周龄雌性Balb/c小鼠80只,SPF级,体质量为(16.54±2.25)g,购自南京市江宁区青龙山实验动物繁殖场,动物合格证编号:NO.202259263,动物生产许可证号:SCXK(苏)2018-0008,动物使用许可证号:SYXK(苏)2018-0049。实验开展前,将小鼠置于室温为24~26 ℃,相对湿度为40%~60%,12 h光暗昼夜循环的环境中,自由进食饮水进行适应性饲养。本研究已通过南京中医药大学实验动物伦理委员会审批(编号:202204A002)。
1.2 药物与试剂 玉屏风颗粒(国药准字Z10930036,批号:210518)购自广东环球制药有限公司;RSV-A型A2标准株病毒购自武汉大学病毒研究所;地塞米松(批号:923H059)购自北京索莱宝科技有限公司;匹多莫德(国药准字H20030325,批号:210303)购自浙江仙琚制药股份有限公司;流式抗体CD8-PE(批号:2016851)、NK1.1-PE(批号:4340125)、CD11c-FITC(批号:2238572)、CD4-FITC(批号:2172506)均购自Thermo Fisher Scientific公司;实验所需引物购自生兴生物,引物序列IL-1β,Forward Primer(5'→3'):GAAATGCCACCTTTTGACAGTG,Reverse Primer (5'→3'):TGGATGCTCTCATCAGGACAG;IFN-β,Forward Primer (5'→3'):AGCTCCAAGAAAGGACGAACA,Reverse Primer (5'→3'):GCCCTGTAGGTGAGGTTGAT;ISG-15,Forward Primer (5'→3'):GGTGTCCGTGACTAACTCCAT,Reverse Primer (5'→3'):CTGTACCACTAGCATCACTGTG;RNA提取试剂:Trizol(批号:335909)购自Invitragen公司;反转录体系(批号:IL8546)购自爱必信(上海)生物科技有限公司;QPCR 试剂:2×SYBR Green supermix(批号:64403754)购自BIO-RAD公司。
1.3 主要仪器 BD Accuri C6个人型流式细胞分析仪(美国BD生物科学公司);超低温冰箱(SANYO公司);普通PCR仪(TaKaRa公司);核酸蛋白检测仪(Bio-Rad公司);Step-One-Plus荧光定量PCR仪(ABI公司);高压灭菌锅(日本TOMY公司);Synergy型超纯水系统(美国Millpore公司);MCO-20AIC型二氧化碳培养箱(日本三洋公司)。
1.4 造模与分组 取健康Balb/c小鼠80只,适应性喂养1周,采用随机数字表法分为正常组(n=20)、模型组(n=20)、阳性药组(n=10)、玉屏风高剂量组(n=10)、玉屏风中剂量组(n=10)、玉屏风低剂量组(n=10)。除正常组外,其他组小鼠参照相关文献[9,12]方法,构建地塞米松诱导的免疫抑制模型:腹腔注射0.2 mL剂量为10 mg/kg的地塞米松混悬液,1次/d,连续注射4 d。若小鼠出现反应迟钝、皮毛乏光、活动少、扎堆明显、食量下降等免疫力低下现象,则说明造模成功。正常组小鼠腹腔注射等体积生理盐水,1次/d,连续注射4 d。
1.5 实验给药 免疫抑制模型构建完成当天(即第5天)进行灌胃治疗,每只小鼠灌胃体积为0.2 mL。参照《人和动物间按体表面积折算的等效剂量比值表》[13]将儿童临床用药剂量换算为小鼠给药剂量,其中玉屏风高、中、低剂量组按临床儿童等效剂量的2、1、1/2倍分别设置。玉屏风高、中、低剂量组小鼠每天分别灌胃给予玉屏风颗粒11.500、5.750、2.875 g/kg;阳性药组小鼠每天灌胃给予匹多莫德0.307 g/kg;正常组、模型组小鼠灌胃给予等体积生理盐水,1次/d,连续给药7 d。
1.6 病毒感染 给药完成后,除正常组外,其余组小鼠鼻腔滴注60 μL RSV病毒感染(含50 μL空斑形成单位为1.0×106的呼吸道合胞病毒),正常组小鼠滴鼻等体积生理盐水。RSV感染24 h后,处死各组小鼠并快速取肺部组织,一部分置于4%多聚甲醛固定,一部分快速置于液氮速冻后于-80 ℃超低温冰箱保存。
1.7 观察指标
1.7.1 小鼠体质量、脾脏质量及脾脏形态 室温条件下,分别于第1、7天给药前(禁食不禁水)测量小鼠体质量;第1、8天每组各取10只小鼠脱脊椎处死用以取材,以75%酒精消毒小鼠左侧背腹交界处皮肤,无菌条件下取脾脏,剪去脂肪及筋膜组织,以生理盐水洗去血迹并用滤纸吸干器官表面多余水分,使用电子天平称取脾脏质量,并拍照观察脾脏大体形态。
1.7.2 小鼠肺泡灌洗液免疫细胞亚群 剪开小鼠喉咙部皮肤,用镊子分离气管周围组织以暴露气管,以穿刺针插入气管上端,0.3 mL PBS反复冲洗,获取小鼠肺泡灌洗液(BALF)。而后裂解红细胞,制备成单细胞悬液。随后将细胞以1 500 r/min离心5 min,收集下层细胞,采用1×PBS洗涤,然后加入相应流式抗体,4 ℃孵育30 min,1×PBS洗涤,使用流式细胞仪上机检测CD4+T,CD8+T,树突状细胞(DC)、自然杀伤细胞(NK)等比例变化,采用FlowJo分析数据。
1.7.3 小鼠肺组织炎症因子mRNA表达水平测定 取部分肺组织,提取RNA并反转录为cDNA,采用RT-qPCR检测干扰素(IFN-β)、白细胞介素-1β(IL-1β)、干扰素刺激基因15蛋白(ISG15)等炎症因子mRNA的相对表达量,方法如下:每份组织称取约20 mg,采用Trizol一步法提取总RNA,Nanodrop仪器测量RNA浓度和纯度(1.8<OD260/280<2.0)。1 μg RNA反转录,使用Tarkata反转录试剂盒,反应程序为42 ℃,20 min;95 ℃,5 min;4 ℃,5 min。随后进行RT-qPCR。反应在96孔或384微孔板内进行。IL-1β mRNA表达采用2-ΔΔct法分析,IFN-β mRNA、ISG15 mRNA表达采用2-Δct法进行分析。
1.7.4 小鼠肺组织形态学观察 取部分肺组织,4%多聚甲醛固定24 h,脱水,石蜡包埋,切片进行苏木精-伊红染色。中性树脂封片后,光学显微镜下阅片,检查组织病变情况,并进行炎症评分,根据病变由轻到重的程度标记为0分(基本正常),1分(轻度),2分(中度),3分(重度),累加所有分数,并计算出每组动物的平均分数。具体评分标准见表1。

表1 肺组织病理评分标准
1.8 统计学方法 用GraphPad Prism 8.0软件进行统计分析,计量资料用(±s)表示,多组间比较用单因素方差分析,两两比较采用LSD-t检验,P<0.05为差异有统计学意义。
2 结 果
2.1 地塞米松对小鼠免疫力的影响 免疫抑制小鼠模型构建完成后,与正常组比较,模型组小鼠脾脏体积缩小,且体质量、脾脏质量均明显降低(P<0.05)。与正常组比较,模型组小鼠BALF中CD4+T、CD8+T、NK、DC细胞比例均明显降低(P<0.05)。(见图1~2)

图1 两组小鼠脾脏大小、形态图
2.2 玉屏风颗粒对模型小鼠免疫力的影响 与模型组比较,玉屏风低、中、高剂量组小鼠的脾脏尺寸肉眼观察均有所恢复。(见图3)与模型组比较,玉屏风高剂量组小鼠的脾脏质量明显增加(P<0.05);与模型组比较,玉屏风高、低剂量组小鼠的体质量均明显增加(P<0.05),且玉屏风高、低剂量组间体质量比较,差异无统计学意义(P>0.05);阳性药组、玉屏风中剂量组小鼠体质量、脾脏质量与模型组比较,差异均无统计学意义(P>0.05)。(见图4)

图2 两组小鼠免疫力评估(±s,n=10)

图3 各组小鼠脾脏大小、形态
与模型组比较,玉屏风高、中剂量组小鼠BALF中DC细胞的比例均明显升高(P<0.05);阳性药组、玉屏风低剂量组小鼠BALF中DC细胞的比例与模型组比较,差异均无统计学意义(P>0.05)。与模型组比较,玉屏风高剂量组小鼠BALF中CD8+T和CD4+T细胞的比例均明显升高(P<0.05);玉屏风低、中、高剂量组间小鼠BALF中DC、CD8+T和CD4+T细胞的比例比较,差异均无统计学意义(P>0.05);阳性药组和玉屏风低、中剂量组小鼠BALF中CD8+T和CD4+T细胞的比例与模型组比较,差异均无统计学意义(P>0.05)。(见图4)

图4 玉屏风颗粒对模型小鼠免疫力的影响(±s,n=10)
2.3 玉屏风颗粒对模型小鼠病毒感染引起的肺部炎症的影响 正常组小鼠肺部组织结构清晰,腔内无充血水肿,黏膜上皮细胞无变性坏死脱落,周围组织无炎症细胞浸润;模型组小鼠肺部结构不清晰,细支气管壁的淋巴细胞少量浸润,镜下可见肺泡壁充血性增厚,亦可见肺泡壁变薄,呈气肿状,炎症程度较重;阳性药组小鼠肺泡腔病变较模型组好转,但腔隙内炎症细胞浸润仍较多;玉屏风高、中、低剂量组小鼠肺组织病变及炎症情况均较模型组显著缓解,其中,玉屏风低剂量组小鼠肺泡腔病变好转,腔隙内炎症细胞浸润减少;玉屏风高剂量组小鼠肺泡腔进一步好转,腔内炎症细胞浸润较少;玉屏风中剂量组小鼠肺组织改善最为明显,近似恢复至正常组水平。(见图5)
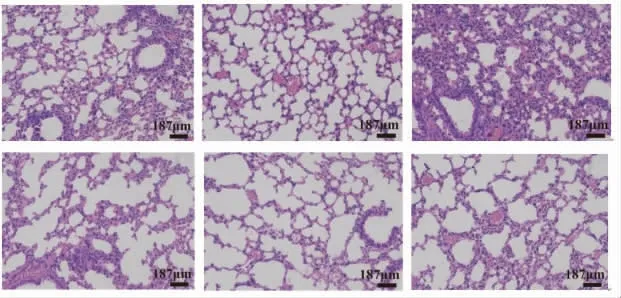
图5 各组小鼠肺部病理切片图(HE,×20)
与正常组比较,模型组小鼠炎病评分及肺组织中IL-1β mRNA相对表达量明显升高(P<0.05);与模型组比较,玉屏风低、中、高剂量组小鼠炎症评分及肺组织中IL-1β mRNA相对表达量均明显降低(P<0.05),且各剂量组间比较,差异无统计学意义(P>0.05);阳性药组小鼠炎症评分及肺组织中IL-1β mRNA相对表达量与模型组比较,差异无统计学意义(P>0.05)。(见图6)

图6 玉屏风颗粒对模型小鼠肺部炎症的影响(±s,n=10)
2.4 玉屏风颗粒处理对模型小鼠Ⅰ型干扰素介导的抗病毒免疫应答的影响 与模型组比较,玉屏风低剂量组小鼠肺组织中IFN-β mRNA、ISG15 mRNA表达均明显升高(P<0.05)。阳性药组和玉屏风高、中剂量组小鼠肺组织中IFN-β mRNA、ISG15 mRNA表达与模型组比较,差异均无统计学意义(P>0.05)。(见图7)

图7 玉屏风颗粒对模型小鼠抗病毒免疫的影响(±s,n=10)
3 讨 论
玉屏风散具有益气固表,扶正祛邪的功效[6],主要成分为多糖、皂苷、黄酮类化合物等,具有双向免疫调节作用,可以增强机体免疫功能,抑制变态反应,减少病毒感染及呼吸道疾病、过敏性疾病的反复发作[7,14]。目前有关玉屏风散的基础研究多通过脾指数、外周血及免疫器官中CD4+T和CD8+T细胞的比例评估机体的整体免疫情况[6,15-16],较少关注对呼吸道局部免疫的影响。既往研究表明[17],玉屏风散可通过促进免疫抑制小鼠口咽部甲型链球菌的生长进而增强小鼠的上呼吸道免疫力。本研究主要关注玉屏风散对免疫抑制小鼠下呼吸道免疫的调节作用及预防RSV感染的效果,以期为其临床应用提供更全面的参考。
地塞米松是临床上常用的免疫抑制剂,对免疫反应的多个环节有抑制作用[2]。在免疫调节药物的研究中,常被用于构建免疫抑制模型[18]。地塞米松为一种抗炎、抗过敏药物,可以通过降低淋巴细胞产生的抗体数量,进而下调免疫功能而产生免疫缺陷。它还能引起免疫器官,包括脾脏和胸腺的质量下降[12]。本研究结果证明,玉屏风颗粒能有效预防地塞米松引起的免疫器官质量和体质量的下降,提示玉屏风颗粒可拮抗地塞米松导致的小鼠免疫抑制,具有免疫调节作用。T细胞亚群中的辅助性T细胞(Th)与细胞毒T细胞(Tc)在机体的细胞免疫中起重要作用[19]。根据T细胞表面标志的不同,Th及Tc又分别称作CD4+T和CD8+T,且CD4+T、CD8+T可相互调节,是免疫系统的核心部分[20]。DC细胞作为体内功能最强的抗原呈递细胞,能够有效激活初始T细胞,诱导免疫反应的激活或耐受,对维持免疫稳态至关重要[21]。NK细胞的比例反映了机体免疫清除功能的强弱[22],而在RSV感染的患儿体内,NK细胞比例越高,患儿的肺功能亦越强[23]。故BALF中CD4+T、CD8+T、DC、NK的比例变化可作为评估呼吸道免疫的指标。本研究结果显示,玉屏风颗粒可显著恢复地塞米松诱导的免疫抑制小鼠模型中CD4+、CD8+及DC细胞的比例,表明玉屏风颗粒可增强小鼠呼吸道细胞免疫应答。然而以上结果并未观察到剂量依赖性,且NK细胞的比例无显著性改变。
炎症反应是机体对病原微生物感染、创伤、变态反应等发生的组织细胞反应[24]。适度的炎症反应可促进组织的修复,而过度的炎症反应易引发气道损伤,阻止气道的正常恢复,是肺炎、哮喘等呼吸系统疾病所共有的病理机制,为免疫过亢的表现[25-26]。炎症细胞因子IL-1β是炎症反应的重要组成部分[27],故可作为肺部炎症评估的指标之一。本研究发现,模型组小鼠肺部炎症细胞浸润明显,病理损伤严重,IL-1β水平较高。与模型组比较,低、中、高剂量的玉屏风颗粒处理后,均可减轻肺部炎症反应,并显著降低IL-1β水平(P<0.05)。此外,抗病毒免疫应答的水平可反映呼吸道免疫的平衡情况,IFN-β在其中发挥重要作用[28],其可以通过诱导多种抗病毒蛋白的表达进而限制病毒的感染进程,如类泛素蛋白ISG15。现有证据表明,ISG15可类泛素(ISG)修饰某些病毒蛋白,对其进行ISG化修饰可抑制病毒复制[29]。本研究结果表明,低剂量玉屏风颗粒可诱导较高水平IFN-β mRNA及ISG15 mRNA的表达(P<0.05),提示玉屏风颗粒可通过增强机体Ⅰ型干扰素介导的固有抗病毒免疫应答来预防RSV感染。
本研究运用流式细胞术、RT-qPCR等手段探讨了玉屏风颗粒对免疫抑制小鼠呼吸道免疫的调节作用及预防RSV感染的可能机制,即通过介导DC、CD4+T、CD8+T细胞等增强呼吸道局部免疫,并于RSV感染发生后提高IFN-β介导的抗病毒免疫应答、减轻炎症反应。但其深层机制未进一步阐明,有待进一步的实验证实。

