丹参炭纳米类成分的发现及其对高胆红素血症致小鼠肝损伤的保护作用*
郭颖慧,陈瑞,曹天佑,董利洋,吴同,张越,孔慧,赵琰,屈会化
(1.北京中医药大学中医学院,北京 100029;2.北京中医药大学中药学院,北京 100029;3.北京中医药大学生命科学学院,北京 100029;4.北京中医药大学中医药研究院,北京 100029)
高胆红素血症是由于血红素过度降解或胆红素排泄减少而引起的疾病[1]。机体游离胆红素浓度升高,可形成稳定的胆红素自由基,导致脂质过氧化损伤,诱导炎症因子的表达,从而引发炎症反应[2-3]。本病常见于病毒性肝炎引起的急性肝炎、慢性肝炎和重型肝炎。血清高胆红素水平的持续存在,可引起肝细胞进一步坏死而加重肝损伤[4],是重症肝病的主要症状之一[5-6]。目前现代医学针对高胆红素血症主要采用光疗和血液净化疗法[7],但光疗及血液净化疗法在降低胆红素的同时,也存在诸多不良反应[8-9]。因此,探索一种全新、有效的治疗药物非常必要。
碳点通常被认为是一种尺寸小于10 nm的准碳基纳米材料,可因碳源或制备方式的不同而呈现出多样性[10]。碳点主要由sp2/sp3碳骨架及丰富的官能团/聚合物链组成,大量的表面基团/聚合物链赋予其良好的稳定性及易于合成和表面修饰等特性[11-12],故其广泛用于生产光学材料[13]、生物传感器[14]、细胞内成像探针[15]等。本团队前期从中药炭药中提取分离出碳纳米类成分并证明了其生物活性,如:大蓟炭[16]纳米类成分能通过干预共同的凝血途径发挥止血效应,葛根炭纳米类成分[17]具有抗高血尿酸和抗炎活性。因此,中药炭药在纳米医学领域具有很大开发潜力和研究价值。
丹参(Salvia Miltiorrhiza,SM)为唇形科植物丹参Salvia moltiorrhiza Bunge.的干燥根及根茎,始载于《神农本草经》。其炮制方法在《备急千金药方》和《圣济总录》中有“熬令紫色、炒令黑黄”的记载,现代地方炮制规范亦记载有炒丹参、丹参炭等[18]。研究[19]发现丹参炭具有较好的抗氧化性。然而丹参炭起效的物质基础研究尚未有报道,因此本课题组从纳米科学技术角度探究丹参炭炮制后的物质基础。
本研究通过高温炭化制备工艺,从丹参炭中制备出一种新的纳米物质,根据团队前期对中药炭药研究的命名原则[20-22]将其命名为丹参炭纳米类成分(salvia miltiorrhiza carbon isatum nanocomponents,SMC-NCs),并利用透射电子显微镜(transmission electron microscopy,TEM)、X-射线衍射仪(X-ray diffractometer,XRD)、X-射线光电子能谱分析仪(X-ray photoelectron spectroscopy,XPS)、傅里叶变换红外光谱(fourier transform infrared spectroscopy,FT-IR)、紫外-可见分光光度计(ultraviolet-visible spectrophotometer,UV-Vis)、荧光分光光度计(fluorescence spectroscopy,FL)对其微观结构及光学特征进行分析。同时本研究建立了高胆红素血症小鼠肝损伤模型,通过生化病理等指标检测来评价SMC-NCs对肝损伤的保护作用。
1 材料与方法
1.1 实验动物 SPF级雄性昆明小鼠(6~8周龄)30只,体质量为(31.0±2.0)g,动物生产许可证号:SCXK(京)2019-0010,质量合格证编号:No.110324211107181812,购于斯贝福(北京)生物技术有限公司。所有实验动物均饲养于北京中医药大学良乡校区动物房,保持室温(25±1)℃左右,通风良好,空气湿度55%~65%,明暗12 h/12 h交替,环境安静,饲养期间动物随意进食,实验前12 h禁食不禁水。所有动物实验均符合北京中医药大学伦理委员会的规定,动物实验伦理批准号:BUCM-4-2021-092202-3084。
1.2 药物与试剂 丹参(批号:201123001)购于北京仟草中药饮片有限公司,生产日期为2020年11月23日,经北京中医药大学赵琰教授鉴定为唇形科植物丹参Salvia moltiorrhiza Bunge.的干燥根;胆红素(bilirubin,BIL)(批号:s30376-1g)购于上海源叶生物科技有限公司;超氧化物歧化酶(superoxide dismutase,SOD)试剂盒(批号:20210407)、丙二醛(malondialdehyde,MDA)试剂盒(批号:20210408)、还原型谷胱甘肽(glutathione,GSH)试剂盒(批号:20210506)均购自南京建成生物工程研究所;肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)检测试剂盒(批号:20220132)、白细胞介素-6(interleukin-6,IL-6)检测试剂盒(批号:20220163)均购自江苏科特生物科技有限公司;生理盐水(批号:2201082001)购自石家庄四药有限公司;水均为去离子水。
1.3 主要仪器 马弗炉(北京中科澳博科技股份有限公司,型号:PXR-9);高分辨率透射电子显微镜(日本电子光学实验室,型号:Jen-1230);透射电子显微镜(美国FEI公司,型号:TecnaiG220);荧光分光光度计(日本Hitachi公司,型号:F-4500);紫外分光光度计(英国Cambridge公司,型号:CECIL);傅立叶转换红外光谱仪(美国Thermo Fisher Scientific公司,型号:JEN-1230);全自动生化分析仪(美国贝克曼库尔特有限公司,型号:AU-480);X射线光电子能谱分析仪(美国Thermo Fisher Scientific公司,型号:ESCALAB 250Xi);X射线衍射仪(德国Bruker AXS公司,型号:D8-Advanced)。
1.4 SMC-NCs的制备 称取丹参生药400 g于坩埚中,用锡纸加盖密封,置于马弗炉中高温煅烧,马弗炉程序升温:第一阶段5 min升温至75 ℃,保持30 min;第二阶段25 min升温至300 ℃,保持1 h。将丹参炭粉碎,称取60 g炭粉末,加入1 800 mL去离子水搅拌均匀,水浴锅中煎煮1 h,用0.22 μm微孔滤膜滤过,重复3次,滤液合并,浓缩后装入透析袋内连续透析72 h,最后将得到的SMC-NCs透析液保存在4 ℃,待用。
1.5 SMC-NCs的表征 利用透射电子显微镜对SMC-NCs的微观形态及分布情况进行分析:将留置待用的SMC-NCs透析液稀释2倍,超声震荡2 h后,用0.22 μm的微孔滤膜过滤,得到待测液。用1 mL注射器吸取适量待测液滴于铜网中央,通风干燥后将铜网置于透射镜下观察;利用X射线衍射仪分析SMC-NCs的内部空间分布状态:取SMC-NCs透析液的冻干粉末,在研钵中研磨充分均匀后压片,放入仪器中检测;利用X射线光电子能谱分析仪测定SMC-NCs元素组成:取SMC-NCs透析液在冻干机中冻成粉末,将其均匀铺在铝箔上,再盖上一层铝箔,用液压机将其压平后放入X射线光电子能谱分析仪中进行测试;利用紫外分光光度计分析SMC-NCs溶液的紫外吸收光谱:开机预热15 min,用去离子水测定出基线后,将稀释后的SMC-NCs透析液放入比色皿,测试波长范围为200~600 nm,速度为5 nm/s;红外光谱仪分析SMC-NCs的表面官能团信息:取20 μL的SMC-NCs溶液滴入玛瑙研钵中,与160 mg溴化钾粉末混合,置于红外箱中不断研磨,使其充分干燥后,用压力机在压力为20 kPa条件下压制成片,快速放入红外光谱仪中检测;利用荧光分光光度计测定SMC-NCs的荧光性质:仪器开机预热30 min后,将SMC-NCs透析液倍比稀释,放入石英比色皿,设定光谱扫描范围为200~600 nm,狭缝宽度10 nm,测定SMC-NCs的最大激发波长及最大发射波长。
1.6 药物的配制
1.6.1 SMC-NCs溶液的制备 将“1.4”项下得到的透析液在冻干机中冻成粉末,精密称取一定量的SMC-NCs冻干粉,加入去离子水配置成1 mg/mL的SMC-NCs溶液。
1.6.2 造模药的配制 避光称取60 mg胆红素粉末,溶于1 mL浓度为0.5 mol/L氢氧化钠溶液中,加入9 mL去离子水,使用0.5 mol/L稀盐酸将其滴定至pH值为8.5,于实验前1 h内配制使用。
1.7 动物分组与给药 将30只SPF级雄性昆明小鼠,随机分为空白组、模型组、SMC-NCs高剂量组、SMC-NCs中剂量组、SMC-NCs低剂量组,每组6只。适应性饲养5 d后,SMC-NCs低、中、高剂量组分别灌胃相应质量浓度的SMC-NCs。SMC-NCs的给药剂量依据成人用药剂量[23]换算成小鼠的用药剂量(按照SMC的质量计算)后,结合团队前期预实验给药剂量筛选所得,即SMC-NCs高、中、低剂量分别为10.0、5.0、2.5 mg/(kg·d)。各组小鼠给药体积均为0.01 mL/g,空白组和模型组小鼠均灌胃等体积的去离子水,1次/d,连续给药7 d。末次给药结束1 h后,除空白组小鼠给予同体积生理盐水外,其余各组均腹腔注射胆红素(150 mg/kg)制备高胆红素血症模型,造模后24 h,小鼠摘眼球取血处死,随即摘取肝脏组织,置于-80 ℃冰箱保存备用。
1.8 观察指标
1.8.1 肝组织病理切片观察 小鼠摘眼球取血处死后取出肝组织,剪取肝左叶大小相当的同一部位,置于4%的多聚甲醛固定液中保存48 h以上。对固定好的肝组织进行乙醇脱水、石蜡包埋、切片及HE染色等处理后,在光学显微镜下观察其病理学改变情况。
1.8.2 血清生化指标检测 造模24 h后,小鼠摘眼球取血,血液室温静置4 h,于离心机中4 000 r/min离心10 min,收集上层血清。用全自动生化分析仪检测小鼠血清中丙氨酸氨基转移酶(alanine transaminase,ALT)、天冬氨酸氨基转移酶(aspartate aminotransferase,AST)、总胆红素(total bilirubin,TBIL)、总胆汁酸(total bile acid,TBA)的含量。
1.8.3 血清炎症因子水平的检测 取上述小鼠血清,采用ELISA法,按照试剂盒说明书,检测各组小鼠血清中IL-6、TNF-α的含量。
1.8.4 抗氧化水平评估 取各组小鼠肝组织,将肝组织与生理盐水(每1 g肝组织加入9 mL生理盐水)匀浆后,3 000 r/min离心15 min,取匀浆上清液留置待测。按照SOD、MDA、GSH试剂盒说明书进行操作,在酶标仪波长450 nm下读取结果,计算各组小鼠肝组织匀浆中MDA含量及SOD、GSH活性。
1.9 统计学方法 采用SPSS 20.0统计软件对实验数据进行统计分析,计量资料以(±s)表示,服从正态分布,同时方差齐则用单因素方差分析,组间两两比较采用LSD-t法。P<0.05为差异有统计学意义。
2 结 果
2.1 SMC-NCs的表征结果 TEM图像显示,SMC-NCs为空间分布均匀的类球形颗粒,在水溶液中分散均匀,无聚集成团现象。通过Image J软件对其粒径大小进行统计分析,其粒径范围在1.2~3.2 nm,主要集中在2.1 nm左右,基本符合正态分布规律。HR-TEM显示,SMC-NCs晶格分布清晰可见,晶格间距为0.214 nm;XRD图谱显示其大约在2θ=26.6°处有一个衍射峰。(见图1)
SMC-NCs的红外光谱显示,该纳米类成分在3 441、2 922、2 852、1 632、1 402、1 099 cm-1处有吸收峰。其中3441 cm-1峰可能是-OH键,在2 922 cm-1和2 852 cm-1处有2个吸收峰,可能是由于甲基或亚甲基的-CH键伸缩振动引起的。结合1 632 cm-1和1 402 cm-1两处吸收峰,SMC-NCs可能含有C=O、C-N、N-H、C-O-C及COO-等官能团[24]。1 099 cm-1处的吸收峰提示C-O-C的拉伸弯曲[25]。上述结果表明,在SMC-NCs的表面含有丰富的基团。SMC-NCs的紫外光谱提示可能是芳香族化合物SP2杂交的π-π跃迁所致,此外没有观察到杂原子(如S和N)参杂的表面态区域的N-π*跃迁。荧光光谱显示,SMC-NCs的最大激发波长在364 nm左右,最大发射波长在457 nm左右。(见图1)
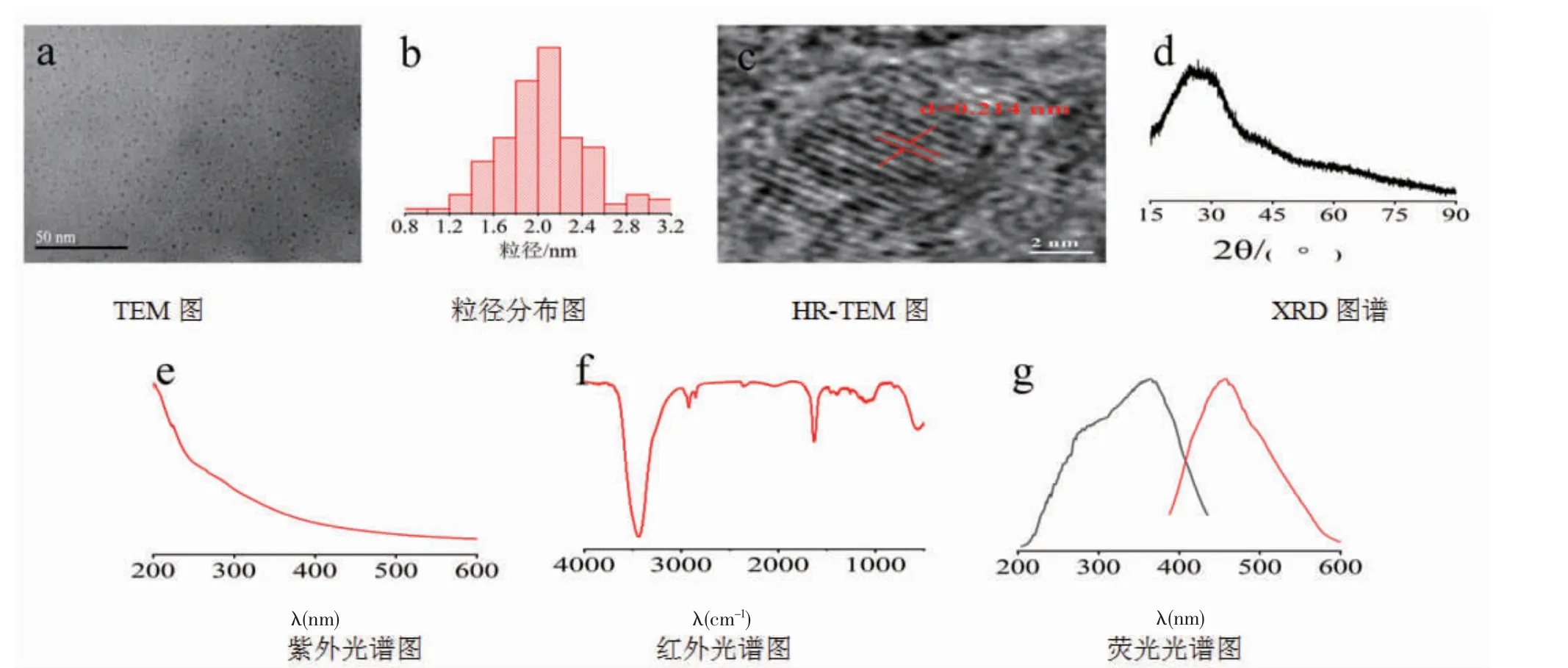
图1 SMC-NCs 的表征结果
利用XPS技术对SMC-NCs的元素组成和表面化学键进行详细测定,结果显示在285.29、400.28、532.03 eV处分别有3个吸收峰,提示SMC-NCs主要由C(70.07%)、O(28.08%)、N(1.84%)3种元素组成。其中C1s谱带显示有3个峰,其中284.79、286.44、288.25 eV分别对应C-N键、C-O键及O-C=O键[26-28]。N1s谱带显示,在399.42、400.03 eV处有吸收峰,分别对应C-N-C键、N-H键[29-30]。O1s谱带显示,在531.27和532.61 eV处有吸收峰,分别对应C=O键、C-OH/C-O-C键[25]。(见图2)

图2 SMC-NCs 表面基团和元素组成的XPS 图谱
2.2 各组小鼠肝组织病理改变情况 空白组小鼠肝组织结构清晰,肝细胞排列整齐,边界清楚,肝小叶结构完整,肝索放射状排列,未见炎症细胞浸润;与空白组比较,模型组小鼠肝组织结构严重紊乱,大量炎症细胞浸润,肝细胞大面积坏死;SMC-NCs低剂量组小鼠肝损伤程度低于模型组,SMC-NCs高、中剂量组小鼠肝组织结构较为清晰,肝细胞坏死程度和炎症细胞浸润情况均明显低于模型组。(见图3)
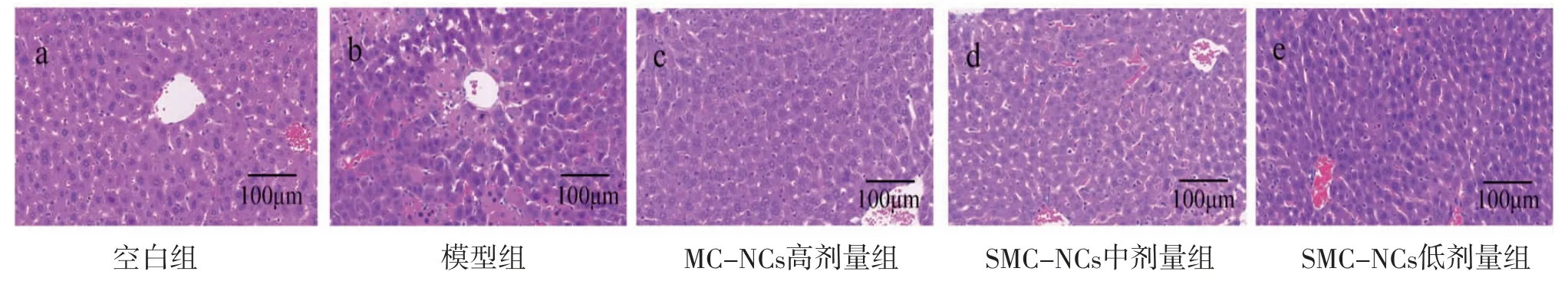
图3 各组小鼠肝组织切片(HE,×200)
2.3 各组小鼠血清AST、ALT、TBIL、TBA含量比较 模型组小鼠血清AST、ALT、TBA、TBIL含量显著高于空白组(P<0.01),表明高胆红素血症模型建立成功。SMC-NCs高、中、低剂量组小鼠血清AST、ALT、TBA、TBIL含量显著低于模型组,差异均有统计学意义(P<0.01或P<0.05)。(见图4)
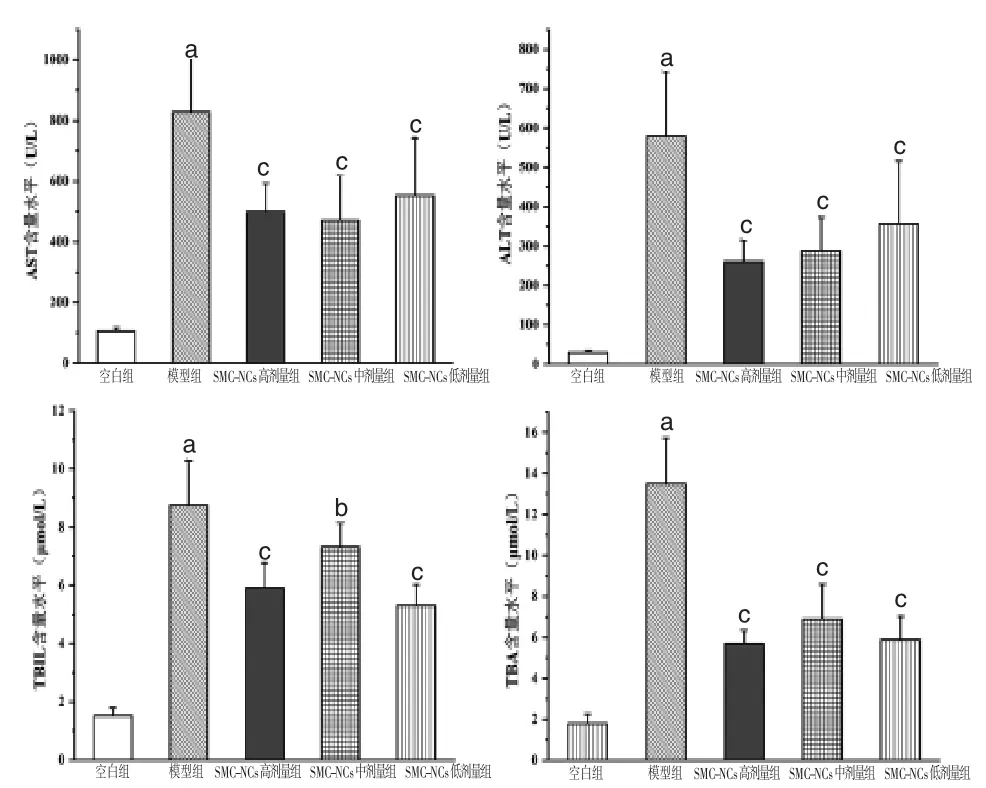
图4 各组小鼠血清AST、ALT、TBIL、TBA含量比较(±s,n=6)
2.4 各组小鼠血清IL-6、TNF-α含量比较 模型组小鼠血清IL-6、TNF-α含量显著高于空白组(P<0.01);SMC-NCs高剂量组小鼠血清IL-6、TNF-α的含量显著低于模型组(P<0.01),SMC-NCs低剂量组小鼠血清TNF-α低于模型组(P<0.05)。(见图5)

图5 各组小鼠血清TNF-α、IL-6 水平(±s,n=6)
2.5 各组小鼠肝组织SOD、GSH活性及MDA含量比较 模型组小鼠肝组织SOD、GSH活性显著低于空白组(P<0.01),MDA含量显著高于空白组(P<0.01);SMC-NCs高剂量组小鼠肝组织SOD、GSH活性显著高于模型组,MDA含量显著低于模型组,差异均有统计学意义(P<0.01)。(见图6)

图6 各组小鼠肝组织SOD、GSH 活性及MDA 含量比较(±s,n=6)
3 讨 论
丹参作为一种传统中药材,其临床应用历史悠久。现代研究主要从丹参酚酸及丹参酮类小分子成分来解释其抗炎、保肝、抗氧化等生物活性[31]。随着纳米材料在医学领域的广泛应用,研究人员发现中药炭药纳米类成分具有抗炎、抗菌、抗病毒、保肝等药理作用[32-33],同时炭类中药的生物活性因其纳米类成分粒径大小及官能团不同而表现出差异性[20]。本研究从纳米材料学角度出发,以天然产物丹参为前驱体,利用与碳点制备相似的高温热解法,提取分离出SMC-NCs,并通过建立高胆红素致小鼠肝损伤模型评价其对肝损伤的保护作用。TEM、XRD结果显示其分散度良好,粒径大小分布在1.2~3.2nm,晶格间距为0.214 nm;UV-Vis、FL显示其具有荧光性;结合XPS、FT-IR图谱显示其元素组成主要为C、O、N,以C含量居多(70.07%),且表面含有C-O-C、COO-及C-N等官能团。SMC-NCs所携带的官能团可能是其发挥生物活性的物质基础。
高胆红素血症可以对机体多个器官、系统造成不同程度的损伤[34],如高水平的胆红素具有肝毒性,可引起肝细胞凋亡,进而出现继发性的坏死[35]。TBIL、ALT、AST为临床诊断及指导高胆红素血症治疗的主要指标[36],可反映肝实质损伤程度;此外,由于TBA的产生、代谢与肝脏的合成、摄取及排泄功能密切相关,且TBA水平不受黄疸等因素干扰,因此TBA也常用于反映肝功能的状态。本实验结果显示,SMC-NCs高、中、低剂量组小鼠血清AST、ALT、TBA、TBIL含量显著低于模型组,差异均有统计学意义(P<0.01或P<0.05),表明SMC-NCs可以改善高胆红素血症所致的小鼠肝功能损伤。
胆红素可以自由穿过细胞膜,对细胞和组织产生毒性作用[5-6]。在各种细胞系统中,过量的未结合胆红素会导致活性氧的产生、脂质过氧化及谷胱甘肽(GSH)代谢的失衡[37]。GSH是重要的抗氧化剂,可以清除人体有害毒素及代谢物[38]。高胆红素血症患者体内会形成脂质过氧化物的堆积,发生氧化应激反应,且体内SOD活性与MDA的含量成负相关[3,39-40]。本研究结果显示,SMC-NCs高剂量组小鼠肝组织SOD、GSH活性显著高于模型组,MDA含量显著低于模型组,差异均有统计学意义(P<0.01),提示SMC-NCs能干预高胆红素血症引发的氧化应激反应,改善其氧化应激水平。
此外,研究表明高胆红素血症可以诱导炎症和NF-κB激活相关的基因表达,促使IL-6、TNF-α释放,且NF-κB通路参与了炎症反应[41-42]。而TNF-α是NF-κB的关键靶点,也是NF-κB通路和炎症介质的成熟激活因子。TNF-α通过与特定的细胞膜受体结合,诱导细胞自溶,然后进入细胞,促进溶酶体酶的释放,从而发挥肝细胞毒性[43]。本实验结果显示,SMC-NCs高剂量组小鼠血清IL-6、TNF-α的含量显著低于模型组(P<0.01),SMC-NCs低剂量组小鼠血清TNF-α含量低于模型组(P<0.05),提示SMC-NCs可以通过抑制炎症反应来减轻肝功能损伤。
本研究利用纳米技术成功从丹参炭中制备出SMC-NCs,并通过动物实验证明了其对高胆红素血症所致肝损伤的保护作用,其发挥肝保护作用的机制可能与抑制炎症反应及改善氧化应激有关。本研究为SMC-NCs干预高胆红素血症所致肝损伤的药物研发奠定了实验基础,也为丹参炭发挥药理效应的物质基础研究提供了新的思维模式。
利益冲突:所有作者均声明不存在利益冲突

