心房颤动病人IL-1β、Calpain-2水平与心脏结构重构的相关性研究
卢园园,李浩宇,耿嘉逸,雷思思,刘晨阳,康品方,张宁汝
临床上心房纤维颤动(房颤)是最常见的持续性心律不齐之一,其死亡率及发生率都较高[1]。研究[2]发现房颤最终会导致脑梗死、心肌梗死、心力衰竭等心脑血管终端事件。相关流行病调查研究[3]发现,房颤的发病率逐年上升。但就目前治疗方案来说,仍具有较多的局限性:房颤射频消融术潜在并发症以及复发率较高;抗心律失常药物疗效有限且不良反应强[4]。因此房颤潜在的病理机制成为我们研究的重点,早期研究[5]证实房颤发生的基础病因主要与心脏结构重构相关,而心脏结构重构的根本原因是心肌纤维化。心肌细胞的炎症反应、钙超载、氧化应激以及心脏成纤维细胞的活化等因素与心肌纤维化有关[6-8]。早期研究证实白细胞介素-1β(IL-1β)作为炎症因子家族成员之一,可参与大量的炎症以及应激反应[9],而钙超载可诱导钙蛋白酶-2(Calpain-2)的激活,并参与多种钙调通路[10]。因此,本研究主要通过分析房颤病人血清中IL-1β、Calpain-2水平和超声心动图左心房内径(LAD)、左心室舒张期内径(LVDd)、左心室射血分数(LVEF)和左心室缩短分数(FS)指标,探究房颤发生与发展的相关病理机制,为临床治疗开辟新思路。
1 资料与方法
1.1 一般资料 选取2019年1月至2020年11月在蚌埠医学院第一附属医院住院房颤病人150例为观察组,依照《2020年心房颤动的诊断和管理指南》将其分为阵发性房颤病人84例和非阵发性房颤病人66例。对照组选用同时段体检健康者120名。入组标准:参考欧洲心脏病协会(ESC)联合欧洲心胸外科协会(EACTS)颁发的《2020年心房颤动的诊断和管理指南》的诊疗标准确诊房颤病人;性别不限;年龄≥18岁;同时检查IL-1β、Calpain-2水平以及超声心动图。排除标准:慢性阻塞性肺疾病、风湿性心脏病、心脏瓣膜病、先天性心脏病、肝肾功能不全、良恶性肿瘤、脑血管意外等。2组的性别、高血压、糖尿病、肝肾功能等基础信息差异均无统计学意义(P>0.05)(见表1)。
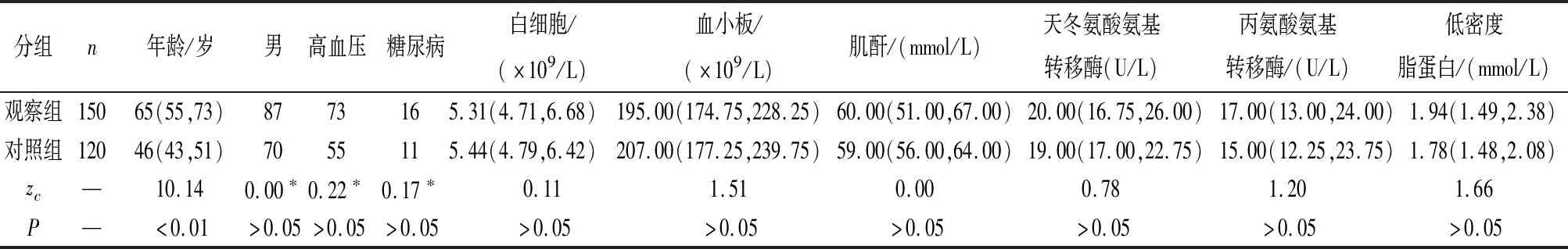
表1 2组基线资料比较[M(P25,P75)]
1.2 指标检测与方法 留取2组外周静脉血5 mL,离心后提取上层血清,将血清保存至-80 ℃冰箱。所有标本中IL-1β、Calpain-2水平统一采用酶联免疫吸附法(ELISA)检测。白细胞、血小板、肌酐、丙氨酸氨基转移酶、天冬氨酸氨基转移酶、低密度脂蛋白等血清学指标由我院检验科测得。利用超声心动图检测房颤病人住院房颤发作期间以及健康体检者的LAD、LVDd、LVEF、FS。
1.3 统计学方法 采用两独立样本非参数检验(Z检验)、χ2检验、多个独立样本非参数(H)检验、Pearson相关性分析和二元logistic回归分析。
2 结果
2.1 3组研究对象IL-1β、Calpain-2血清学指标与超声心动图相关结果比较 与对照组相比,阵发性房颤组和非阵发性房颤组IL-1β、Calpain-2、LAD、LVDd水平均升高,LVEF、FS水平下降;同时与阵发性房颤组相比,非阵发性房颤组中IL-1β、Calpain-2、LAD、LVDd水平上升,且LVEF、FS水平下降,差异均有统计学意义(P<0.05~P<0.01)(见表2)。

表2 IL-1β、Calpain-2及心脏彩超结果结果比较[M(P25,P75)]
2.2 房颤影响因素二元logistic回归 二元logistic回归提示:年龄大、IL-1β、Caplain-2、LAD水平升高是房颤发生的危险因素(P<0.01)(见表3)。

表3 房颤影响二元logistic回归结果
2.3 IL-1β、Calpain-2血清学指标与超声心动图相关性分析 在Spearman相关性检验结果中,IL-1β与LAD、LVDd呈正相关关系(P<0.01),与LVEF、 FS呈负相关关系(P<0.01);同样Caplain-2与LAD、LVDd呈正相关关系(P<0.01),与LVEF、FS呈负相关关系(P<0.01)(见表4)。
3 讨论
近年房颤的发病率随着人口老龄化的加剧也明显增加[11]。本次研究也发现随着年龄的增加,房颤发生的风险明显上升。早期研究[12]已证实心脏电重构以及结构重构是房颤发生以及进展的病理学基础,其中心脏的结构重构主要是由于心肌纤维化所致。本研究也发现了观察组LAD、LVDd明显高于对照组,且非阵发性房颤病人较阵发性房颤病人有较强差异性,进一步证实心脏结构重构是房颤发生与进展的病理基石。心肌纤维化与心肌细胞炎症反应以及心肌细胞损伤有明显的相关性[13]。IL-1β是较常见的炎症因子之一,当其被激活后心肌细胞可在其介导的相关炎症介质如NLRP3、IL-6作用下出现坏死,诱导心肌纤维化[14]。Calpain-2是钙蛋白酶家族重要组成成分,参与多种钙调信号途径,从而与心肌的细胞凋亡有紧密关联[23]。因此本研究主要探讨IL-1β、Calpain-2 与房颤的发生以及发展是否存在相关性,以及作用的相关机制。
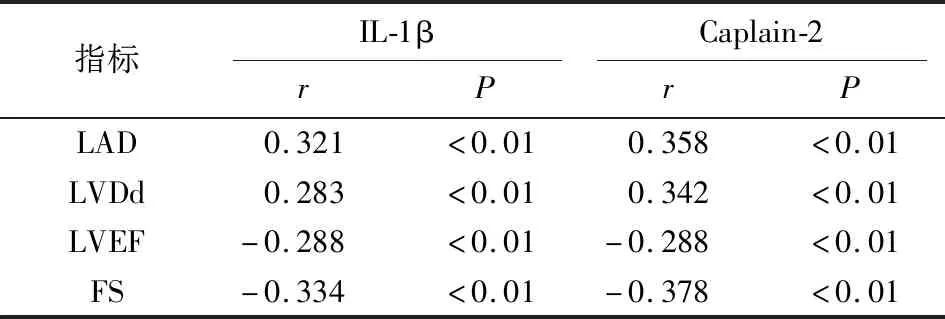
表4 IL-1β、Caplain-2与心脏彩超结果的相关性分析
研究[15]已证实了炎症相关因子可促进房颤的发生和进展,根本原因为心肌组织的炎症反应加重了心房电重构和结构重构。众所周知IL-1家族在炎症反应中尤为特殊,IL-1β是其中最具特征性的成员。成熟的IL-1β在Caspase-1依赖的蛋白水解IL-1产生后通过非常规途径分泌至细胞外,随后通过切割C-末端来发挥炎症和免疫刺激反应[16]。前期有研究[17]发现IL-1β可导致血管内皮炎症反应以及细胞损伤。近期研究[18-19]发现,房颤病人左心房内巨噬细胞含量明显增加且被极化,极化后的巨噬细胞可进一步释放IL-1β,抑制下游Quaking蛋白(Quaking protein,QKI)的表达,从而降低了QKI抑制炎症反应的能力,同时下调L型钙离子通道,加剧了心房肌细胞电重构。同样有研究[20]发现IL-6可在IL-1β诱导下释放,进而促进心肌纤维化,加重心脏结构重构,所以IL-1β不仅促进了心脏的电重构同样也参与了心脏的结构重构。与上述研究相似,我们此次研究发现观察组IL-1β明显高于对照组,与此同时非阵发性房颤组IL-1β较阵发性房颤组显著增加,因此我们推测IL-1β与房颤有着一定的相关性。为探求其具体作用机制,我们分析了IL-1β与LAD、LVDd相关性,发现随着IL-1β含量增加,LAD、LVDd显著上升,而LVEF、FS明显下降,进一步证实了IL-1β促进了心脏的结构重构。另外我们发现IL-1β可作为房颤的相关危险因素,随着IL-1β含量的升高,房颤发生的风险显著上升。因此我们推测IL-1β可导致心脏结构重构,进而参与房颤的发生与发展,具体作用机制可能与其介导的心肌细胞炎症反应,使得心肌细胞坏死,从而诱发心肌纤维化有关。
Calpain是一种中性半胱氨酸蛋白酶,由钙离子激活后发挥各种功能,几乎存在于所有的真核细胞中[10]。大量研究[21-24]已证实Calpain可通过激活核转录因子-κB等促进心肌肥厚和炎症反应、激活转化生长因子-β诱导间质纤维化、介导钙离子信号通路诱发心肌细胞坏死等机制加重心脏结构重构,导致心律失常、心力衰竭等心血管事件。其中Calpain-2是钙蛋白酶系统中重要的组成成员,当细胞内Ca2+大量超载时其会被激活[23]。SATADRU等[25-26]在应激诱导的心衰小鼠的心室肌组织中发现当Ca2+激活Calpain-2后,使亲联蛋(junctophilin-2,JPH-2)的C-端裂解,产生一种新的C-端JPH-2肽,使得Ca2+与心肌的收缩耦联机制失调,使得心室结构重构。近期一项临床研究[27]发现Calpain-2可上调钙调神经磷酸活性,进而激活CaN-NFAT信号通路,参与心房结构重塑,引起房颤的发生[27]。我们此次研究也发现,观察组Calpain-2含量较对照组显著升高,同样非阵发性房颤病人Calpain-2水平较阵发性房颤病人明显上升,为了探讨其是否与心脏结构重构有关,我们将Calpain-2与心脏彩超结果进行分析,发现观察组LAD、LVDd明显高于对照组,且非阵发性房颤组较阵发性房颤组升高,差异均有统计学意义,且Calpain-2与LAD、LVDd呈明显正相关。通过二元logistic分析可知Calpain-2对房颤的发生起着一定的促进作用。综合上述结论我们可知Calpain-2参与了房颤的发生及发展过程,主要原因为其加重了心脏结构重构,具体机制可能与Calpain-2参与了相关钙离子信号通路有关。
综上所述,本研究通过房颤病人与正常体检者血清中IL-1β、Calpain-2以及超声心动图指标对比及相关性分析,证实了IL-1β、Calpain-2通过促进心脏结构重构,进而导致房颤的发生与发展。其具体作用机制可能与心肌细胞炎症反应以及钙离子相关通路激活有关,尚待进一步探讨。

