大剂量甲氨蝶呤治疗中枢神经系统淋巴瘤的疗效及不良反应防治
姜玲 史雯 侯安继 杨晓燕
(徐汇区中心医院肿瘤科 上海 200031)
原发性中枢神经系统淋巴瘤(primary central nervous system lymphoma, PCNSL)是一种少见的原发于脑、脊髓、脑脊膜和眼部的淋巴瘤,发病率占颅脑肿瘤的1%~6%,多为弥漫大B细胞类型[1]。多数恶性程度高的淋巴瘤在治疗过程中,亦会转移至中枢神经系统出现继发性中枢神经系统淋巴瘤(secondary central nervous system lymphoma, SCNSL)。这两者的预后均差,中位生存期仅1.5个月左右。大剂量甲氨蝶呤(methotrexate, MTX)可以通过血脑屏障,已经成为治疗这两种脑淋巴瘤的一线治疗方案,使患者生存期明显延长。但由于大剂量MTX的治疗会带来严重的骨髓抑制和肝肾损伤[2],甚至危及生命,因此给临床应用带来一定的限制。我院近10多年共收治20例PCNSL和SCNSL并使用大剂量MTX治疗的患者,通过规范治疗和密切监测MTX血药浓度的方法,保障了治疗的安全进行,同时明显降低不良反应并积累了一定经验。
1 资料和方法
1.1 一般资料
本组患者以PCNSL为主,病理多为弥漫大B淋巴瘤。国际预后指数(international prognostic index, IPI)评分多≤2分,多为一、二线化疗,具体见表1。纳入标准:有明确淋巴瘤病理诊断的患者,且伴原发或继发中枢神经系统浸润,符合化疗指征。排除标准:神志改变,无法沟通者;存在严重肝肾、心肺功能障碍;伴发其他神经系统疾病或脑血管疾病患者。

表1 患者基本情况
1.2 化疗过程和方法
1.2.1 化疗方案
第1日早晨6时静脉滴注5%碳酸氢钠注射液250 mL碱化尿液,静脉输液750 mL水化同时补钾。检测尿pH>7后按3 g/m2的MTX加入0.9%氯化钠注射液1 000 mL中匀速静脉滴注24 h。同时每天使用5%葡萄糖注射液2 000 mL、0.9%氯化钠注射液2 000 mL水化、5%碳酸氢钠注射液320 mL碱化、呋塞米40 mg静脉推注利尿、10%氯化钾注射液共40 mL加入补液中补充钾离子。每次排尿后测尿液pH,确保pH≥7,如果pH持续<7,需要临时加用5%碳酸氢钠注射液100 mL。每天早晚称体质量,如果晚上比早晨体质量>2 kg或者出现水钠潴留的症状,需要临时加用呋塞米20~40 mg。每天计算尿量,确保每24 h尿量>4 000 mL,必要时加用呋塞米20~40 mg。MTX用药结束后开始监测MTX血药浓度,MTX用药结束后12 h进行亚叶酸钙(calcium folinate, CF)静脉输注解救,根据MTX血药浓度的结果调整CF静脉输注解救的剂量。
1.2.2 化疗前后的支持治疗
化疗前检查血常规、肝肾功能、心电图等,确认无化疗禁忌证。化疗结束后每日检查血常规、肝肾功能、电解质等以随访化疗不良反应。治疗同时予以CF 100 mg加入0.9%氯化钠注射液100 mL中,漱口,3次/d;复方氯己定溶液饭前后漱口,6次/d。予甘草酸二胺胶囊口服100 mg/次,3次/d预防性保肝治疗;别嘌醇0.1 g/次,3次/d,降低尿酸。
1.2.3 血药浓度监测
于静脉注射MTX结束后0、24、48及72 h时,取患者静脉血2 mL至肝素钠抗凝管,采用Agilent 1100高效液相色谱系统(美国Agilent公司)、Bond Elut C18固相萃取小柱(美国Agilent公司)进行色谱分析测定血清MTX浓度,检测下限为0.01 μmol/L。检测范围为0 h<700 μmol/L,24 h<10 μmol/ L,48 h <1 μmol/L,72 h<0.1 μmol/L。目标安全浓度<0.1 μmol/L。根据MTX血浓度调整CF静脉输注解救方案(表2)。
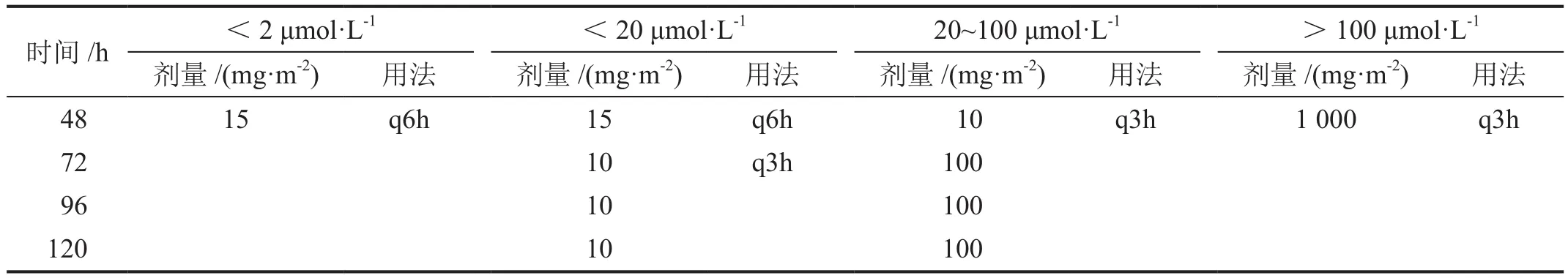
表2 根据MTX血药浓度调整CF静脉输注解救方案
1.2.4 不良反应观察
监测患者化疗前后的血常规、肝肾功能及电解质等生化指标,同时观察患者化疗后其他临床症状及表现。不良反应参考WHO的抗肿瘤药物不良反应分度标准进行分级统计。
2 结果
2.1 MTX血药浓度
本组20例患者24、48和72 h时测定MTX血药浓度分别为<10、<1和<0.1 μmol/L,均在安全范围内。
2.2 化疗疗效
大剂量MTX治疗PCNSL或SCNSL在一线、二线化疗中均获得较好疗效,多为完全缓解(complete response, CR)及部分缓解(partial response, PR)。其中4例在一线使用该方案后仅达到病情稳定(stable disease,SD),1例病理为NK/T细胞淋巴瘤;1例为原发骨弥漫大B细胞淋巴瘤;其他2例均为非生发中心来源型弥漫大B细胞淋巴瘤。在二线治疗后疗效仅达到SD的患者中,1例病理为外周T细胞淋巴瘤,另1例病理为弥漫大B细胞淋巴瘤(表3)。有效率定义为CR、PR患者的总人数比患者总数。
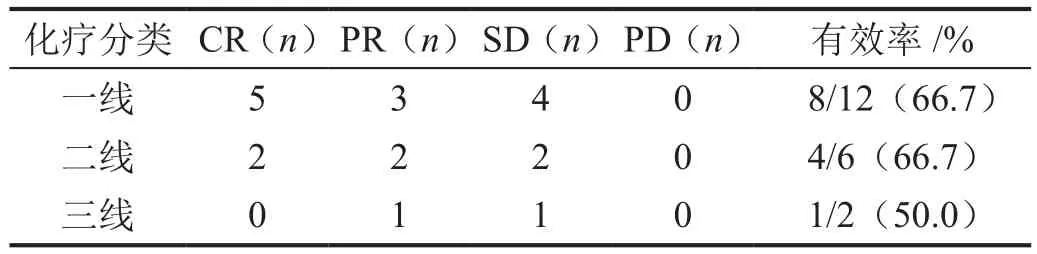
表3 一、二、三线治疗疗效
2.3 不良反应
20例大剂量MTX化疗的患者中白细胞减少发生率最多见,约75.0%,其中15.0%的患者合并粒细胞缺乏伴发热,但无死亡病例。25.0%患者出现血小板减少,多为中重度;5.0%患者出现重度血红蛋白的降低,均无严重并发症。35.0%的患者出现肝功能损害,大多为轻中度。10.0%患者出现中度口腔溃疡(表4)。
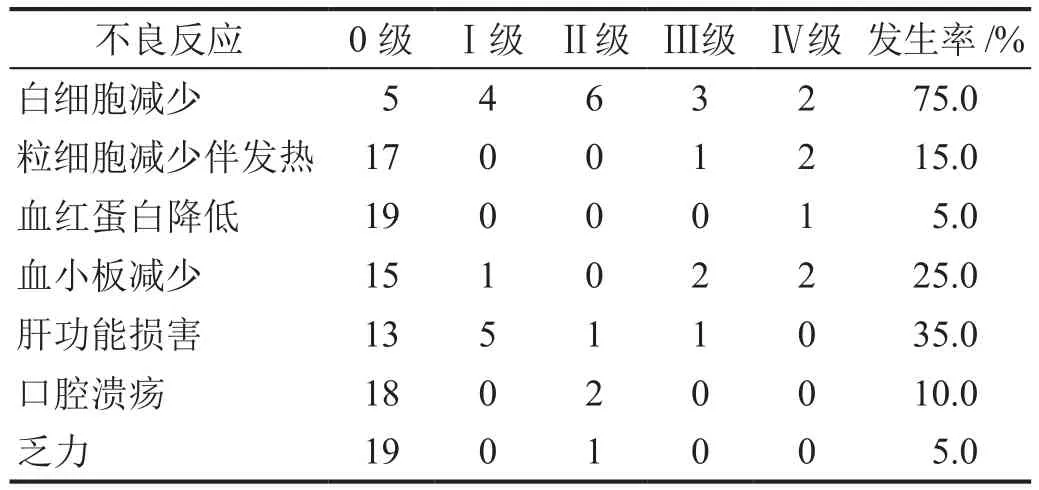
表4 20例患者MTX化疗不良反应
3 讨论
MTX是一种二氢叶酸还原酶抑制剂,可竞争性抑制二氢叶酸转化为有生理活性的四氢叶酸,从而影响胸腺嘧啶核苷酸和嘌呤核苷酸的生物合成过程,最终导致DNA的合成受阻而抑制肿瘤细胞的增殖。大剂量MTX多认为≥3 g/m2[3],美国相关临床治疗指南同时推荐2种MTX剂量,分别是3.5和8 g/m2,但从2018年开始,8 g/m2成为第一选择[4]。常作为化疗的组成部分用于治疗PCNSL或SCNSL[5]。大剂量MTX方案可通过增加MTX血药浓度,使MTX向细胞内转运增加,从而透过血脑屏障[6]。但同时也会产生显著的毒性反应,如急性肝肾损伤、骨髓抑制、黏膜炎及胃肠道反应等[7]。为了更好地提高本病的治疗疗效、控制毒性反应,有效的护理干预显得尤为重要[8]。
国内外许多研究者已对大剂量MTX的临床和药物代谢动力学进行深入研究,认为MTX 3~5 g/m2,连续24 h静脉滴注,第36小时CF解救能获得最好的疗效,毒性可耐受[9-11]。本组患者选用24 h输注方式,达到一线、二线治疗客观反应率均达66.7%,与国内崔向丽等[12]报道的疗效相近。其中近一半的患者为老年患者,2例为ECOG评分较差的患者亦能耐受该方案的治疗。本组患者中骨髓抑制较多,Ⅲ级以上骨髓抑制患者中有2例为多线化疗的患者,可能与曾经接受过化疗而骨髓功能不佳有关。肝功能损害与口腔溃疡较轻,无一例肾功能损伤。后者与规范的水化、碱化治疗,以及严密的护理随访密不可分。
在大剂量MTX治疗方案中,即使采用固定的剂量与输注时间,MTX的体内药代动力学过程在不同患者或者同一患者不同治疗周期间仍有很大差异性,尤其是排泄延迟现象[13]。因此,通过对MTX血药浓度监测,观察患者是否出现MTX排泄延迟以及把握CF的解救时机和剂量具有重要的临床意义。我们采取公认的MTX治疗后12 h CF解救的方案,在MTX治疗结束后0、24、48及72 h监测MTX浓度,并制定好解救方案。所幸在积极的预防、规范的治疗和严密的护理下,我组的所有患者在72 h后MTX浓度均降至安全范围内。
另外,需要注意的是,赵海艳等[14]曾报道1例白血病患儿使用大剂量MTX后出现急性肾损伤的情况,进一步基因检测提示该患儿亚甲基四氢叶酸还原酶(methylene tetrahydrofolate reductase, MTHFR) 基因C677T(rs 1801133)存在杂合突变(CT型)。陈丽萍等[15]观察了41例使用大剂量MTX的患者,进行了MTHFR(677C>T)多态位点检测分为CC型(野生型)、CT型及TT型(突变型),不良反应的发生率分别为35.7%、45.0%及85.7%。后续对于基因型为CT和TT的患者,增加CF解救次数,发现不良反应发生率下降至30.0%和57.0%。马乐等[16]也进行了131例MTHFR和三磷酸腺苷结合盒B亚家族成员1转运蛋白(ABCB1)基因多态性检测,发现MTHFR 677位点(CT + TT)型携带者肝肾功能损伤发生率均较CC型高,但差异无统计学意义;ABCB1 3435位点(CT + TT)型携带者肝功能损伤发生率明显高于CC型。进行基因检测来预估大剂量MTX的毒性反应有待更多的数据来统一认识。
总之,我们通过20例125次大剂量MTX的规范治疗,强调足量水化、碱化,密切监测尿量和尿液pH的变化,以便确保MTX的排泄;按计划监测MTX浓度,根据血药浓度调整CF解救方案,以期降低化疗不良反应;加强口腔卫生的护理,有效地控制了口腔黏膜损害的发生。通过采取这些措施,我们降低了严重化疗不良反应的发生率,保障了化疗的按时顺利进行及疗效。

