正常血钙型原发性甲状旁腺功能亢进症的临床特征及影响因素研究
黄泽宇,苏磊,桑剑锋,赵茹,韩晨,王茜,顾天伟,毕艳,朱大龙,沈山梅*
原发性甲状旁腺功能亢进症(PHPT)是由甲状旁腺病变引起的甲状旁腺激素(PTH)合成与分泌过多所致的全身性疾病,是第三大常见的内分泌系统疾病[1]。PHPT的典型表现为骨质疏松、病理性骨折、反复泌尿系结石等多系统的改变。随着实验室检查及颈部彩超的普及,PHPT的流行病学特点从经典型向无症状型转变,从高钙型向正常血钙型转变[2]。正常血钙型原发性甲状旁腺功能亢进症(NCPHPT)是指PTH水平升高而血钙水平正常,并排除维生素D缺乏、肾功能不全等其他继发性因素[3]。目前,尚未有证据表明NCPHPT是PHPT的轻症阶段或是高钙型PHPT的特殊类型[4-5],且因其实验室指标变化不显著、漏诊率高,临床医生在诊疗中存在不少困惑。本研究拟通过回顾性探讨糖代谢、骨代谢等相关指标在NCPHPT患者中的特征表现,为早期诊治NCPHPT提供一定的临床依据。
1 资料与方法
1.1 资料来源 回顾性选取2016年1月至2021年12月在南京大学医学院附属鼓楼医院就诊的PHPT患者153例。纳入标准:(1)根据2014年《原发性甲状旁腺功能亢进症诊疗指南》[6]诊断为PHPT;(2)影像学检查(甲状旁腺彩色多普勒超声、CT或放射性核素显像)可见颈部甲状旁腺区域存在病变或存在异位病变;(3)患者自愿接受甲状旁腺切除术且手术病理检查示甲状旁腺腺瘤、增生或甲状旁腺癌;(4)临床病史、实验室检查、影像学及病理学资料完整。排除标准:(1)继发性及散发性甲状旁腺功能亢进症;(2)肾功能不全〔根据CKD-EPI公式计算估算肾小球滤过率(eGFR)<60 ml·min-1·(1.73 m2)-1〕;(3)肝功能不全(肝酶指标升高至参考值上限的2倍及以上);(4)与炎症性肠病、慢性胰腺炎、代谢手术等与钙吸收不良有关的胃肠道疾病;(5)服用噻嗪类利尿剂、锂剂、磷制剂及抗惊厥等影响血清PTH的药物;(6)妊娠期及哺乳期妇女。同时选取同期行健康体检且甲状旁腺功能正常者作为健康对照组。本研究获得南京大学医学院附属鼓楼医院伦理委员会批准(编号:2022-096-02)。
1.2 方法 将153例PHPT患者根据校正血钙(CsCa)水平分为高钙组和正常血钙组。
1.2.1 分组标准及定义 血钙分组标准:根据血清白蛋白校正血钙公式[6],CsCa(mmol/L)=实测血钙(mmol/L)+[40-血清白蛋白(g/L)]×0.02。根据国内外指南共识[7-8]及南京大学医学院附属鼓楼医院血钙参考范围,定义CsCa>2.75 mmol/L为高钙组,2.25 mmol/L≤CsCa≤2.75 mmol/L为正常血钙组。
1.2.2 资料采集 收集正常血钙组、高钙组及健康对照组的临床资料,记录其性别、年龄、身高、体质量、体质指数(BMI)、血压、临床症状及实验室检查结果(包括生化指标、糖代谢及骨代谢指标);收集高钙组和正常血钙组患者的甲状旁腺影像学资料(包括直径、位置、异位情况及是否存在多腺体病变)及病理学资料(包括占位性质、是否侵犯包膜及是否具有细胞异型性)。
1.3 统计学方法 采用SPSS 26.0统计软件进行数据分析。符合正态分布的计量资料以(±s)表示,两组间比较采用独立样本t检验,多组间比较采用单因素方差分析,组间两两比较采用LSD法。计数资料以相对数表示,组间比较采用χ2检验或Fisher's确切概率法。影响因素的分析采用单因素和多因素Logistic回归分析。以P<0.05为差异有统计学意义。
2 结果
2.1 一般资料比较 正常血钙组36例,其中男12例、女 24例, 年龄(51.5±14.1)岁,BMI(24.2±3.4)kg/m2;高钙组117例,其中男34例、女83例,年龄(52.5±15.8)岁,BMI(23.6±3.8)kg/m2。健康对照组50例,其中男22例、女28例,年龄(46.9±15.4)岁,BMI(24.1±4.1)kg/m2。三组间性别、年龄、BMI比较,差异均无统计学意义(P>0.05);三组间收缩压及舒张压比较,差异有统计学意义(P<0.05);正常血钙组患者的收缩压及舒张压均较健康对照组高,差异有统计学意义(P<0.05),见表1。
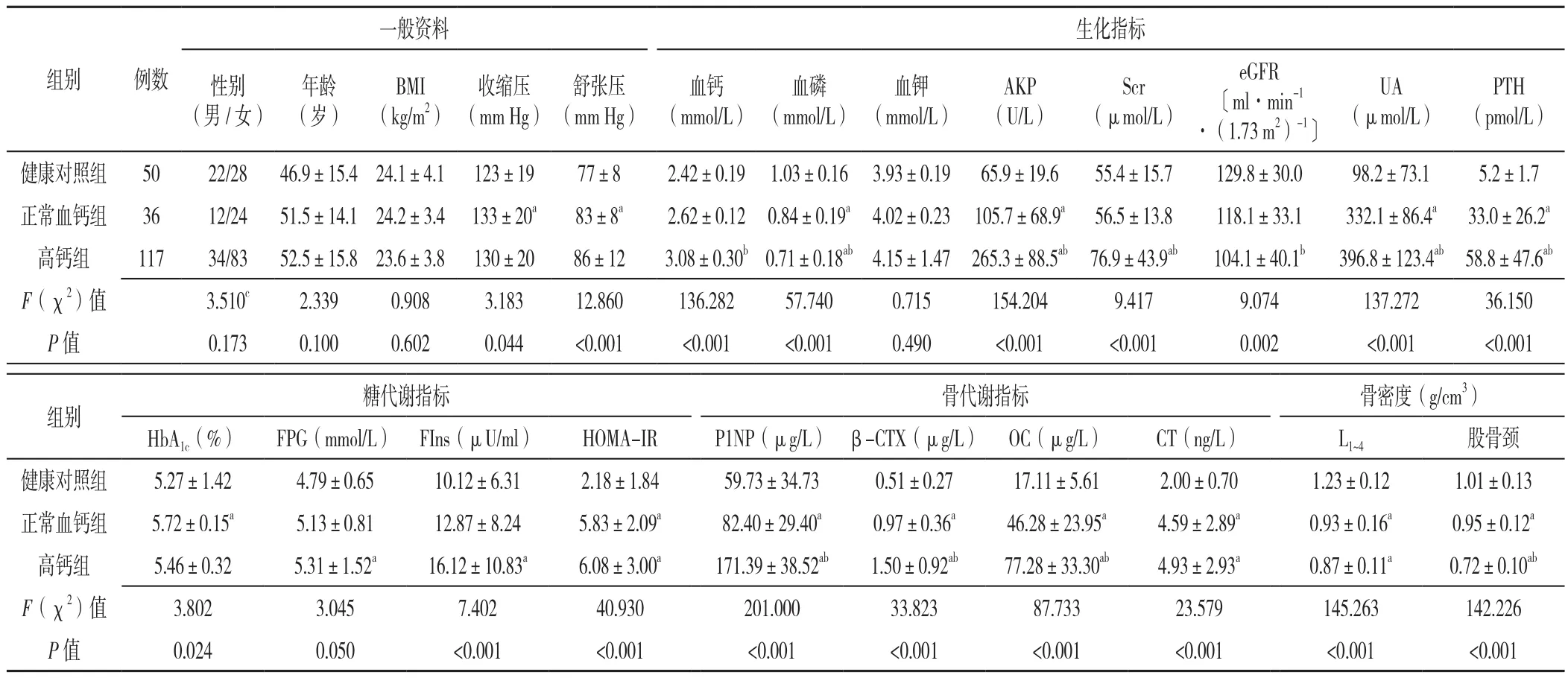
表1 健康对照组、高钙组和正常血钙组一般资料及实验室检查比较Table 1 Comparison of general data and biochemical indices among control group,hypercalcemia PHPT group and NCPHPT group
正常血钙组中有15例(41.7%)因体检行甲状腺彩超发现甲状旁腺区域存在占位就诊,8例(22.2%)因PTH升高就诊,4例(11.1%)因骨痛、关节痛、病理性骨折等骨骼系统症状就诊,3例(8.3%)因腰痛、泌尿系结石等泌尿系统症状就诊,其他就诊原因包括乏力3例(8.3%),恶心呕吐2例(5.6%)和口干多饮1例(2.8%)。高钙组中有38例(32.5%)因骨骼系统症状就诊,21例(17.9%)因体检发现血钙升高或甲状旁腺区域占位就诊,17例(14.5%)因泌尿系统症状就诊,14例(12.0%)因乏力就诊,8例(6.8%)因口干多饮就诊,6例(5.1%)因恶心、呕吐等消化系统症状就诊,6例(5.1%)因消瘦就诊,其他就诊原因包括发现血压升高3例(2.6%),头晕2例(1.7%),下肢麻木1例(0.9%),心悸1例(0.9%)。
2.2 实验室检查结果比较 生化指标方面:三组患者的血钙、血磷、碱性磷酸酶(AKP)、血肌酐(Scr)、eGFR、尿酸(UA)、PTH比较,差异均有统计学意义(P<0.05);三组间血钾比较,差异无统计学意义(P>0.05)。与健康对照组相比,正常血钙组患者的AKP、UA、PTH水平升高,血磷降低,差异有统计学意义(P<0.05);与高钙组相比,正常血钙组患者血钙、AKP、Scr、UA、PTH降低,血磷及eGFR升高,差异有统计学意义(P<0.05)。糖代谢指标方面:三组间糖化血红蛋白(HbA1c)、空腹血糖(FPG)、空腹胰岛素(FIns)及胰岛素抵抗指数(HOMA-IR)比较,差异有统计学意义(P<0.05)。与健康对照组相比,正常血钙组的HbA1c、HOMA-IR升高(P<0.05),高钙组FPG、FIns、HOMA-IR升高(P<0.05)。骨代谢指标及骨密度方面:三组Ⅰ型前胶原氨基端延长肽(P1NP)、Ⅰ型前胶原C端肽β降解产物(β-CTX)、骨钙素(OC)、降钙素(CT)、第1腰椎~第4腰椎骨密度(L1~4)及股骨颈密度比较,差异均有统计学意义(P<0.05)。其中,正常血钙组的P1NP、β-CTX、OC和CT较健康对照组高,L1~4及股骨颈密度较健康对照组降低,差异有统计学意义(P<0.05);与高钙组相比,正常血钙组的P1NP、β-CTX、OC降低,股骨颈密度升高,差异有统计意义(P<0.05),见表1。
2.3 正常血钙组和高钙组影像学比较 将甲状腺左右叶后方及上下极旁病变位置分为4个象限:左上、左下、右上、右下象限。正常血钙组患者的影像学检查(甲状旁腺彩色多普勒超声、CT或放射性核素显像)显示4例存在多腺体病变,甲状旁腺病灶合计40个,分别位于左上8个(20.0%),左下17个(42.5%),右上3个(7.5%),右下12个(30.0%)。正常血钙组的病灶直径0.50~4.01 cm,平均为(2.06±1.00)cm。高钙组患者的影像学检查显示共117个甲状旁腺病灶,分别位于左上25个(21.4%),左下27个(23.1%),右上9个(7.7%),右下52个(44.4%),异位4例(3.4%),不存在多腺体病变。高钙组的病灶直径0.60~6.50 cm,平均为(2.23±1.04)cm。正常血钙组及高钙组甲状旁腺占位均好发于下极。正常血钙组和高钙组病变的直径、位置和异位情况比较,差异无统计学意义(P>0.05);正常血钙组多腺体病变率高于高钙组,差异有统计学意义(P<0.05),见表2。
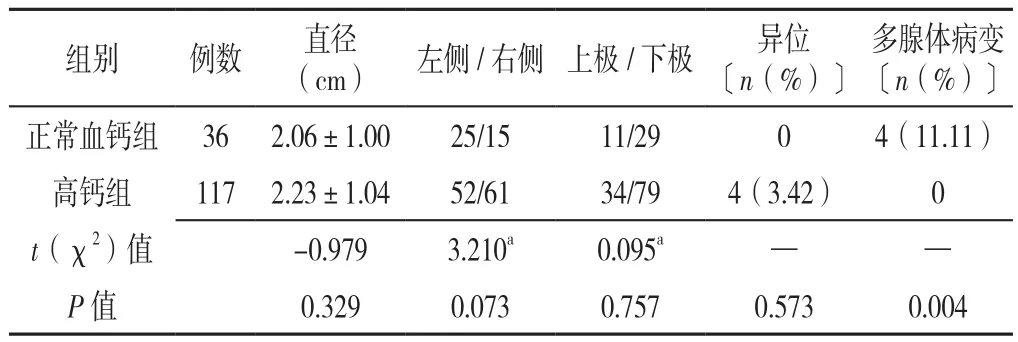
表2 正常血钙组与高钙组患者的影像学资料比较Table 2 Comparison of imaging features between NCPHPT group and hypercalcemia PHPT group
2.4 正常血钙组和高钙组病理学比较 正常血钙组患者术后病理结果主要为良性病变,其中34例(94.44%)为甲状旁腺腺瘤,2例(5.56%)为甲状旁腺增生;有7例(24.1%)因甲状腺乳头状癌同期行甲状腺手术。在高钙组,甲状旁腺腺瘤(88.89%)仍是其主要的病理改变,10例(8.55%)为甲状旁腺增生,甲状旁腺癌较为罕见(2.56%)。两组病理类型比较,差异无统计学意义(χ2=8.556,P>0.05),见表3。
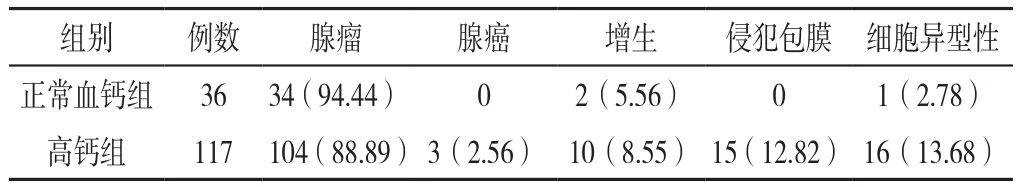
表3 正常血钙组与高钙组患者病理学资料比较〔n(%)〕Table 3 Comparison of pathology features between NCPHPT group and hypercalcemia PHPT group
2.5 NCPHPT的相关因素分析 以是否为NCPHPT为因变量(赋值:0=否,1=是),将性别、年龄、BMI、病史及相关实验室检查指标(生化、糖代谢及骨代谢指标)为自变量,分别建立单因素和多因素Logistic回归模型,主要变量和赋值见表4。
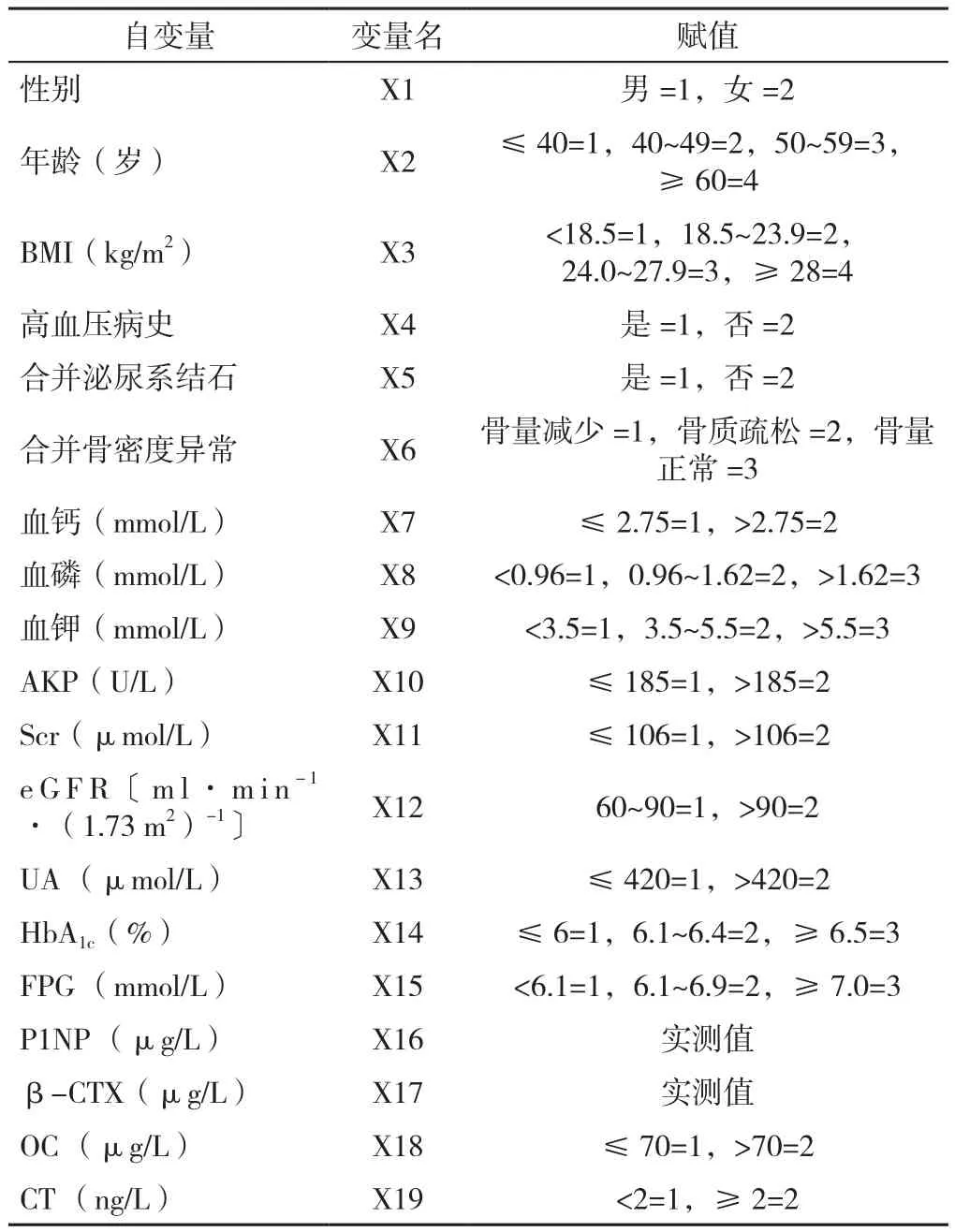
表4 Logistic回归分析的主要变量和赋值Table 4 Main variables and corresponding assignments for Logistic regression
以单因素分析中P<0.05的变量骨密度异常〔OR=10.23,95%CI(1.007,1.046)〕、泌尿系结石〔OR=1.005,95%CI(1.001,1.010)〕、血磷〔OR=0.016,95%CI(0.001,0.192)〕、AKP〔OR=2.692,95%CI(1.274,6.272)〕、Scr〔OR=1.060,95%CI(1.007,1.930)〕、UA〔OR=1.027,95%CI(1.003,1.040)〕、OC〔OR=1.014,95%CI(1.004,1.024)〕及CT〔OR=1.021,95%CI(1.002,1.040)〕作为自变量进行多因素Logistic回归分析,结果显示合并泌尿系结石、低血磷及高AKP是NCPHPT发生的独立危险因素(P<0.05),见表5。
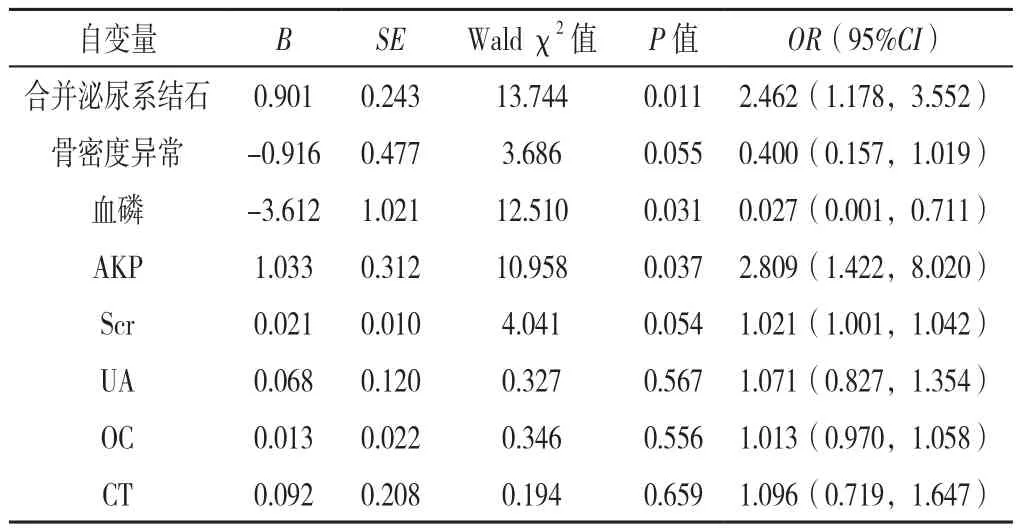
表5 发生NCPHPT影响因素的多因素Logistic回归分析Table 5 Multivariate Logistic regression analysis of the risk factors for NCPHPT
3 讨论
随着国民健康意识的增强以及体检项目的完善,NCPHPT作为PHPT的一种新类型逐渐受到关注[9]。NCPHPT的发病机制尚未完全清晰,自然转归仍不明确[10-11],目前国内外尚缺乏关于NCPHPT的诊疗指南或共识,因此本研究回顾性分析了NCPHPT的临床特征及其影响因素。
本研究发现尽管NCPHPT患者生化指标如AKP、UA、Scr等较高钙型PHPT升高不明显,但相较健康人群,NCPHPT已经对机体的骨代谢、糖代谢及心血管系统产生了一定程度的损害。在骨代谢方面,本研究发现NCPHPT患者相较健康对照组P1NP、β-CTX、OC、CT均升高,这表明NCPHPT使机体处于高骨转换状态,且本研究临床数据提示NCPHPT对骨密度的影响依旧存在,主要体现在L1~4及股骨颈密度的降低。ŠIPROVÁ等[12]在一项纳入187例NCPHPT患者的研究中同样发现42%的患者并发骨密度异常。本研究在糖代谢方面结果显示,NCPHPT组患者HbA1c、FPG、HOMA-IR较健康对照组高。TASSONE等[13]分析了23例NCPHPT患者的胰岛素敏感性,也发现其较对照组降低,但不具有统计学差异。另一项研究发现PTH水平与空腹血糖呈正相关,这表明NCPHPT可能会导致糖调节受损[14]。而NCPHPT的糖代谢异常可能与骨代谢密切相关,有动物实验表明骨转换指标可以直接刺激β细胞增殖并释放胰岛素,而胰岛素也可以通过胰岛素样生长因子1刺激骨基质的合成代谢[15]。除此之外,还有研究证实了NCPHPT对心血管、神经精神系统的影响。在心血管方面,本研究结果和CHEN等[16]研究结果一致,均发现NCPHPT患者较健康对照组发生高血压的风险升高;而巴西最近一项研究通过QoL测评表发现NCPHPT患者生活质量较绝经后女性更差[17]。因此,尽管NCPHPT患者大多因体检发现甲状旁腺区域占位而就诊,但NCPHPT不等于无症状型PHPT,其临床表现可与高钙型PHPT存在重叠,同样可对靶器官尤其是骨骼系统产生不良影响。
鉴于NCPHPT可对多系统产生不良影响,早期发现并诊断NCPHPT尤为重要。本研究通过多因素Logistic回归分析泌尿系结石、血磷降低和AKP升高是NCPHPT发生的危险因素,临床可应用于NCPHPT的早期筛查,降低疾病误诊率。(1)泌尿系结石:泌尿系结石常为PHPT的首发症状之一,其常被认为是高钙血症的重要表现。本研究中8.3%的NCPHPT患者因泌尿系统症状就诊,这可能与PTH促进尿钙排出增多有关。该特点也表明NCPHPT患者尽管无高钙血症,但临床上仍应注重定期监测其肾功能、泌尿系彩超情况。(2)低血磷:低血磷是发生NCPHPT的危险因素〔OR=0.027,95%CI(0.001,0.711),P=0.031〕。既往研究表明,甲状旁腺上可能存在磷受体位点[18-19]。由此可推测,NCPHPT可能并非通过血钙,而是由血磷独立调控PTH的活性,从而促进PTH的分泌。由此可见,血磷是NCPHPT疾病发展过程中较为敏感的一项指标,对低血磷患者应注重筛查PTH,并动态复查血磷变化。(3)高AKP:AKP是一种膜结合糖蛋白,常见于骨骼、肾脏、肝脏中,由成骨细胞产生并释放入血[20]。高碱性磷酸酶反映了成骨细胞和破骨细胞的功能状态,该指标与骨代谢异常密切相关,可提示患者存在高骨转换状态,且既往研究表明AKP与PTH呈正相关[21],因此可据此提示存在NCPHPT的可能。
目前对于NCPHPT的治疗尚缺乏指南推荐,但治疗并发症的同时,甲状旁腺切除术仍是治疗的重要方式之一。多项研究表明NCPHPT较高钙型PHPT更易出现多个甲状旁腺腺体的病变[22-24],本研究结论与之一致,此特征也为NCPHPT的手术治疗带来一定的挑战。
本研究的局限性:本研究为回顾性横断面、单中心研究,样本量偏少,且纳入样本多为至内分泌科就诊的病例,存在一定的选择偏倚。今后需进一步扩大样本量,设计多中心、前瞻性研究来验证发生NCPHPT影响因素的灵敏度和特异度,并需要建立全面的随访体系以更深入了解NCPHPT的临床转归及预后。
综上所述,在临床表现方面,NCPHPT同样可导致糖代谢紊乱、骨密度降低、泌尿系统结石甚至慢性肾脏病的发生。合并泌尿系结石、血磷降低及AKP升高提示NCPHPT存在的可能,对诊断NCPHPT具有一定的预测价值。临床工作中,对于此类患者应当注重筛查PTH和甲状旁腺彩超,定期监测患者的代谢指标,早发现、早诊断NCPHPT并进行合理干预,以免漏诊、误诊。
作者贡献:黄泽宇分析资料、起草论文、统计分析并对论文整体负责;苏磊、桑剑锋实施研究并提供技术和材料支持;赵茹、韩晨、王茜选取研究对象并采集数据;顾天伟、毕艳、朱大龙指导论文并提供资助;沈山梅负责审核究结果、指导修改论文,负责最终版本修订并对论文整体负责。
本文无利益冲突。

