4-辛基衣康酸减轻脂多糖诱导的心肌损伤
李彬 刘江文 王凤媛 文英 蒋学俊
(武汉大学人民医院心内科 武汉大学心血管病研究所 心血管病湖北省重点实验室,湖北 武汉 430060)
脓毒症是临床上一种常见的全身性疾病,极易进展为多器官衰竭,进而导致患者死亡[1-2]。其中,脓毒症引发的以左心室扩张和左室射血分数(left ventricular ejection fraction,LVEF)降低为特征的心肌损伤在脓毒症并发症中最为常见,是导致患者死亡的重要原因[3]。目前临床缺乏有效的特异性治疗方法。因此,寻求新的治疗方案以减轻脓毒症引发的心肌损伤是目前临床亟待解决的问题。新近研究[4]显示,作为三羧酸循环代谢物的衣康酸在活化的巨噬细胞中高度诱导,可显著抑制炎症反应。其作用机制主要是使Kelch样环氧氯丙烷相关蛋白1的半胱氨酸残基151、257、288、273和297烷基化,并阻止它与核转录因子红系2相关因子2(nuclear factor-erythroid 2-related factor 2,Nrf2)结合,使Nrf2易位到细胞核,上调下游抗氧化反应相关基因的表达,从而抑制氧化应激[5],同时4-辛基衣康酸(4-octyl itaconate,4-OI)还可抑制p65的磷酸化以及pp65的入核[6]。4-OI是一种细胞通透性衣康酸衍生物,具备潜在的减轻脓毒症引发的心肌损伤的应用价值,但尚无研究证实。因此,本研究拟探究4-OI对脂多糖(lipopolysaccharide,LPS)诱导的心肌损伤的影响,以评估4-OI在脓毒症引发的心肌损伤方面的治疗价值。
1 材料和方法
1.1 动物与分组
6~8周雄性C57BL/6J小鼠,购自北京维通利华实验动物技术有限公司,饲养于武汉大学动物实验中心,无特定病原体条件下,随机分为3组。Control组(n=10):腹腔注射等量生理盐水连续3 d;LPS组(n=10):腹腔注射等量生理盐水3 d后,腹腔注射LPS(10 mg/kg),构建LPS诱导的脓毒症造成的心肌损伤模型;4-OI组(n=10):腹腔注射4-OI(25 mg/kg)连续处理3 d后,腹腔注射LPS(10 mg/kg)。
1.2 药品与试剂
4-OI和LPS购自sigma公司,p65、pp65、谷胱甘肽过氧化物酶4(glutathione peroxidase 4,GPx4)、前列腺素内过氧化物合成酶2(prostaglandin endoperoxide synthase 2,PTGS2)、Nrf2和甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)抗体购自Cell Signaling Technology公司。
1.3 超声心动图检查
用1%戊巴比妥钠溶液腹腔注射麻醉小鼠,胸部备皮后固定,使用飞依诺公司的VINNO6超声仪描记M型心脏超声图像,测量LVEF、左心室短轴缩短率(left ventricular fractional shortening,LVFS)、左心室舒张末期内径(left ventricular end-diastolic diameter,LVEDd)和左心室收缩末期内径(left ventricular end-systolic diameter,LVESd),以评估左心室的结构及功能[7]。
1.4 苏木精-伊红染色
用1%戊巴比妥钠腹腔注射(90 mg/kg)安乐死处死小鼠,迅速开胸摘取心脏,4%多聚甲醛中4 ℃固定过夜。石蜡包埋,6 μm切片后行苏木精-伊红(hematoxylin and eosin,HE)染色,光学显微镜下观察并拍照。
1.5 Western blot检测
分离小鼠左心室心肌组织并冷冻在液氮中,用RIPA裂解液提取总蛋白,BCA蛋白质测定试剂盒定量蛋白浓度并用RIPA裂解液调整至同一浓度,后加入5X上样缓冲液,混匀并100 ℃加热10 min。采用SDS-PAGE电泳分离40 μg蛋白质,电转至PVDF膜。5%脱脂牛奶室温封闭1 h,然后与特定一抗工作液4 ℃孵育过夜[p65 1:1 000、pp65 1:1 000、GPx4 1:1 000、PTGS2 1:1 000、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)1:1 000、白介素-1β(interleukin-1β,IL-1β)1:1 000和GAPDH 1:1 500]。洗膜后,二抗工作液室温孵育1 h,使用ECL试剂盒激发化学发光信号,并用ImageLabTM软件检测。以GAPDH作为内参进行灰度分析。
1.6 统计学分析
所有数据均以平均值±标准误表示。使用GraphPad Prism 9软件,采用单因素方差分析法进行统计分析,P<0.05具有统计学意义。
2 结果
2.1 超声心动图检查结果
心脏超声检查结果显示(图1E和表1),与Control组相比,LPS组LVEF[(41.65±4.49)% vs(80.32±2.43)%,P<0.001]和LVFS[(17.16±2.92)% vs(41.84±2.31)%,P<0.001]显著降低,LVESd[(3.05±0.16)mm vs(2.17±0.12)mm,P<0.001]显著增加。与LPS组相比,4-OI组LVEF[(60.93±4.26)% vs(41.65±4.49)%,P<0.001]和LVFS[(28.89±2.64)% vs(17.16±2.92)%,P<0.001]得以保留,LVESd[(2.50±0.12)mm vs(3.05±0.16)mm,P<0.001]明显缩小(图1A、图1B和图1C)。三组之间LVEDd无显著性差异(图1D)。

表1 三组小鼠超声心功能比较
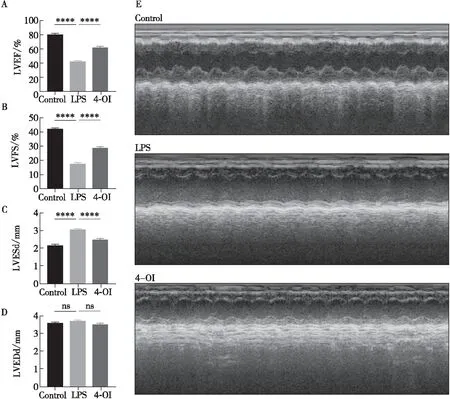
注:****表示P<0.001,ns表示P>0.05。
2.2 病理学检查结果
HE染色显示,与Control组相比,LPS组小鼠心脏表现出明显的炎症细胞浸润以及心肌细胞排列疏松,该表现类似于脓毒症诱导的心肌损伤的病理特点。与LPS组相比,4-OI组小鼠心脏炎症细胞浸润程度较低,心肌细胞排列较紧密(图2)。
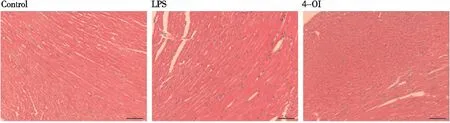
注:HE染色,200倍。
2.3 Western blot检测结果
Western blot检测结果显示,与Control组比较,LPS组小鼠心肌组织中Nrf2和GPx4的表达明显降低(P<0.05),IL-1β、TNF-α、PTGS2(P<0.05)和pp65/p65(P<0.01)的表达明显升高;与LPS组相比,4-OI组小鼠Nrf2(P<0.01)和GPx4(P<0.05)的表达明显升高,IL-1β、TNF-α、pp65/p65(P<0.05)和PTGS2(P<0.01)的表达明显下降(图3)。LPS组小鼠心肌组织中的pp65/p65(P<0.01)、TNF-α和IL-β(P<0.05)的表达上调,Nrf2(P<0.05)的表达下调,而PTGS2(P<0.05)的表达上调,GPx4(P<0.05)的表达下调;与LPS组相比,4-OI组小鼠心肌组织中的pp65/p65、TNF-α和IL-β(P<0.05)的表达下调,Nrf2(P<0.01)的表达上调,而PTGS2(P<0.01)的表达下调,GPx4(P<0.05)的表达上调。
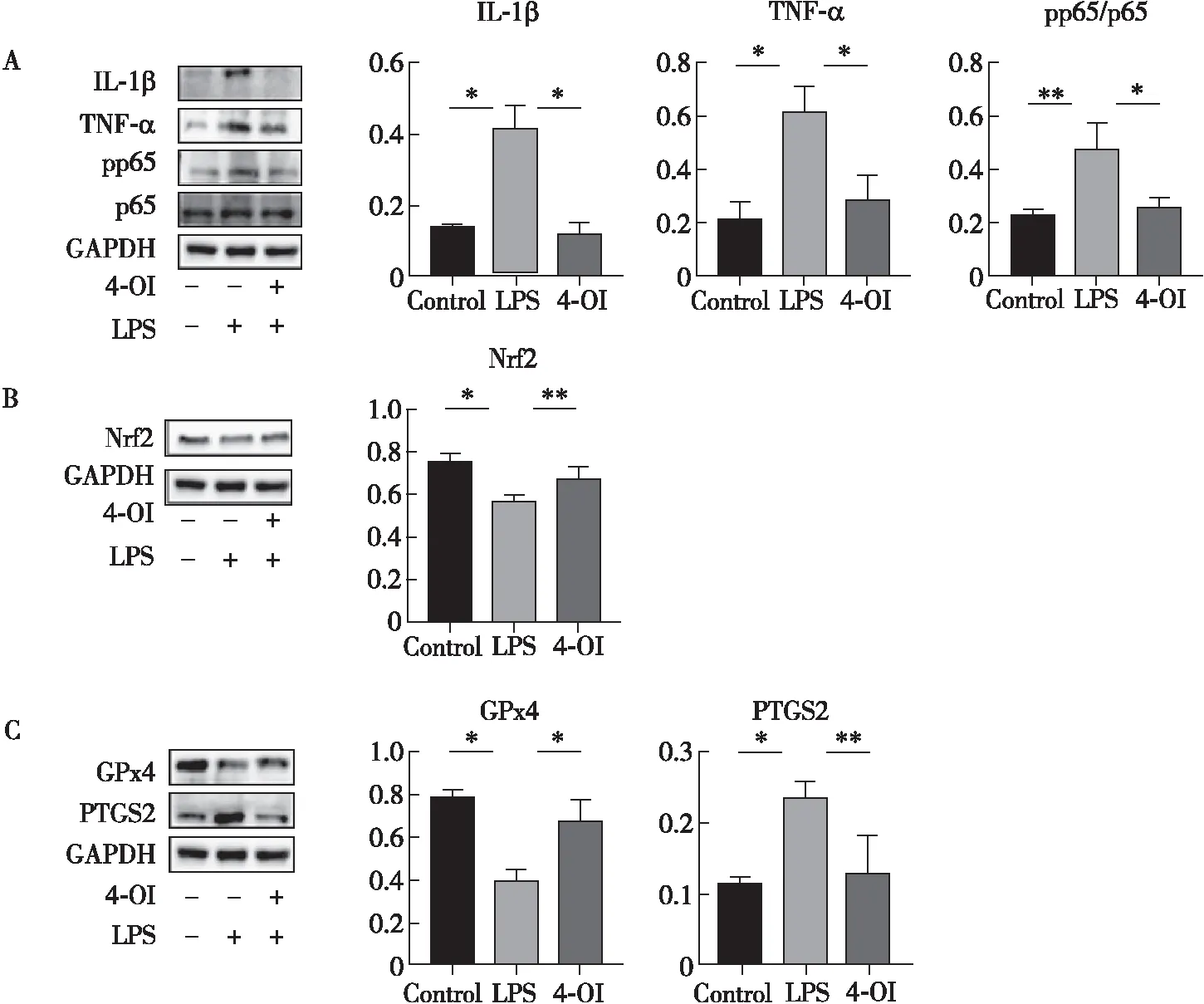
注:图A,炎症相关蛋白的改变;图B,Nrf2的改变;图C,PTGS2和GPx4的改变(*表示P<0.05,**表示P<0.01)。
3 讨论与结论
脓毒症是一种常见的全身性炎症疾病,易进展为多器官功能衰竭,患者死亡率极高,尤以合并有心肌损伤时更为严重[8]。虽然脓毒症诱发的心肌损伤是一个可逆的过程,但其仍是导致脓毒症死亡率高的主要原因[9]。因此,在脓毒症患者的治疗中,减轻脓毒症引发的心肌损伤的治疗尤为重要,是降低脓毒症患者临床死亡率的重要措施。既往研究[1]表明,炎症反应和氧化应激是脓毒症患者发生心肌损伤的两个重要发病机制。LPS可结合并激活巨噬细胞膜上的Toll样受体,促进p65的磷酸化以及pp65入核,促使包括TNF-α和IL-1β在内的促炎症因子表达上调[10],激活炎症细胞直接损伤心肌细胞并抑制其收缩功能[11],临床表现为LVEF及LVFS下降。另一方面,严重感染导致心肌细胞线粒体呼吸链酶复合物Ⅱ功能障碍,导致电子传递方向逆转,诱发氧化应激,并对脂质、蛋白质和DNA等细胞组成成分产生直接损害[12],还可进一步阻止缺氧诱导因子-1α的降解,最终上调促炎性细胞IL-1β的转录,加重炎症。GPx4作为一种抗氧化成分,在氧化应激时表达水平会明显下降,同时诱导PTGS2上调,进而导致脂质氧化[13-14]。
衣康酸是三羧酸循环中的代谢产物,具有抗炎和抗氧化应激作用,新近研究[2]显示,4-OI作为其衍生物可激活Nrf2,上调抗氧化应激反应相关基因的表达,同时可作用于p65蛋白抑制炎症相关蛋白的表达,具备潜在的减轻脓毒症引发心肌损伤的应用价值,但尚无研究证实。本研究结果表明,4-OI腹腔注射预处理能明显改善LPS腹腔注射后小鼠的心脏收缩功能,保护心脏结构的完整并缓解心肌组织的炎症浸润。4-OI的应用可明显缓解LPS诱导的心肌组织TNF-α和IL-1β等炎症因子的增加,抑制p65磷酸化。其机制可能与4-OI抑制p65的磷酸化,进而减少pp65入核以及下调促炎因子的表达有关。同时,4-OI的应用可激活Nrf2,抑制LPS腹腔注射后导致的心脏GPx4水平下降及PTGS2水平上调,最终抑制氧化应激反应,从而保护心肌。
综上所述,4-OI的预处理可能通过上调Nrf2的表达,降低p65的磷酸化水平来抑制炎症并发挥抗氧化应激作用,从而减轻LPS诱导造成的心肌损伤,但具体作用机制还有待深入研究。