经皮冠状动脉介入治疗围手术期抗栓治疗的演变
金冉阳 刘德敏 崔炜
(河北医科大学第二医院心内科, 河北 石家庄 050000)
经皮冠状动脉介入治疗(percutaneous coronary intervention,PCI)于20世纪70年代后期首次提出作为冠状动脉旁路移植术的替代方法。最初,由于支架内血栓形成以及支架内再狭窄等风险,极大地限制了其应用[1]。而90年代初出现的PCI围手术期抗栓治疗,以增加出血为代价,极大地减少了支架相关缺血事件的发生,显著地提高了PCI的安全性。目前,PCI已成为临床上治疗冠心病的主要方法之一[2]。
近年来,随着各种高效新型抗凝剂的不断涌现以及PCI技术的发展,PCI后缺血事件的发生率显著降低。人们的视线也逐渐转移到其出血风险的增高。越来越致力于在确保预防血栓事件和防止出血风险过度增加之间取得平衡[3]。现就近年国内外PCI围手术期的抗栓治疗的演变进行分析,希望能为未来国内PCI围手术期抗栓治疗的应用提出一些建议。
1 P2Y12受体拮抗剂选择的演变
阿司匹林和P2Y12受体拮抗剂组成的双联抗血小板治疗(dual antiplatelet therapy, DAPT)一直是所有接受选择性PCI患者治疗的基石[4]。氯吡格雷也一直被作为经典的P2Y12受体拮抗剂用于PCI围手术期的抗血小板治疗。而随着替格瑞洛、普拉格雷等新型P2Y12受体拮抗剂的出现,人们对于P2Y12受体拮抗剂的选择开始有了新的认知。《2018 ESC/EACTS心肌血运重建指南》[5]中指出,对于稳定型心绞痛患者,氯吡格雷仍被作为P2Y12受体拮抗剂的最优选推荐用于选择性支架植入术。而对于急性冠脉综合征患者,《2017 ESC关于ST段抬高型急性冠脉综合征管理指南》[6]和《2020 ESC非持续性ST段抬高型急性冠脉综合征患者的管理指南》[7]均将普拉格雷和替格瑞洛代替氯吡格雷作为P2Y12受体拮抗剂的最优选推荐用于选择性支架植入术,而且在《2020 ESC非持续性ST段抬高型急性冠脉综合征患者的管理指南》中甚至将普拉格雷的优先级置于替格瑞洛之前(如图1)。
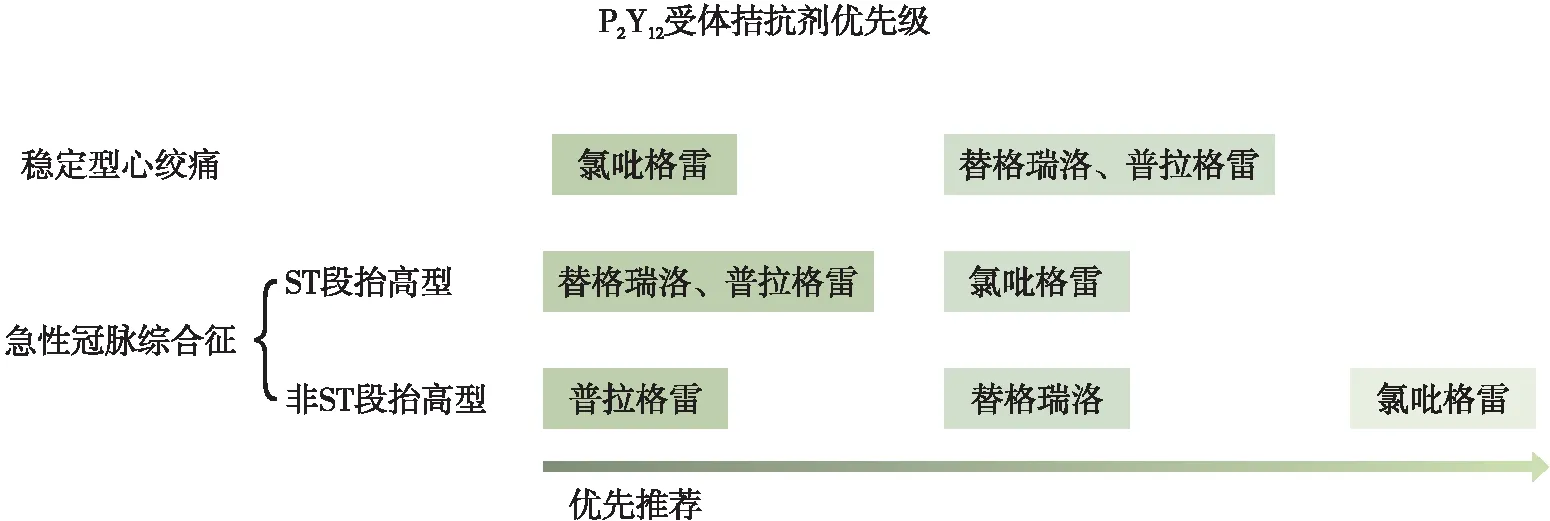
图1 P2Y12受体拮抗剂优先级指南推荐
尽管新型P2Y12受体拮抗剂解决了氯吡格雷起效缓慢和异质血小板抑制特性的问题,且指南也越来越推荐普拉格雷和替格瑞洛的应用,但近年来对于新型P2Y12受体拮抗剂的应用争论不休。普拉格雷和替格瑞洛作为第三代P2Y12受体拮抗剂,不论是在对血小板的作用强度还是起效时间方面都明显优于氯吡格雷,但其相应的出血风险也明显增加[8]。近年来,随着最新一代药物洗脱支架(drug-eluting stent,DES)和更有效的P2Y12受体拮抗剂的使用,极大地减少了PCI后心肌梗死、支架内血栓形成等缺血事件的风险。而随着缺血事件的减少,人们的视线也逐渐聚焦于术后出血事件的发生,追逐缺血获益和出血风险之间的最佳平衡[9]。近几年越来越多的研究[4,10-11]发现,与氯吡格雷相比,替格瑞洛、普拉格雷对急性冠脉综合征患者产生稳定的血小板聚集抑制作用,但其支架内血栓形成、心肌坏死等主要不良心血管事件的发生率并无显著差异。在一项随机对照临床试验[8]中,大多数急性冠脉综合征患者接受了新一代DES治疗后,相较于新型P2Y12受体拮抗剂,基于氯吡格雷的DAPT显示出良好的结果。Fujisaki等[12]一项关于10 792例老年急性冠脉综合征患者的荟萃分析发现,与氯吡格雷相比,新型P2Y12受体拮抗剂发生主要不良心血管事件的风险相似(HR=0.94,95%CI0.85~1.06),全因死亡率的风险相似(HR=0.89,95%CI0.74~1.07),降低了心血管死亡风险(HR=0.82,95%CI0.68~0.98),但增加了大出血的风险(HR=1.27,95%CI1.04~1.56)。而在亚组分析中,与氯吡格雷比较,替格瑞洛降低了全因死亡率(HR=0.73,95%CI0.55~0.98)和心血管死亡风险(HR=0.70,95%CI0.54~0.90)。目前普遍认为这可能与研究中使用了不同种类的支架有关。与裸金属支架相比,DES与更快的再内皮化和更低的血栓形成风险相关。这可能会在结果中引入偏差。但这也同样提示,尽管新型P2Y12受体拮抗剂较氯吡格雷抗血小板作用更强且更稳定,但其出血风险也更高,对于主要不良心血管事件、全因死亡率等风险仍有待探究。
2 P2Y12受体拮抗剂负荷量给予的演变
自PCI发展以来,无论何种PCI前常规要给予负荷量。随着近年来临床研究的探索,人们对于负荷量的应用越来越严苛。对于稳定型心绞痛,《2018 ESC/EACTS心肌血运重建指南》[5]指出,术前氯吡格雷负荷量的给予则仅限于在某些有较高PCI可能性的患者或在分期PCI前,不推荐广泛的氯吡格雷负荷量的给予。而对于急性冠脉综合征患者,《2020 ESC非持续性ST段抬高型急性冠脉综合征患者的管理指南》[7]也将对于较高PCI可能性和明确的行择期PCI的患者推荐给予相应的负荷量,更改为仅推荐明确的行择期PCI的患者推荐给予相应的负荷量,而对于一直接受DAPT维持治疗的冠状动脉情况不清的早期介入治疗患者,则不推荐给予负荷量。
PCI前通常给予P2Y12受体拮抗剂负荷量,但近年来不论是指南还是一些临床研究对术前负荷量的给予越来越持保守态度。也有大量的国外研究[13]显示,在使用DES进行PCI后具有高治疗反应性的患者中,与标准剂量氯吡格雷相比,大剂量氯吡格雷的使用并未减少因心血管原因、心肌梗死或支架内血栓形成而导致的死亡。而在接受择期PCI的ST段抬高心肌梗死患者中,替格瑞洛负荷量的给予并未比标准剂量的抗血小板作用起效快,也并未显著降低PCI后的心肌坏死[14]。普拉格雷剂量30 mg与普拉格雷剂量60 mg一样有效,且低剂量的普拉格雷轻微出血的发生率明显降低[15]。一项纳入7项试验,13 226例患者的荟萃研究[16]发现,非ST段抬高心肌梗死患者在血管造影前使用口服P2Y12受体拮抗剂进行预处理与出血风险增加相关,并且心血管结局无差异。鉴于近年来大量的临床试验并未显示出P2Y12受体拮抗剂负荷量给予对于主要不良心血管结局的影响,反而还会影响之后可能的急诊冠状动脉搭桥术的实施,国际对于负荷量的应用越来越严苛。但这些大多是基于DES的选择以及国外目前对于P2Y12受体拮抗剂优先推荐普拉格雷的结果。中国大多数患者应用的还是阿司匹林+氯吡格雷的经典DAPT方案,且DES尚未完全普及。社区医院无相关设备设施,无法准确地评估患者病情,太过保守的负荷量选择,可能会影响转院后急诊PCI的实施。中国实施急诊冠状动脉搭桥术的例数相对较少,不用担心负荷量的使用对后期急诊冠状动脉搭桥术可能的影响。
3 单药抗血小板治疗药物选择的演变
阿司匹林作为环氧合酶-1抑制剂,抑制血栓烷A2的合成,从而导致血小板功能的不可逆抑制[17]。由于其独特的作用方式以及强大的抗血小板作用,阿司匹林一直被公认为是心血管疾病一线抗血小板药,被推荐为DAPT的基石,以及单药抗血小板药的首选[18]。然而随着人们近年的不断探索,阿司匹林也逐渐落下神坛[19]。《2020 ESC非持续性ST段抬高型急性冠脉综合征管理指南》[7]推荐阿司匹林仍是DAPT的基石,但对于单药抗血小板治疗的选择发生了巨大转变。根据对患者出血风险以及抗血小板药作用强弱的评估,出血风险极高者优先选用氯吡格雷,出血风险高者优先选用阿司匹林,出血风险低者则优先推荐替格瑞洛。单药抗血小板药的选择不再是单一的阿司匹林,而是更倾向于通过对于患者缺血、出血风险以及各种抗血小板药的不同特性进行评估选择(如图2)。
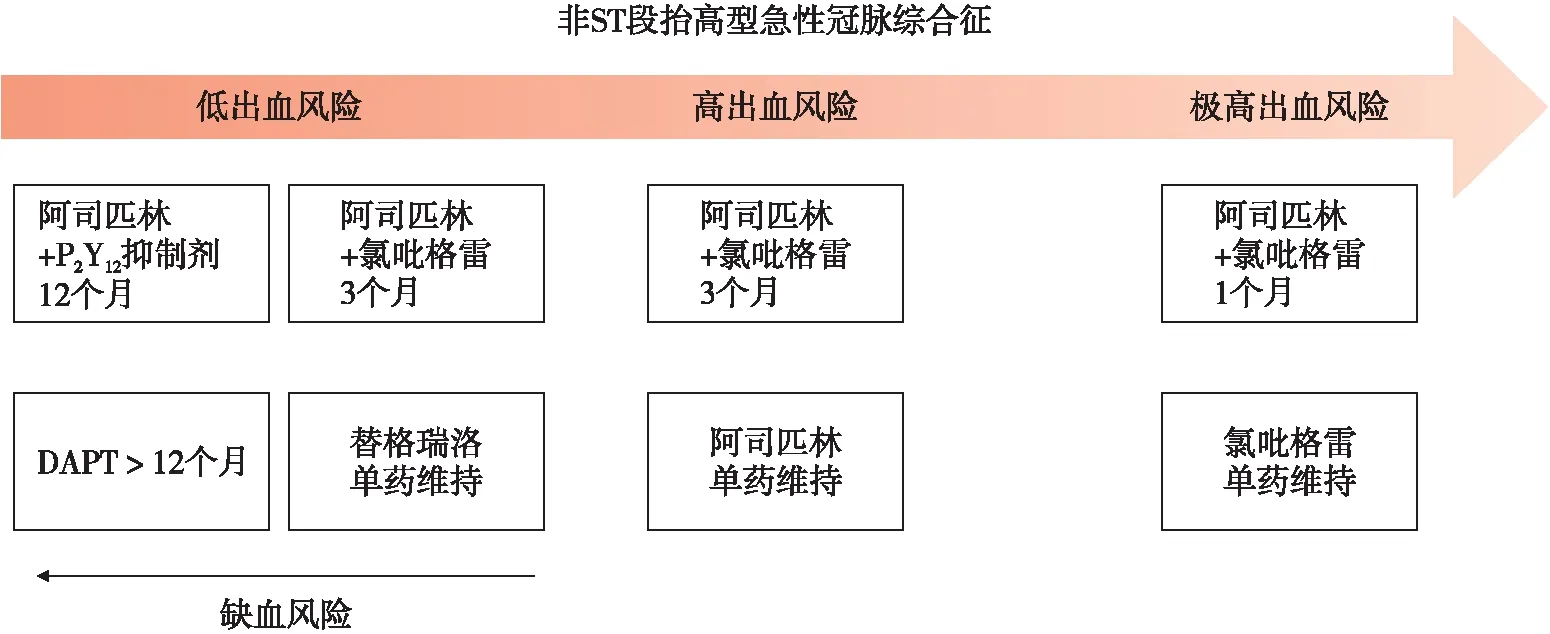
图2 《2020 ESC非持续性ST段抬高型急性冠脉综合征管理指南》关于PCI后抗凝推荐
随着人们对抗血小板观念的不断改变,抗血小板药的选择越来越精细,不仅是指南中提出的对于出血风险以及抗血小板药作用强弱的评估,更多研究开始试图探索更为个性化的抗血小板治疗方案。10%~40%接受PCI的患者对氯吡格雷有抵抗力,这导致血小板聚集降低不足(治疗时血小板反应性高),并导致主要不良心血管事件的发生率显著增加。而对于CYP2C19*1、CYP2C19*2、CYP2C19*3和CYP2C19*17快速床旁基因检测,可一定程度上避免这种现象[20]。 一项有关基因型指导的抗血小板个性化治疗的荟萃分析[21]显示,与常规组相比,基因引导组高血小板反应性(HR=0.32,95%CI0.18~0.55,P<0.000 1),全因死亡率(HR=0.55,95%CI0.37~0.83,P=0.005 ),心肌梗死(HR=0.43,95%CI0.27~0.67,P=0.000 2)和支架内血栓形成(HR=0.39,95%CI0.16~0.97,P=0.004)的风险明显降低。同时,也有研究[22-23]表明,通过检测抗血小板药应用过程中血小板的功能,可更好地指导抗血小板药的选择,在不增加缺血风险的情况下降低大出血风险。在一项涉及2 237例患者的随机对照试验[24]中发现,与标准组相比,根据血小板聚集率进行个性化抗血小板治疗,个性化组在PCI后30 d的净临床不良事件(包括缺血和出血事件)显著减少(1.5% vs 3.0%,HR=0.510,95%CI0.284~0.915,P=0.020),且在180 d随访中两组主要出血事件(2.1% vs 1.6%,P=0.364)未发现显著差异。尽管这些研究都还处于试验阶段,其有效性还有待考究,但抗血小板治疗的个性化方案已成为一种趋势。未来抗血小板药的选择方向会更加致力于排除个体异质性的影响,制定出更适合个人的抗血小板治疗方案。
4 DAPT的药物选择以及时长的演变
DAPT仍是预防PCI后缺血事件的基础疗法。然而随着支架技术的发展以及DES的普及,PCI后DAPT的最佳持续时间备受争议。《2017 ESC关于ST段抬高型急性冠脉综合征管理指南》[6]认为,对于低出血风险的PCI后急性冠脉综合征患者均应进行至少12个月的DAPT。《2018 ESC/EACTS心肌血运重建指南》[5]提出,对于稳定型心绞痛行PCI的患者,可根据出血风险酌情调整DAPT的时间为3~6个月,对于非ST段抬高型急性冠脉综合征以及ST段抬高心肌梗死PCI后的患者,可根据出血风险调整DAPT的时间为6~12个月。《2020 ESC 非持续性ST段抬高型急性冠脉综合征管理指南》[7]则指出,对于非ST段抬高型急性冠脉综合征PCI后的患者,出血风险低但缺血风险高的应给予DAPT至少12个月,而对于缺血风险低的可给予阿司匹林+替格瑞洛3个月后改为单药替格瑞洛;出血风险高者,可先给予阿司匹林+氯吡格雷3个月,后改为阿司匹林单药应用9个月;出血风险极高者,可先给予阿司匹林+氯吡格雷3个月,后改为氯吡格雷单药应用9个月;由此可看出,指南的变化越来越趋向于在保证患者缺血风险低的情况下,降级DAPT的应用,以降低患者出血的风险,同时也越来越注重患者个体化的选择。
O’Donoghue等[25]最新一项荟萃研究也显示,在32 145例使用第二代DES进行PCI的患者中,与延长DAPT的应用时间相比,应用DAPT 1~3个月,而后应用单药阿司匹林或P2Y12受体拮抗剂,并未增加患者支架内血栓形成、全因死亡以及心肌梗死的风险,但其出血的风险明显降低。Valgimigli等[26]的一项关于高出血风险的PCI后患者的前瞻性研究中,使用钴铬依维莫司洗脱支架接受DAPT 1个月后改为阿司匹林单药治疗与接受DAPT 3个月后改为阿司匹林单药治疗,两组患者具有相似的缺血事件发生率,而出血风险降低。目前指南推荐不论何种患者,PCI后至少应用DAPT 3个月,但近期的研究均趋向于更短的DAPT时间,这些研究均表明在保证不增加缺血风险的基础上,更倾向于缩短DAPT的应用时间,以求降低出血风险。当然,这些研究结果均基于二代DES的结果,相对于金属裸支架,其本身支架内再狭窄的风险较低。因此,对于应用金属裸支架的患者,DAPT的应用应更谨慎。但不难看出,未来抗血小板药的选择将不再仅着眼于降低缺血风险,而是更加注重在不增加缺血风险的基础上将出血风险降到最低。
5 可逆性环氧合酶抑制剂在PCI中应用的演变
随着各类新兴抗血小板药的发展,阿司匹林也逐渐跌下神坛。尤其是对于阿司匹林不耐受的患者,寻求有效的替代治疗至关重要。在阿司匹林过敏的情况下,大多数医生会选择使用替代药物或单独使用氯吡格雷。对于单药替代阿司匹林,无论是氯吡格雷(正常或双剂量)、普拉格雷或替格瑞洛,并无相关研究显示其对支架内血栓形成、早期再出血或出血的影响[27]。而以吲哚布芬为代表的可逆性环氧合酶抑制剂,作为阿司匹林不耐受者的替代治疗开始逐渐被大家接受。来自Barillà等[28]的研究显示,应用吲哚布芬联合氯吡格雷替代阿司匹林显示出更强大的血小板抑制作用[(73.67±19.92)% vs (31.79±27.33)%,P<0.000 1],吲哚布芬联合氯吡格雷组患者最大血小板聚集值更低[(28.53±21.32)% vs (73.58±17.71)%,P<0.000 1],二磷酸腺苷最大抑制百分比更高[(14.23±18.92)% vs (10.30±18.97)%,P=0.23],1周和1个月的血清血栓烷B2产量更低[分别为(2.6±1.6)ng/mL和(3.0±2.7)ng/mL,P=0.82]。尽管至今还无相关指南推荐,但可逆性环氧合酶抑制剂作为阿司匹林不耐受患者的替代治疗方案已逐渐走进大众的视野。
6 展望
近年来,随着一些新型抗血小板药以及抗凝药物的不断涌现,PCI围手术期抗栓治疗日趋多样化。PCI发展初期,抗栓药物治疗极大地减少了PCI后心肌梗死、支架内血栓形成等缺血事件的风险[29]。但近年来随着缺血事件的减少,抗栓治疗后出血事件的出现逐渐引起了人们的重视。对PCI前负荷量的给予越来越严苛[13],术后应用新型P2Y12受体拮抗剂的单药抗血小板治疗逐渐代替传统的DAPT[25]。DAPT的时长选择以及对P2Y12受体拮抗剂药物的选择更趋于个体化[22-23]。这些均表明,在抗栓药物的选择时,在减少缺血事件的基础上,越来越注重于出血事件的减少。而且不再拘泥于传统的药物搭配,结合每一种抗栓药物的特性,力求在达到最好的改善预后的同时,将出血风险降到最低。
当然,目前这些结果大多是基于国外二代DES的应用以及新型P2Y12受体拮抗剂的普及。例如国外对于PCI前负荷量的给予越来越严苛,一方面是由于近年来多项临床大数据显示,术前负荷量的给予并未起到更好的减少缺血事件发生的效果,反而增加了相关出血的风险[16];另一方面考虑到PCI前负荷量的应用可能会影响到之后急诊冠状动脉搭桥术的实施[7]。但这些临床试验大多是基于替格瑞洛的结果,可能并不适用于国内。目前国内氯吡咯雷的使用更为普遍且急诊冠状动脉搭桥术较为少见。因此,基于国内现状,PCI术前负荷量的给予还是有一定必要的。对于国内的抗栓治疗,不能照搬国外的指南推荐,应学习国外的抗栓理念。不再拘泥于传统的药物搭配,结合每一种抗栓药物的特性,将抗栓治疗更趋于个体化,在达到最好的改善预后的基础上,将出血风险降到最低。