针刺督脉组穴对血管性痴呆大鼠海马CA1区NGB与 HIF-1α表达的影响
胡培佳,程红亮,4,杨超,张闻东,李青海,张宜廷
1 安徽中医药大学第二附属医院 安徽合肥 230000
2 浙江省上虞中医医院 浙江绍兴 312300
3 安徽中医药大学 安徽合肥 230000
4 安徽中医药大学针灸临床研究所 安徽合肥 230000
血管性痴呆(Vascular dementia,VD)是继发于多种脑血管损伤的一大类以记忆减退和严重认知功能障碍为临床表现的综合征,病情严重的VD患者甚至生活不能自理,该病最主要原因包括脑动脉闭塞、脑出血[1]。调查发现,过去5年,我国VD发病率逐年攀升,在50岁以上中老年人口中,VD发病率是0.8%,其中75岁以上人口占比高达80%[2],且令人担忧的是该病呈现出年轻化趋势。随着我国社会老龄化程度的不断推进,预计到2040年,VD的患病率将翻一番[3],这将给患者家庭和社会造成极大的负担。目前西医在治疗VD方面暂没有令人满意的策略[4],而中医针刺对于VD的防治有较好的疗效[5],但其作用机制尚不清楚。笔者认为针刺可能通过调节脑组织的血氧代谢,近而起到保护脑部神经元的作用。本研究通过建立VD大鼠模型,观察针刺督脉组穴对VD大鼠海马CA1区Ngb和HIF-1α表达的影响,并探究针刺防治VD的神经保护机制。
材料与方法
1 材料与仪器
1.1 实验动物 雄鼠60只,SD级,体重230~270g,3月龄,购自济南朋悦实验动物繁育有限公司,动物许可证号:SCXK(鲁)2014-0007。喂养地点:安徽中医药大学实验动物饲养中心,温度21~25℃,湿度50%,饲料选用实验鼠专用豆粕饲料,每日灯光明/暗交替时间为18/6h。
1.2 筛选与分组 为减少大鼠先天差别对研究的干扰,将喂养一周后的全部大鼠依次放入Morris水迷宫中连续训练3d,5min/d,第4d时挑选出反应较恒定的36只大鼠作为最终研究对象。采用Excel随机排序法将大鼠分为电针组、模型组和假手术组,每组12只,接下来电针组、模型组将作造模处理,假手术组作假手术处理。
2 方法
2.1 VD大鼠模型复制方法 通过反复三次阻断双侧颈总动脉血流后永久性结扎颈总动脉制作VD大鼠模型[6]。具体步骤为:所有待造模大鼠禁食不禁水12h后,称重,采用巴比妥钠腹腔注射麻醉(药物浓度2%,剂量200mg/kg)。麻醉约5min后用血管钳夹持大鼠尾部,确保大鼠无疼痛反应后将其仰卧放置,用橡皮筋固定四肢和头部,拉直其颈部剃毛,常规手术区域消毒,备皮,用手术刀划开颈部皮肤,逐层分离肌肉层直到颈总动脉,用玻璃分针将与颈总动脉并行的交感神经钝性分离,随后夹闭颈总动脉20min,然后释放10min,此阻断和恢复脑血流步骤共重复三次,期间密切关注大鼠生命体征,呼吸心跳不规则的大鼠可适当缩减夹闭时间。首次夹闭颈总动脉5min后,剪断大鼠尾部最后1cm,放血约0.2mL,第三次释放动脉夹30min后,用4号无菌细线对生命体征稳定的大鼠两测颈总动脉近心端、远心端作永久性结扎,并剪断结扎中点,随后缝合切口,并在接下来两周内每日对切口进行常规消毒。三组大鼠手术步骤相同,但假手术组大鼠颈总动脉血流不作阻断。
2.2 治疗方法
2.2.1 电针组 造模成功后,对大鼠进行针刺干预,穴位参考《实验针灸学》[7]大鼠标准穴位图谱,选取“百会”(平刺2.5mm)、“神庭”(平刺2.5mm)、“大椎”(直刺5mm)、“风府”(斜刺5mm)。百会和神庭连接一对电极,大椎和风府连接一对电极,刺激电流选择疏波,频率2Hz,强度1.1mA(峰-峰值),波宽300μs。1次/d,30 min/次,每治疗6d,休息1d,连续治疗2周。
2.2.2 假手术组、模型组 与电针组同步开始,但仅作相同的固定。
2.3 Morris水迷宫实验 为减少测试环境对大鼠造成的影响,测试开始前1d,将大鼠放于水迷宫内随意活动2min。第2d起,每日对大鼠进行测试,每只大鼠每次的测试时间最长2min,将大鼠放入固定起始点后用计时器记录大鼠找到登陆平台的总用时,该时长又称逃避潜伏期,在此期间未能到达登陆台的大鼠,则该次用时计为2min,并引导其顺利到达登陆点。第6d撤去登陆台,按相同方法将大鼠放入水中,让其寻找记忆中的登陆点,时间2min,记录每只大鼠经过登陆点的次数。
2.4 石蜡切片Tunel法观察细胞凋亡 采用石蜡切片Tunel法制作观察样本。具体步骤为:取脑组织前将水迷宫实验完成后的大鼠作禁食不禁水12h处理,麻醉药物及方法同手术处理,麻醉完成后,从大鼠颈椎上部点切断其头部,将头放置于冰盘上,剥离头骨和其它脑组织,迅速取出脑内CA1区海马组织。将海马依次放入三杯10mL二甲苯溶液中,每杯时间15min,再将海马依次放入三杯浓度分别为100%、95%、80%乙醇中,每杯时间5min。将染色架连同切片放于洁净玻璃盘中,于缓慢流动的自来水下漂洗,以切片干净透明为度。在36℃下用ProteinaseK溶液处理切片20min,PBS清洗3遍,过氧化物酶封闭20~30min,于标本上滴入50uL的Tunel反应液(50uL TdT+450uL dUTP)后放入36℃反应盒中静置1h,再次PBS清洗3次,滴入50uLPOD后将标本放入36℃反应盒中静置30min,继用PBS清洗3遍,最后采用DAB显色,蒸馏水冲洗,终止显色,苏木素复染,盐酸酒精分化数秒,碳酸锂蓝化1min,水洗,脱水透明,中性树胶封片。
2.5 检测海马中ATP浓度 取出的大鼠脑内CA1区海马组织,采用ATP检测试剂盒检测海马中ATP浓度。计算公式:组织中ATP浓度(μmol/mgprot)=(测定OD值-对照OD值)/(标准OD值-空白OD值)*推荐值(1000μmol/L)/待测样品蛋白浓度。
2.6 Ngb、HIF-1α蛋白表达水平检测 取出的大鼠脑内CA1区海马组织,用NS漂洗与实验无关的组织和污物,随后按以下程序用Western blot法进行检测。
2.6.1 将海马组织切割成重量约为100mg的样本。
2.6.2 组织匀浆及蛋白的提取。
2.6.3 电泳 ①SDS-PAGE凝胶配制;②样品处理;③上样与电泳;④转膜;⑤封闭;⑥一抗孵育。
参照相关使用说明,用专用液稀释被过氧化物酶(HRP)标记的二抗(稀释比例为1:2万)。25℃下孵育2h。再于TBST液中漂洗3道,每道10min。最后根据检测说明书,采用ECL发光试剂盒进行检测。
2.7 p53RFPmRNA、NgbmRNA、HIF-1αmRNA检测
2.7.1 RNA提取 剥离好的海马组织称取50~100 mg剪切后放入EP管中,然后放入液氮中研磨,随后加入1mL TRIzol进行匀浆。为使上述组织完全裂解,将海马组织放置于离心机中,温度4℃,离心时间10min,转速12000rpm,离心完成再将0.2mL氯仿加入组织液中,充分震荡混合后在25℃环境内静置30min。在4 ℃的温度下将组织混合液用离心机以12000 rpm进行离心15 min,随后取大约500 μL的上清液放置于EP管中。滴入异丙醇0.5mL于EP管中,缓慢摇匀后在25℃环境内静置10 min,接着滴入1ml浓度为75%乙醇溶液(DEPC配置),4℃下离心5 min,结束后取出底层沉淀物,在25℃环境内静置干燥20min,待其干燥后即得到RNA沉淀。于干燥后的RNA沉淀物中加入DEPC水20~50μL,使用PCR仪,加热10 min,温度55℃,以促进RNA沉淀物充分溶解,完成将其放置于-80℃冷冻库内保存备用。
2.7.2 RT反应 先后于0.2mL的EP管中放入重量为1μg的总RNA和约12μ L10μMOligo(dT)1μL DEPC水,充分混合后离心10min。然后使用PCR仪,将混合液加热5min,温度65℃,结束后立即于0℃的冰水中静置3min。随后滴入10 mM dNTP Mix2 μL、Revert Aid TM M-MuLV Reverse Transcniptase、5×Reaction Buffer 4.0μL、RibolockTM Rnase inhibitor 1μL。接着依次在温度为42 ℃和70 ℃的保温箱内静置60 min和5 min。最后形成的mRNA即为实验所需,将其放置于-80℃冷冻库内保存备用。
3 统计学处理
统计分析使用SPSS22.0统计软件,其中组间比较使用单因素方差分析,结果以均数±标准差表示,P<0.05表示差异有统计学意义。
结 果
1 水迷宫实验结果
如图1所示,模型组大鼠的逃避潜伏期最长,其次为电针组,假手术组最短;假手术组跨越平台次数最多,其次为电针组,模型组最少。由此可见,针刺具有改善认知功能障碍的作用。
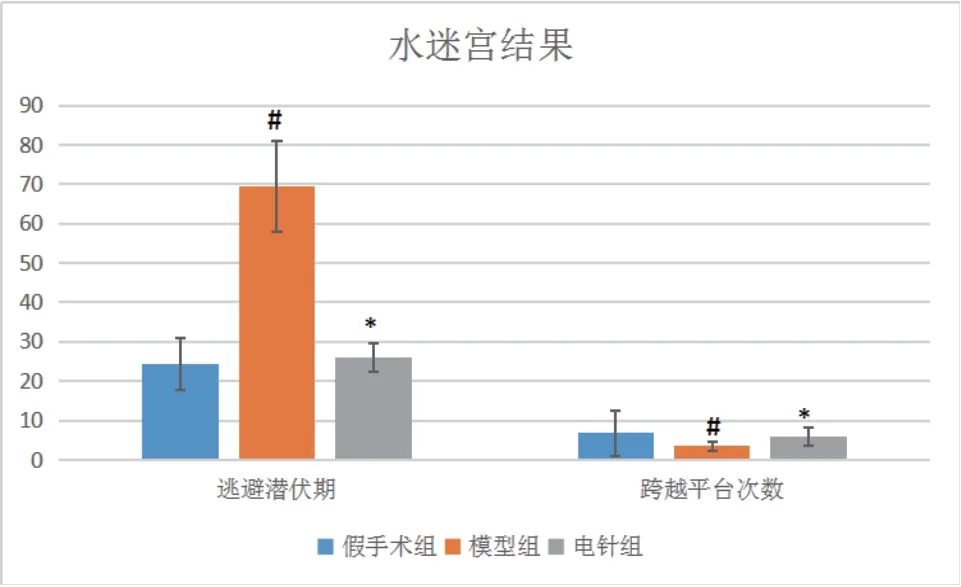
图1 治疗结束后三组水迷宫数据比较(±s,n=12)
2 Tunel切片结果
如图2所示,取海马大致相同部位为观察区域,镜下呈棕褐色显色的为凋亡细胞阳性反应物,模型组凋亡细胞数明显较电针组多,假手术组凋亡细胞数明显较模型组和电针组少。此结果说明针刺具有减缓神经细胞凋亡的作用。
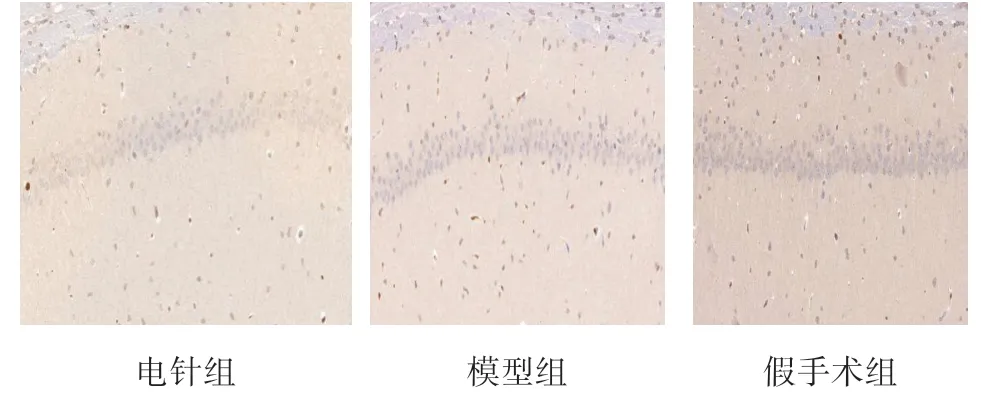
图2 Tune切片结果
3 海马中ATP浓度
如表1所示,假手术组海马组织中的ATP浓度明显高于模型组与电针组,而电针组又高于模型组。可见针刺治疗能显著增加ATP浓度,从而为细胞的再生提供良好的环境。
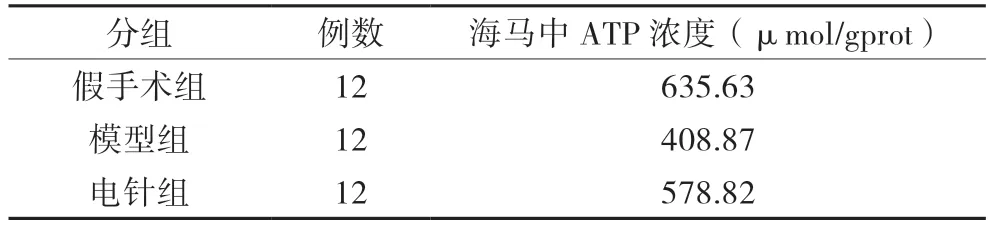
表1 三组海马中ATP浓度
4 Ngb、 HIF-1α 蛋白表达水平
采用Western blot法检测Ngb、HIF-1α蛋白,如图3所见,电针组大鼠海马组织中Ngb、HIF-1α蛋白表达水平高于其余两组,三组蛋白表达水平按照假手术组、模型组、电针组呈升高趋势;相较于假手术组,电针组的Ngb、HIF-1α蛋白表达水平升高幅度明显高于模型组。这表明针刺能促进Ngb、 HIF-1α表达,改善脑部病变部位缺血缺氧状态,进而缓解认知功能障碍。
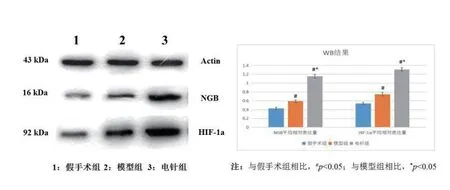
图3 三组大鼠海马组织中Ngb、HIF-1α蛋白表达比较(±s,n=12)
5 p53RFPmRNA、NgbmRNA、HIF-1αmRNA表达水平
采用RT-PCR法检测三种mRNA 的表达水平,结果如图4所示,电针组大鼠海马组织NgbmRNA、HIF-1αmRNA表达水平高于模型组和假手术组;相较于假手术组,电针组的NgbmRNA、HIF-1αmRNA表达水平升高幅度明显高于模型组;p53RFPmRNA的表达水平按模型组、电针组和假手术组呈下降趋势。实验数据说明,针刺通过促进NgbmRNA、HIF-1αmRNA 表达和抑制p53RFPmRNA表达来改善VD大鼠认知功能。以上数据差异均具有统计学意义(P<0.05)。
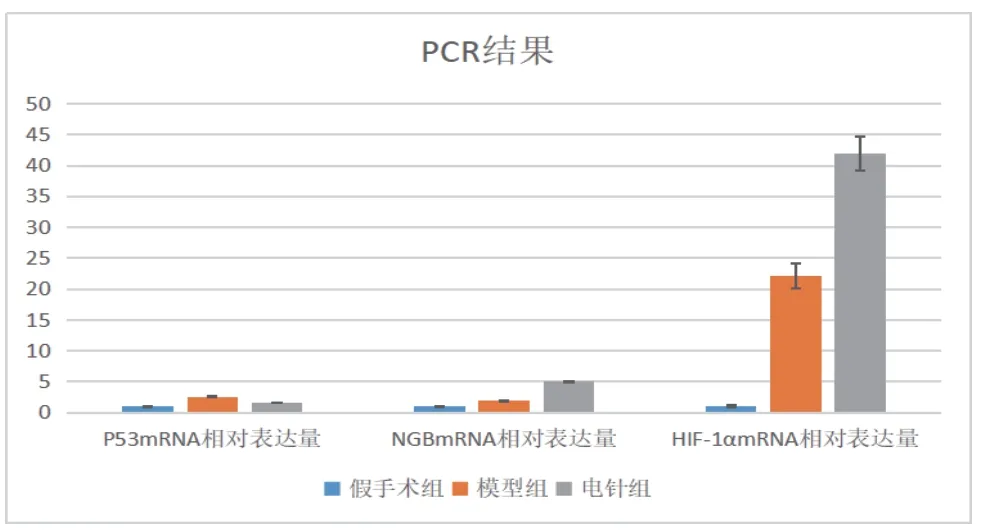
图4 三组大鼠p53 RFPmRNA、NgbmRNA、HIF-1αmRNA表达比较(±s,n=12)
讨 论
在我国,血管性痴呆(VD)的发病率呈逐年上述趋势,VD患者可出现严重的思维、认知、记忆、情绪和行为障碍,该病给中老年人日常生活造成了极大的困扰,同时也给患者家庭和整个社会带来极大的负担[9]。现有的大量影像学资料和尸检报告发现,脑灰质和白质深部小血管病变是引发VD的重要原因[10],且大脑的微小血管病变程度越高,患者认知障碍的程度越深。截止目前的大量临床研究、影像学资料和实验动物研究已能够确定VD患者脑内血流量较正常人存在不同幅度减少,由此得出的结论是增加脑血流量能减缓神经元凋亡和保护脑组织,从而起到防治VD的作用[11-14]。
中医学认为,VD的病位在脑,与督脉密切相关,核心病机是年老肾虚、阳气虚衰、脑髓空虚,治疗原则为调气血、通脑洛、温阳气。本课题组认为治疗VD需从通调督脉入手,《难经·二十八难》谓:“督脉者,起于下极之输,并于脊里,上至风府,入属于脑。”由此可见,若督脉得通,则阳气得畅,脑髓得养,精神得振。穴位选取百会、风府、大椎、神庭,百会又称“三阳五会”,能通达周身阴阳;风府又称“上椎”,靠近脑髓部,具有通督调神,安神定志之效,擅调节神机治疗脑疾;大椎为“三阳督脉之会”,既是通阳要穴,又能增神益智;神庭为调神之要穴,又居额叶前,而额叶部主管情志。以上四穴,我们在临床防治VD已经取得了确切疗效。
此次研究我们发现,发生脑栓塞时,VD大鼠体内HIF-1α表达水平迅速上升,脑组织缺血缺氧状态得到一定程度改善,并且接受针灸治疗的大鼠脑组织损伤程度较模型组轻。通过免疫组化和蛋白印迹分析检测内源性NSCs,结果显示,内源性NSCs受HIF-1α早期表达的影响,为脑神经元修复提供良好的环境[15-16]。Ngb是脑组织中特有的第三类载氧蛋白,多种信号转导通路的正常运行需Ngb的参与,该蛋白与脑的氧供关系十分密切,能清除带有神经毒性的氧化产物、减缓神经细胞受损、保护神经信号传递[17]。HIF-1α是一种异源二聚体,能增加机体对缺氧的耐受度,并促进病灶血管新生,当机体处于缺氧状况时,HIF-1α会被刺激表达,与Ngb共同增加脑组织的摄氧量。国外学者研究发现Ngb的表达与不仅与P53有关联,HIF-1α还能与P53相结合[18]。无独有偶,国内的研究发现Ngb的高表达能抑制Bax分泌[19],从而起到保护神经元的功能,并且认为可以通过检测Ngb含量来评估脑损伤的预后[20]。对于脑组织受保护的完整过程,我们推断是因为脑梗塞发生后某种通路被激活,从而使Ngb表达水平上升,该通路可能为“脑组织缺血缺氧刺激HIF-1α表达→P53与HIF-1α结合→Ngb表达水平上升→脑组织用氧率提升”。综上中外学者的研究,可以得出的结论是刺激体内Ngb和HIF-1α表达能改善认知功能障碍。该结论于本次研究结果相一致,即电针组脑组织恢复程度优于模型组,电针组大鼠认知障碍改善程度和Ngb与HIF-1α的表达呈现正相关。
本研究以反复三次阻断双侧颈总动脉血流后永久性结扎颈总动脉复制VD大鼠模型,以针刺督脉百会、大椎、风府、神庭为治疗方法,通过观察大鼠Morris水迷宫行为和检测海马CA1区NGB与HIF-1α表达水平,发现针刺能促进NGB和HIF-1α表达,发挥改善脑组织缺血缺氧状态和保护神经元作用,进而改善大鼠认知功能障碍。但是本研究的不足之处在于未能阐明NGB与HIF-1α发挥神经保护的水平时序变化关系,这将成为我们下一步研究的重点。

