NLRP3炎症小体在bEnd.3细胞氧糖剥夺及复氧复糖后的表达观察
徐雯琦,高 宇,李慧颖,南光贤
(吉林大学中日联谊医院 神经内科,吉林 长春130033)
脑卒中具有高死亡率及高致残率的特点,其死亡率在全球范围内位居第二[1],其所导致的长期残疾为家庭和社会带来了沉重的负担。治疗缺血性脑卒中最有效的策略之一是立即恢复大脑的血流,尽管这会导致进一步的细胞坏死和神经损伤,即缺血再灌注损伤。现阶段已经有关于缺血性卒中的研究[2-3]发现了先天免疫系统炎症相关的损伤机制引发了神经元和星型胶质细胞的死亡,进而导致神经功能缺损症状。且Endres等人[4]发现,缺血再灌注损伤可诱导强烈的炎症反应。NLRP3炎症小体是研究最深入的炎症小体,它是一种体内先天免疫机制形成的无菌性免疫复合体,其主要有NLRP3、凋亡相关斑点状接头蛋白ASC和下游效应酶procaspase-1组成。NLRP3炎症体促进caspase-1的激活,caspase-1将IL-1β和IL-18的前体裂解成活性形式,特异性地介导缺血性卒中期间对无菌组织损伤的炎症反应,并推动一种称为焦亡的炎性细胞死亡[5]。已经有研究[6]证实缺血性脑卒中后神经元死亡与炎症小体的激活有关,但是炎症小体激活是否参与缺血及缺血再灌注后血管内皮细胞损伤,其证据尚不充足。因为血脑屏障的破坏已经成为缺血及缺血再灌注后脑损伤的主要机制之一,所以研究血脑屏障的破坏机理尤为必要。已有动物实验研究[7-8]表明,NLRP3炎症小体通过减少梗塞面积和血脑屏障损伤改善了缺血性卒中后小鼠的脑损伤。为了进一步研究NLRP3炎症小体与缺血性脑卒中血脑屏障破坏的关系,本研究以bEnd.3细胞系为主要研究对象,观察在不同氧糖剥夺及复氧复糖时间点NLRP3炎症小体及其下游因子的表达变化。
1 材料和方法
1.1 实验细胞
bEnd.3细胞系购于ATCC
1.2 主要试剂、材料和仪器
DMEM无糖培养基(Gibico),DMEM培养基(Gibico),胎牛血清(Gibico),胰蛋白酶-EDTA消化液(0.25%)(Solarbio),抗NLRP3抗体(ABMART),抗β-actin抗体(Affinity),鼠二抗(Cell Signaling Technology),BCA蛋白定量试剂盒(Signalway),小鼠白介素IL-1β、IL-18Elisa试剂盒(Bioswamp)厌氧培养袋(日本三菱),厌氧袋产气包(日本三菱),恒温二氧化碳培养(Sanyo),显微镜(Nikon),垂直板电泳槽、电转槽(Bio-Rad)。
1.3 方法
1.3.1bEnd.3细胞培养 bEnd.3细胞用含10%胎牛血清、1% 青、链霉素的DMEM培养基在 37℃,5%CO2的培养箱中培养。
1.3.2氧糖剥夺再复氧复糖模型制作 弃掉细胞培养皿中原有培养基,PBS洗一次,弃掉PBS,换成DMEM无糖培养基,将培养皿放入培养袋中,迅速排出袋中空气,将厌氧产气袋放入培养袋内,再将培养袋密封好,放入37℃,5%CO2的培养箱内孵育2、4、6 h后取出细胞,弃掉DMEM无糖培养基,换成含有10%胎牛血清的完全培养基,放入37℃,5%CO2的培养箱内继续孵育6、12、24 h,取出细胞后继续进行后续实验。
1.3.3Western blot 用胰酶消化收集各组细胞,PBS清洗2次,加入适量体积的ripa裂解液,在预冷的离心机中12000rcf离心10 min,收集上清液即为细胞总蛋白。根据BCA法进行蛋白定量,测定蛋白浓度。取相同质量的蛋白样本进行聚丙烯酰胺凝胶电泳,电转印至PVDF膜,5%脱脂奶粉进行封闭,TBST洗3次,用鼠抗NLRP3、β-actin抗体4℃孵育过夜,TBST清洗3次,辣根过氧化物酶标记的相应二抗避光孵育1 h,将PVDF膜放置在Odyssey扫膜仪上扫描,并用ImageJ进行定量分析。
1.3.4ELISA 取对数生长期的bEnd.3细胞,按照每孔12000个细胞浓度接种于6孔板,培养36小时后,制作相应时间点的氧糖剥夺及复氧复糖模型,收集各组细胞上清液,按小鼠白介素IL-1β、IL-18ELISA试剂盒说明书加入试剂盒内的试剂,用多功能酶标仪在450 nm波长测量各孔的吸光度,代入标准曲线,即为各组IL-1β及IL-18的浓度含量。
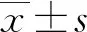
2 结果
2.1 OGD2h、4h、6h,bEnd.3细胞中NLRP3、caspase-1的表达情况及IL-1β、IL-18的浓度水平
氧糖剥夺后NLRP3、caspase-1、IL-1β、IL-18对照组表达水平较低,OGD2h时NLRP3表达较对照组略升高,caspase-1表达较对照组略升高(P<0.05),IL-1β、IL-18浓度较对照组略升高。OGD4h时NLRP3表达进一步升高(P<0.01),caspase-1表达进一步升高(P<0.01),IL-1β、IL-18浓度进一步升高。OGD6h时NLRP3表达升高(P<0.01),但低于OGD4h组,仍高于对照组,caspase-1表达与对照组相比差异无统计学意义,IL-1β、IL-18浓度升高,但低于OGD4h组,仍高于对照组,差异无统计学意义,见图1。

注:与对照组相比,*表示有统计学意义,*P<0.05,**P<0.01。
2.2 在OGD6hR6h、12h、24h,bEnd.3细胞中NLRP3、caspase-1的表达情况及IL-1β、IL-18的浓度水平
氧糖剥夺6 h后复氧复糖,NLRP3、caspase-1、IL-1β、IL-18对照组表达水平较低,复氧复糖6 h时NLRP3表达较对照组非常显著升高(P<0.001),caspase-1表达较对照组非常显著升高(P<0.0001),IL-1β、IL-18浓度水平较对照组升高(P<0.05)。复氧复糖12 h时NLRP3表达较对照组显著升高(P<0.01),caspase-1表达较对照组非常显著升高(P<0.0001),IL-1β、IL-18浓度水平较对照组升高,差异无统计学意义。复氧复糖24 h时NLRP3表达较对照组显著升高(P<0.01),caspase-1表达较对照组非常显著升高(P<0.0001),IL-1β、IL-18浓度水平较对照组升高,差异无统计学意义。随着再灌注时间的延长,NLRP3、caspase-1的表达水平及IL-1β、IL-18的浓度水平均呈逐渐下降的趋势,见图 2。
3 讨论
缺血性卒中后的病理生理学是一系列复杂的过程,包括酸中毒、兴奋毒性、生物学功能障碍、血脑屏障破坏、活性氧介导的氧化应激、白细胞浸润、细胞因子介导的炎症反应、细胞离子稳态丧失以及花生四烯酸产物的产生和补体的激活。在卒中的多种潜在机制中,氧化应激和炎症参与了脑缺血再灌注损伤的发病机制,适当调节炎症对卒中的预防和治疗有重要作用。研究表明[9-10],NLRP3相关蛋白主要在内皮细胞和小胶质细胞中表达。当前关于NLRP3炎症小体在内皮细胞中缺血再灌注损伤早期表达规律的研究报道较少。本研究采用体外缺氧缺糖再复氧模型模拟脑缺血再灌注损伤,分别于氧糖剥夺2、4、6 h和氧糖剥夺6 h复氧复糖0 h、6 h、12 h和24 h不同时间点观察NLRP3炎症小体及其下游因子的蛋白及浓度的动态变化,观察其在血管内皮细胞中缺血再灌注损伤早期的变化规律,为脑缺血再灌注损伤中血脑屏障的破坏情况,提供一定的理论依据。

注:与对照组相比,*表示有统计学意义,*P<0.05,**P<0.01,***P<0.001,****P<0.0001。
脑缺血再灌注过程中产生大量的活性氧,使NLRP3炎症小体激活,进一步促进caspase-1、IL-1β、IL-18的生成。本研究发现,缺氧缺糖条件下,对照组NLRP3蛋白水平及IL-1β、IL-18浓度水平较低,缺氧缺糖2 h表达略增加,于4 h达到高峰后,6 h下降。该结果提示,缺氧缺糖4 h时,炎症小体对血管内皮细胞损伤较大。缺氧缺糖再复氧条件下,对照组NLRP3蛋白水平及IL-1β、IL-18浓度水平较低,复氧复糖后6 h表达增加,12 h下降,24 h进一步下降。该结果提示,复氧复糖6 h时,炎症小体对血管内皮细胞损伤较大,随着复氧时间的延长,炎症小体在血管内皮细胞中的表达逐渐减少,对血脑屏障的影响逐渐减小,说明在此期间复氧复糖对血管内皮细胞起到一定的保护作用。
众所周知,炎症是有害还是有益,取决于缺血性损伤的严重程度、频率和持续时间。早期的炎症反应可能会加重缺血性损伤,而晚期的炎症反应可能有助于修复受损的血脑屏障和组织。本研究探索了炎症小体在缺血及缺血再灌注后血管内皮细胞中的表达情况,以及炎症小体对脑卒中后血脑屏障损伤的影响,为缺血性卒中患者开发新治疗策略提供了线索。

