多形性脂肪肉瘤患者术后总体生存率预测的诺模图建立
皮杨威,童悦歆,姜利明,巩 岩,朱德瑾,赵东旭
(吉林大学中日联谊医院 脊柱外科,吉林 长春130033)
多形性脂肪肉瘤(PLPS)是一种罕见的肉瘤,具有高度侵袭性和复发性,约占所有脂肪肉瘤的5%-10%[1],最常见于四肢以及腹腔内和腹膜后区域[2]。以往的研究表明,其5年和10年总体生存率分别为54%和40%,癌症特异生存率分别是60%和53%[3]。根据NCCN软组织肉瘤指南,脂肪肉瘤的治疗效果主要取决于手术切除[4],因此手术治疗是PLPS的最佳选择,与未接受手术的患者相比,接受手术的PLPS患者的生存率显著提高[5]。根据临床数据分析,即使在根治性手术后,PLPS仍有一定的复发率,需要反复手术、放疗或化疗[6]。尽管手术后患者的生存率较未手术患者有所提高,但术后死亡的发生率仍很高,死亡原因也有很多,例如多器官功能衰竭[7],致使其成为临床研究中的一个难题。此外,术后残留的PLPS(手术切缘阳性)非常常见,因此,额外的治疗及干预措施就显得尤为重要。研究表明,放射治疗在术后辅助治疗中显示出巨大潜力,可延缓病情的进展和复发,接受辅助放疗患者的生存率明显高于未接受辅助放疗的患者[5]。因此,准确估计这些患者的预后有助于临床决策,本研究旨在确定PLPS术后患者的预后因素,基于监测、流行病学和最终结果(SEER)数据库,本研究获得了一个基于人群的队列来研究预后因素,并开发诺模图和基于网络的生存计算器,以评估PLPS患者手术后的生存率。
1 方法
1.1 数据源
SEER数据库是最大的公开癌症数据库,覆盖约28%的美国人口[8]。疾病编码使用国际肿瘤疾病分类第3版(ICD-O-3)。
1.2 患者选择
使用SEER*Stat(8.3.8)从2004年至2015年SEER数据库中提取PLPS术后患者的数据。患者纳入标准为:(1)2004年至2015年间,患者在组织学上被诊断为PLPS;(2)根据ICD-O-3,组织学类型记录为8854的患者。排除婚姻状况、年龄、种族、性别、原发部位、分级、放疗、化疗和随访数据未知且未进行癌症外科手术的PLPS患者。最后,286例PLPS术后患者被纳入本研究。图1显示了本研究中选择程序的流程图。TNM分期是根据美国癌症联合委员会(AJCC)第8版TNM分期系统确定的。
1.3 研究变量
数量和百分比(n,%)用于描述分类变量。本研究收集了SEER数据库中记录的11个变量。根据X-tile计划(美国耶鲁大学)获得的最佳临界值,将诊断时的连续年龄变量转换为分类变量,然后将患者分为两个年龄组(<65岁,≥65岁)。PLPS术后患者的原发肿瘤部位分为四肢、躯干和其他。其他研究变量包括婚姻状况(未婚、已婚)、种族(黑人、白人、其他)、性别(男性、女性)、等级(分化良好、分化不良)、T分期(T1、T2)、N分期(N0、N1)、M分期(M0、M1)、放疗(否、是)、化疗(否、是)。研究终点定义为总体生存率(OS)。OS的时间从诊断日期到任何原因死亡或最后一次随访的时间计算。SEER数据库不包含个人信息,因此本研究不需要知情同意。
1.4 统计分析
所选患者被随机分为训练队列和验证队列,比例为7∶3。训练队列用于确定独立的预后因素并绘制诺模图,验证队列用于验证诺模图的性能。使用χ2检验比较两个队列之间的变量差异。
单变量和多变量Cox回归分析用于确定独立预后因素,并计算相对危险度(HR)和95%可信区间(CI)。单变量分析中P<0.05的变量被纳入多变量分析。最后,只有多变量分析中P<0.05的变量才被确定为独立预后因素,并被纳入诺模图的构建中。诺模图的辨别能力通过受试者工作特征(ROC)曲线和曲线下面积(AUC)值进行评估。校准曲线用于评估实际结果和预测结果之间的一致性。决策曲线分析(DCA)曲线用以计算预测模型的净获益,显示临床实用性。此外,计算每个患者的总分,将两个队列中的患者按中位数分为低风险组和高风险组。绘制Kaplan-Meier生存曲线,并应用对数秩检验比较两个风险组的生存结果。最后,使用“Dynnom”软件包,根据诺模图编制了基于网络的生存计算器。

图1 数据提取流程图和研究设计
所有统计分析均在IBM SPSS Statistics版本25.0(SPSS,Inc)和R软件版本3.6.3中进行。P<0.05被认为差异具有统计学意义。
2 结果
2.1 PLPS术后患者的人口统计学和临床病理学信息
共有286名PLPS术后患者最终被纳入本研究,并被随机分为训练队列(n=202)和验证队列(n=84)。所有患者的人口统计学和临床病理学信息汇总于表1。大多数患者为已婚(65.38%)、老年人(≥65,45.80%)、白人(79.37%)和男性(61.54%)。88%以上的肿瘤分级为分化不良。最常见的原发部位是四肢(66.08%),其次是躯干(31.12%)。此外,对于治疗信息,大多数患者选择放疗而不是化疗。结果表明两组间基线资料无显著性差异(P>0.05)。
2.2 PLPS患者术后OS的独立预后因素
为了揭示PLPS患者术后OS的独立预后因素,在训练队列中应用了单变量和多变量Cox回归分析。结果如表2所示,单变量分析显示,年龄、婚姻状况、T分期、M分期和放疗与OS显著相关(P<0.05)。最后,在多变量分析中,年龄、婚姻状况、T分期、M分期和放疗是独立预后因素(P<0.05)。
2.3 诺模图的建立和验证
基于5个变量,建立诺模图来预测12个月、24个月和36个月的OS(图2)。诺模图显示M期对OS的贡献最大(HR:14.07,95%CI:5.72-34.61),其次是T期(HR:2.86,95%CI:1.61-5.07)。PLSP术后患者的总分可以通过对每个点进行求和来计算,然后可以确定12个月、24个月、36个月的OS。例如,一名63岁的已婚PLPS患者在手术后接受了M0期、T2期和放射治疗,其总分为153分,在12个月、24个月、36个月的预测OS分别为0.048、0.148和0.26。为了验证训练队列中诺模图的区分度,在训练队列中,预测12个月,24个月和36个月OS的AUC值为0.793,0.811和0.774(图3-A);在验证队列中,预测12个月、24个月、36个月OS的AUC值分别为0.830、0.670和0.612(图3-B)。校准曲线显示在训练(图4-A、B、C)和验证队列(图4-D、E、F)中诺模图预测值与实际结果之间具有良好的一致性。在训练队列(图5-A、B、C)和验证队列(图5-D、E、F)中,12个月、24个月和36个月OS的DCA曲线显示出较好的正净获益,表明具有较强的临床实用性。
2.4 基于诺模图模型的风险分层系统
在建立诺模图的同时,计算了每个PLPS术后患者的总分,并根据中位数144分将他们分为两组:低风险组和高风险组。Kaplan-Meier生存曲线显示,低风险组的生存概率高于高风险组(两者P值均<0.0001),这表明当患者被分为低风险组时,预后更好(图6A、B)。

表1 多形性脂肪肉瘤术后患者的人口统计学和临床病理学信息

表2 多形性脂肪肉瘤术后患者的单变量和多变量Cox回归分析
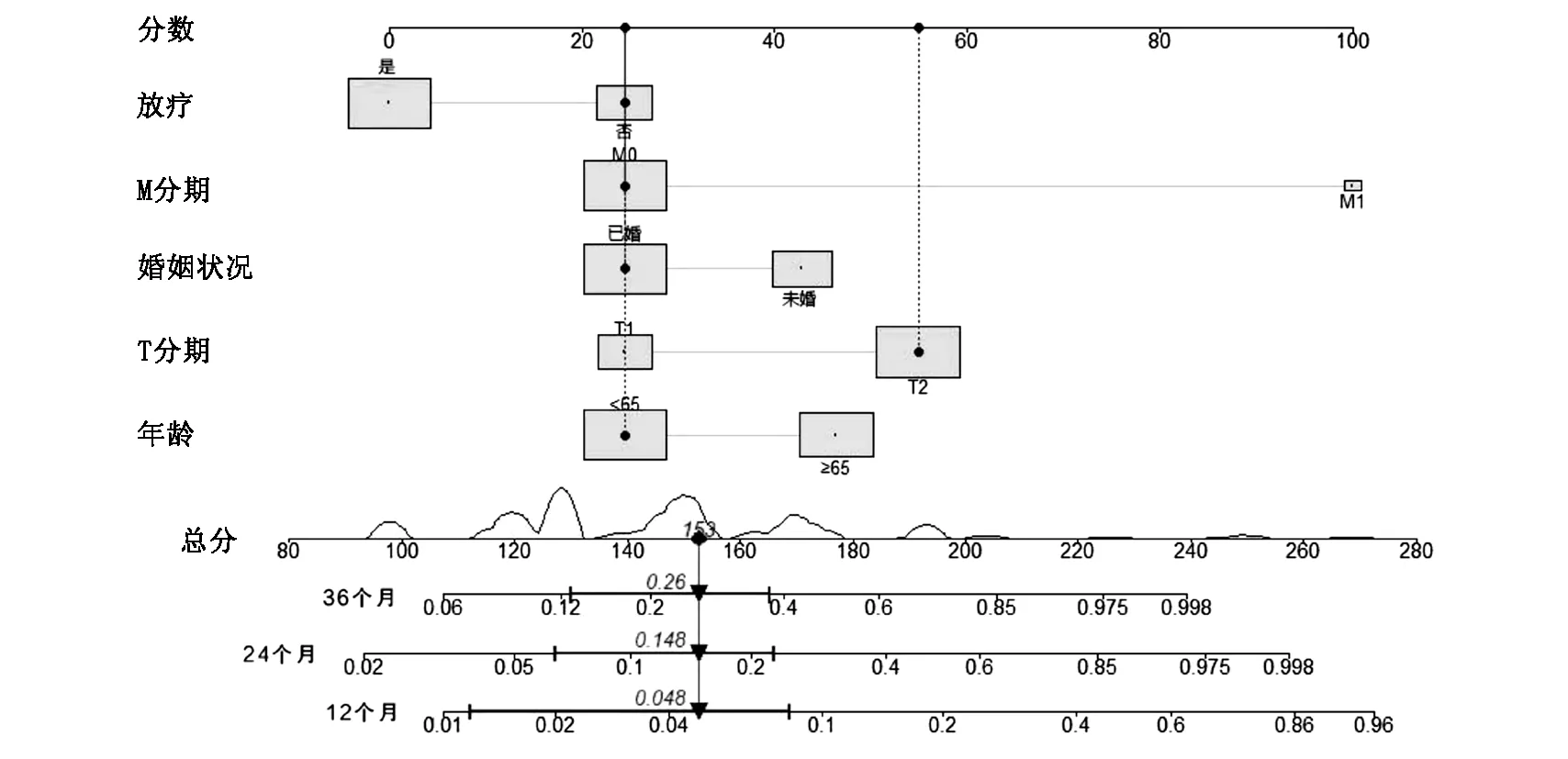
图2 预测PLPS患者术后12个月、24个月和36个月OS的诺模图
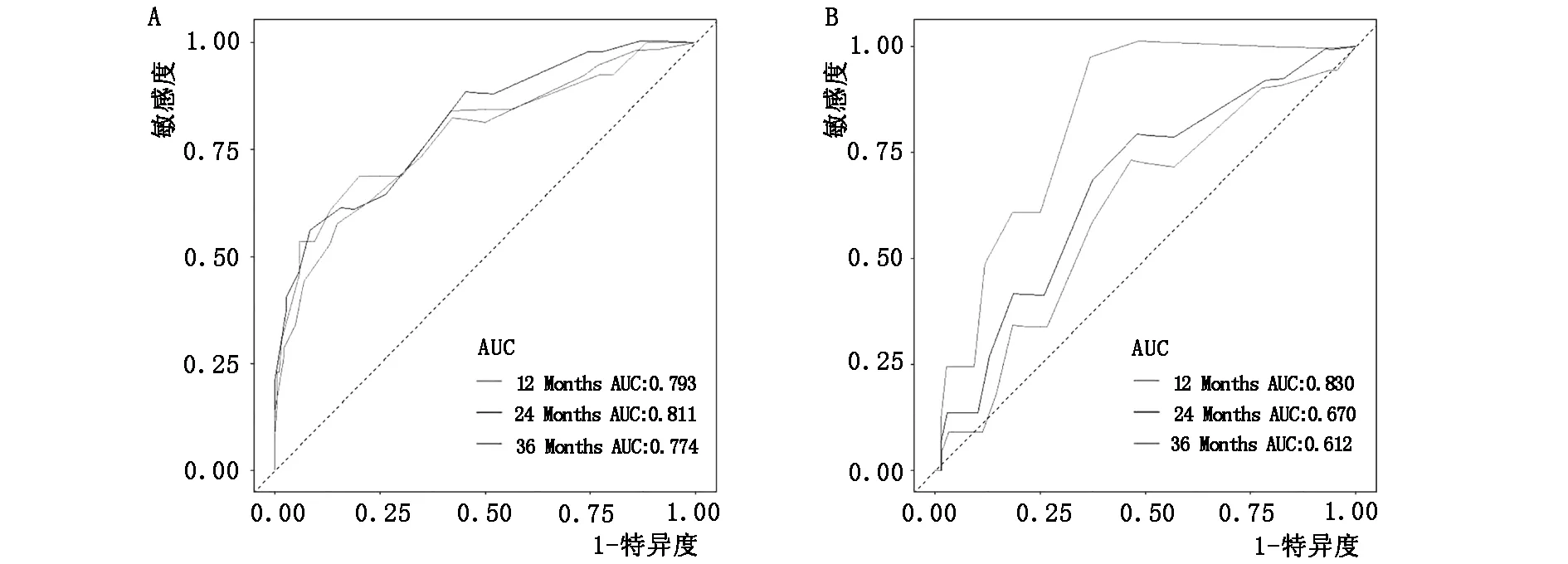
图3 训练队列(A)和验证队列(B)与时间相关ROC曲线

图4 训练队列(A、B、C)和验证队列(D、E、F)分别于12个月、24个月和36个月的校准曲线

图5 训练队列(A、B、C)和验证队列(D、E、F)分别于12个月、24个月和36个月的决策曲线分析
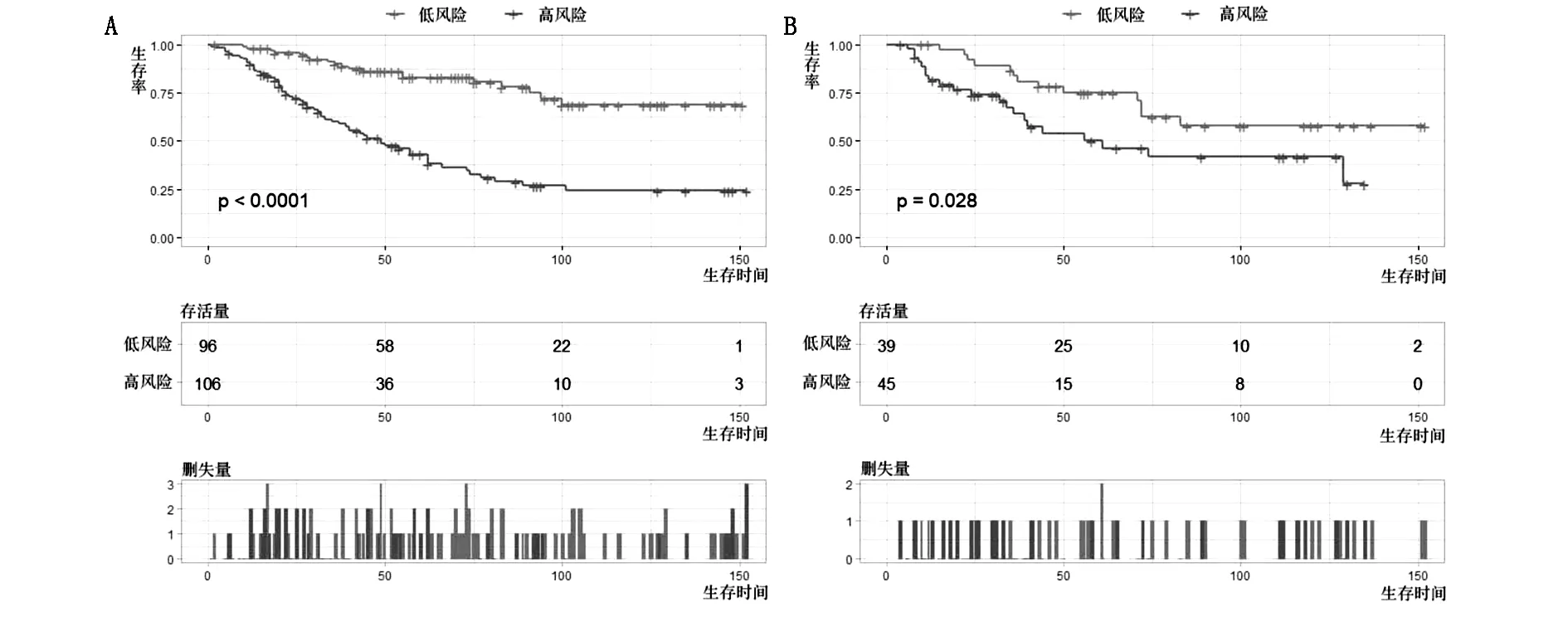
图6 训练队列(A)和验证队列(B)不同风险组的Kaplan-Meier生存分析
2.5 基于网络的生存计算器
为了方便直观地应用诺模图,构建了一个基于网络的生存计算器(https://research1.shinyapps.io/DynNomapp/)。PLPS术后患者5个独立预后因素和随访时间显示在网络界面的左侧。然后,通过选择相应的值和随访时间,可以显示生存曲线、生存率和95%CI(图7A、B)。
3 讨论
目前,根治性手术被认为是PLPS的首选治疗方法[4,9]。尽管接受手术的PLPS患者与未接受手术的患者相比具有更满意的生存结果,但手术后PLPS患者的高复发率和死亡率仍然是临床治疗的一个挑战。因此,有必要构建一个模型来评估PLPS术后患者的OS,这对于PLPS患者手术后的临床管理尤为重要。
本研究回顾性分析了SEER数据库中286例PLPS术后患者的数据,并确定了五个独立的预后因素,包括年龄、婚姻状况、M期、T期和放疗。基于这些预后因素,构建了一个诺模图来预测PLPS术后患者12、24、36个月的OS。ROC曲线、校准曲线和DCA曲线分别显示了诺模图良好的分辨能力、校准能力和临床实践能力。此外,为了便于模型的应用,构建了一个基于网络的生存计算器,通过输入五个确定变量的时间点和特定值,可以报告特定时间下95%CI的患者生存概率。该在线工具不仅可以随时准确预测患者的预后,还可以节省计算各变量的分数及总分数的繁琐步骤[10]。通过应用所开发的模型,临床医生将能够根据一些已知因素预测个体存活概率,估计死亡率风险,并为PLPS术后患者做出个性化医疗决策。

图7 网页诺模图操作界面
本研究表明,年龄是PLPS术后患者重要的预后因素,PLPS术后患者年龄越大,其预后越差,这一结果与另一项研究[3]的结果一致。这可能是因为老年患者经常伴有一些基础疾病,如糖尿病、动脉硬化和高血压等,这些可能会加重术后并发症。此外,Daniela等人[11]已经表明,老年患者通常有较大的肿瘤,这很容易导致手术切缘阳性。在术后治疗方面,老年患者由于对多次放疗的依从性较差,通常接受较少的强化治疗,而蒽环类化疗可能是常见心脏病或血液病的禁忌症[11- 12]。上述潜在原因合理地解释了接受手术的老年PLPS患者接受辅助治疗较少和生存概率低的原因。此外,据报道,PLPS有很强的转移倾向,最常见的转移部位是肺[13]。本研究结果表明,在所有独立预测因子中,M期的HR最高,这意味着M期对诺模图中的OS概率贡献最大。当PLPS术后患者在初诊时有远处转移时,生存率下降的原因不仅包括原发部位的癌变,还包括肿瘤细胞的全身转移,这也解释了为什么本研究的结果显示,即使接受了手术治疗,有转移的PLPS患者的生存概率仍比没有转移的患者低。这也表明原发部位切除术后PLPS患者的转移管理同样重要。
此外,本研究表明,肿瘤较大的PLPS患者预后较差。Wan等人[3]表明,肿瘤体积大与存活率低之间的相关性揭示了肿瘤体积大小是其生物活性强弱的标志。众所周知,术后肿瘤切缘的状态与术后患者的预后密切相关,而那些较大肿瘤患者很难获得安全的手术切缘。在一项临床研究中,Kaplan-Meier分析表明,手术切缘阳性与疾病特异性生存率的降低显著相关[13]。其他研究表明,手术切缘的状态与手术部位有关,上肢肉瘤通常较小,手术解剖更复杂,这种差异常常危及手术切缘的阴性,导致较高的复发率和不良预后[14]。本研究还发现,在PLPS术后患者群体中,已婚患者的存活率明显高于未婚患者。Kamen等人[15]发现,与缺乏家庭支持的患者相比,有强大家庭支持的病人更容易遭受较低水平的心理困扰。因此,基于当前癌症多学科管理的理念和这些发现,需要强调心理干预的重要性,尤其是对未婚患者。本研究进一步表明,在基于人群的队列中,辅助放疗可以改善PLPS术后患者的OS。许多研究表明,围手术期放疗是PLPS患者最常用的辅助治疗策略,有助于降低术后复发风险[16-18]。此外,尽管化疗被用作癌症患者的辅助治疗,但之前的一些研究表明,PLPS患者对化疗的反应较低[6,19-20],本研究结果与其一致。本研究结果还表明,术后化疗并没有显著改善PLPS患者的预后,这可能与PLPS高度的细胞多形性、不规则的生长模式和不同的分子异常有关,这使得治疗靶点的识别变得模糊[13],化疗敏感性降低,效果不明显。
然而,本研究仍有许多局限性:首先,一些研究表明手术部位与术后患者的生存率有关,但SEER数据库无法获得手术部位,因此,有必要进一步构建一个新的诺模图,以包含这些变量,预计更多风险因素会改善这些变量;其次,由于随访结束时间不同,容易产生结果偏差;最后,缺乏外部验证来验证诺模图的应用价值。
总之,在本研究中,年龄、婚姻状况、T分期、M分期和放疗是PLPS术后患者OS的独立预后因素,本研究建立了一个诺模图和基于网络的生存计算器(https://research1.shinyapps.io/DynNomapp/),用于定量评估PLPS术后患者的OS,可以作为方便直观的工具,指导PLPS患者术后的临床决策和个性化管理。

