肿瘤干细胞疗法在三阴性乳腺癌分子分型及靶向治疗中的应用研究进展
宋纬巍 孙金丽综述 牟 为审校
乳腺癌已经成为全世界发病率最高的癌症,是全世界女性因癌症死亡首要原因[1]。目前乳腺癌发展出不同分类亚型,三阴性乳腺癌(TNBC)虽仅占乳腺癌发病种类的10%~20%,却导致了近70%的因患乳腺癌而发生的死亡。TNBC是一种癌组织中雌激素受体(ER),孕激素受体(PR)均为阴性,人表皮生长激素受体-2(HER-2)不存在过表达的乳腺癌亚型,由于缺乏治疗性靶向激素受体以及不存在HER2 蛋白过度表达,难以进行分子靶向治疗和内分泌治疗。此外,TNBC的细胞分型发现其具有较高的肿瘤干细胞亚型,可能调控TNBC早期转移、复发耐药并最终导致患者总体预后不佳[2]。肿瘤干细胞(CSC)是一种分化水平较低,且具有类似干细胞自我更新能力和更高的分化潜能的肿瘤细胞类型。肿瘤干细胞可以通过分裂产生肿瘤组织中其他分化程度更高的肿瘤细胞,增强肿瘤的异质性,为肿瘤治疗带来更大的挑战。研究表明,从肿瘤组织中分离出来的肿瘤干细胞在被移植到患严重联合免疫缺陷病(SCID)小鼠中后,仍可形成新的肿瘤,而其他肿瘤细胞不具有这种异种移植的能力[3],这也提示我们肿瘤干细胞可能作为肿瘤转移的种子,促进肿瘤转移后新的肿瘤的形成[4]。
干细胞特定的生物标志物可作为肿瘤转移及耐药相关信号通路的组成部分,在肿瘤的进展中起到关键作用。在乳腺癌中,少量具有CD44+/CD24-表型的细胞,高醛脱氢酶(ALDH)活性细胞的亚群即可在体外形成乳腺癌组织,并使免疫缺陷的小鼠发生乳腺癌[5]。因此,CD44+/CD24-表型和高醛脱氢酶(ALDH)活性被认为是TNBC肿瘤干细胞的经典特征。后续深入的体内体外研究均证实,CD44作为TNBC肿瘤干细胞经典的生物标志物,可以通过与配体透明质酸(HA)的结合导致TNBC的靶向转移,其特异性抗体可以降低乳腺癌细胞的侵入性[5]。高醛脱氢酶(ALDH)活性可以通过激活缺氧诱导因子(HIF-2),降低细胞内的ROS水平,防止在化疗和放疗中肿瘤细胞氧化应激产生大量ROS从而导致的细胞死亡,使肿瘤干细胞有高度耐药性[6]。而干细胞中活化的信号通路也促进了肿瘤发展,Wnt通路在干细胞中的活化抑制了β-catenin磷酸化的高表达,导致了上皮-间质转化基因的转录增加,促进了肿瘤转移[7]。
然而随着新技术的发展以及对于肿瘤微环境等理论认识的深入,对于TNBC肿瘤干细胞的认识不再限于CD44和ALDH。TNBC肿瘤干细胞对于乳腺癌进展的影响研究以及药物的研发得到了一定的突破,但关于TNBC肿瘤干细胞对宿主肿瘤微环境的整体影响,对特异器官的恶性靶向转移和复发耐药的影响仍需进一步研究。
1 肿瘤干细胞调控TNBC的发生发展
1.1 肿瘤干细胞促进TNBC恶性转移
TNBC具有高度转移倾向,其远端转移与预后不佳有关[8]。经典的肿瘤转移“种子-土壤”理论认为,肿瘤细胞通过血液或淋巴系统随机转移,但仅在第二靶器官微环境(土壤)适合肿瘤细胞(种子)时,肿瘤才会定殖并形成转移灶[9]。传统的乳腺癌转移模式中,原发性乳腺癌的肿瘤细胞经历了上皮-间质过渡(EMT),从而进入淋巴循环,并在形成合适的肿瘤转移前微环境的器官形成转移灶[1]。在对于发生转移的乳腺癌患者淋巴循环中的肿瘤细胞测序发现,这些乳腺癌细胞与原发性乳腺癌肿瘤干细胞在转录水平上高度一致[10]。这表明,乳腺癌肿瘤干细胞可以通过EMT进入淋巴结,在肿瘤原发及靶器官部位通过间质-上皮转换定植,同时逃避免疫细胞的杀伤,与“土壤”即肿瘤转移微环境相互作用,从而形成新的肿瘤转移灶[9]。TNBC肿瘤干细胞还可能通过与肿瘤微环境的相互作用增强其在转移后定植的能力。研究发现,肿瘤干细胞有更强的适应和重塑微环境的能力[11]。TNBC肿瘤干细胞具有CXCR4高表达的特点,CXCR4高表达的TNBC肿瘤干细胞向CXCR12高表达的组织进行转移,再通过CXCR12的高表达招募其他CXCR4高表达的免疫细胞,血管内皮细胞等,重塑肿瘤微环境,通过这些细胞分泌IL-1β,TGF-β等细胞因子,支持转移肿瘤的生长[12]。TNBC脑转移后,肿瘤微环境中高水平的IL-1β会促进邻近星形胶质细胞高表达Jagged1,激活肿瘤干细胞的Notch信号,IL-1β与Notch相互作用能诱导肿瘤干细胞自我更新[13];Jagged1激活的细胞释放ICN1与ICN3,作用于肿瘤干细胞Notch基因转录起始位点上游2,085bp的RBP-Jκ序列,促进IL-1β分泌,间接提高CCL2水平,募集肿瘤相关巨噬细胞(tumor associated macrophage,TAM)与单核细胞于肿瘤病灶,形成免疫浸润,导致TNBC不良预后[14]。除此之外,TNBC肿瘤干细胞具有CD44阳性的特点,CD44在受到磷酸化信号后,可以激活下游转录信号造成TGF-β的高表达[15],TGFβ通过作用于宿主肿瘤微环境促进肿瘤生长,特别是通过促进肿瘤微环境中的内皮细胞发生上皮-间质转换,再诱导间质细胞进一步分化为肿瘤相关成纤维细胞(CAF),成纤维细胞通过分泌基质金属蛋白酶(MMPs)或细胞因子进一步促进上皮-间质过渡。此外,成纤维细胞通过 PAR1 依赖Ca2+信号和MMP表达水平上升增强原始非侵入性肿瘤细胞的侵入性[16],MMP促进ECM的降解,解离细胞粘附分子,从而增强肿瘤细胞的侵袭性[17];TGFβ通过抑制CD8阳性T细胞中的孔隙形成蛋白(PFP)表达,抑制T细胞活化诱导的细胞死亡(activation-induced cell death),抑制抗肿瘤免疫[18];TGFβ触发肿瘤血管生成,以自分泌/旁分泌方式,以及与其他信号级联的合作作用,包括血管内皮生长因子(VEGF)、成纤维细胞生长因子(bFGF)、Notch、结缔组织生长因子(CTGF)和血管生成素,通过促进内皮细胞迁移和增殖刺激血管生成[15]。
1.2 肿瘤干细胞调控TNBC耐药和复发
肿瘤在化疗后产生的耐药现象与肿瘤异质性有关,肿瘤组织中不同类型的肿瘤细胞对化疗的敏感性不同。在常规化疗后TNBC组织的活检中,肿瘤干细胞相关基因表达水平发生上调,残余肿瘤中肿瘤干细胞的存在比例显著增加[19]。这一发现表明TNBC肿瘤干细胞是对于化疗药物不敏感的细胞的主要类型,其高度耐药性导致化疗后的残余肿瘤中肿瘤干细胞得到富集,并导致TNBC的复发。与分化程度较高的肿瘤细胞相比,肿瘤干细胞相对平静,可以在分裂时停止在细胞周期G0期[20]。而细胞毒性药物通常对快速分裂细胞最有效[21],肿瘤干细胞的这种休眠行为为他们提供了对细胞毒性药物的天然保护。其次,在以吉西他滨或紫杉醇作为化疗药物进行治疗的TNBC组织中,肿瘤干细胞相关缺氧诱导因子出现高表达,从而导致肿瘤细胞多耐药蛋白基因1(ABCB1)表达的上调。肿瘤干细胞高度表达了多种多耐药蛋白,如Bcrp1蛋白,ABCB1蛋白等[22-23],通过利用ATP将多种化疗药物排出细胞外,使肿瘤干细胞具有高度耐药性,或是通过TNF-α与CD44的结合,激活Ras/MAPK通路,增加抗凋亡蛋白的表达,提高肿瘤干细胞的抗凋亡能力。第三,TNBC肿瘤干细胞高度耐药性受其肿瘤微环境以及NF-kB通路的激活调控。肿瘤相关成纤维细胞(CAF)和免疫细胞之间相互作用,通过激活肿瘤干细胞中的NF-κB信号来诱导自我更新特性增强进一步的治疗耐药性[17]。CAF能够通过与受体RIG-1结合,激活TNBC肿瘤干细胞中的STAT1;反过来,STAT1的激活进一步激活NOTCH3,导致CSCs的耐药性增加。间质细胞MSCs和TNBC之间的相互作用通过激活非受体酪氨酸激酶及其下游PI3K/Akt途径,增加了肿瘤干细胞对曲妥珠单抗的耐药性。除此之外,内皮细胞(ECs)分泌TNFα,激活CSCs中的NF-κB信号通路,并诱导TNBC中CXCL1/2,吸引免疫细胞在肿瘤微环境的富集和趋化因子的产生,包括S100A8/9等,从而降低肿瘤干细胞对于环磷酰胺的敏感性[24]。同时,通过肿瘤微环境中各种生长因子、细胞因子和趋化因子与肿瘤细胞的相互作用也可能提升肿瘤干细胞的耐药性[25]。例如,IL6和STAT3通路与BCSCs中的曲妥珠单抗耐药性有关[26]。
2 基于肿瘤干细胞的TNBC治疗策略
2.1 基于TNBC肿瘤干细胞表面特异性抗原的临床应用
TNBC肿瘤干细胞表面存在许多干细胞相关生物标志物,其中CD44不仅被认为是在识别TNBC肿瘤干细胞中的重要生物标志物,在通过清除乳腺癌干细胞治疗TNBC这一治疗策略中也受到了广泛的关注[27]。CD44与其在肿瘤微环境中大量存在的配体透明质酸(HA)的特异性结合在肿瘤转移和耐药中起到了关键性作用[5],CD44-HA在接受TNF-α信号后,可以通过磷酸化S133和促进CREB相关基因转录,激活TGF-β信号转导通路,促进乳腺癌肿瘤细胞发生上皮-间质转化[28],离开原发肿瘤组织,从而促进转移;而CD44-HA在接受受体酪氨酸酶(RTK)激活信号发生磷酸化后,可以通过磷酸化级联反应激活RAS-MAPK通路,增加抗凋亡蛋白的表达,从而增强肿瘤细胞的抗凋亡能力[29](图1)。因此,通过特异性结合CD44,竞争性抑制肿瘤相关HA与CD44结合形成CD44-HA分子,从而实现化疗药物在特定的肿瘤干细胞部位释放,同时阻断CD44下游信号通路抑制肿瘤的转移,降低肿瘤抗凋亡水平,可能成为TNBC未来的重要治疗策略。
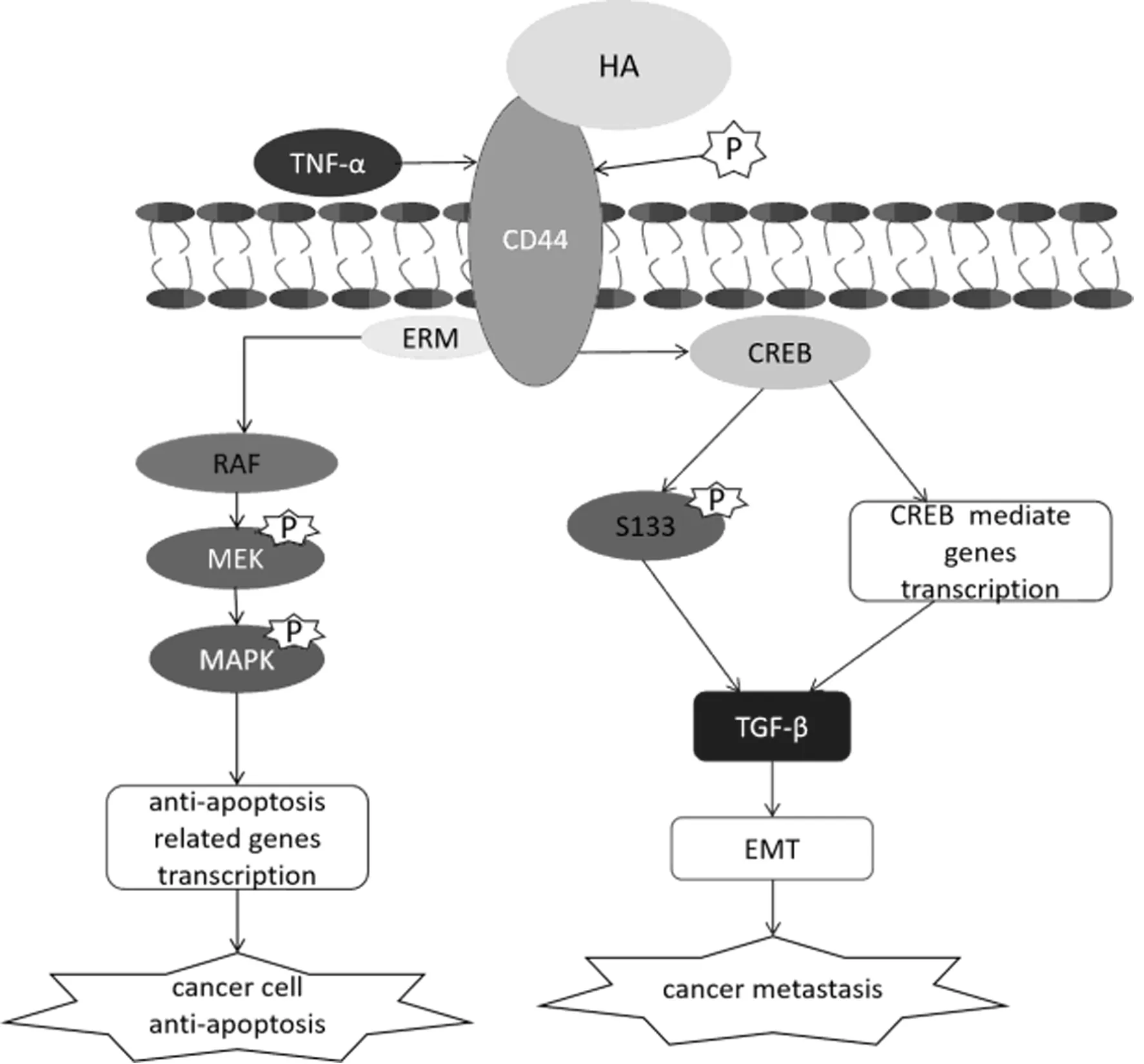
图1 CD44相关信号通路在肿瘤细胞耐药和转移中的作用模式图
研究显示,通过运用靶向CD44的小分子结合化疗药物,到达TNBC癌组织部位,通过与CD44阳性细胞结合,特异性杀伤乳腺癌肿瘤干细胞的方法在动物实验中是可行的[30]。Marangoni E等的研究发现,使用人CD44单克隆抗体p245携带环磷酰胺对携带异种移植TNBC的小鼠进行治疗可以显著抑制肿瘤生长,在化疗后4~6周,与对照组相比,CD44单克隆抗体的运用有效地预防了由残留CD44阳性乳腺癌肿瘤干细胞介导的肿瘤复发[31]。随着新技术的发展,纳米材料的辅助应用为靶向CD44的TNBC治疗新思路。Cuixia Yang等通过开发以与CD44特异性结合分子HA作为涂层的纳米材料携带紫杉醇,尝试靶向结合CD44治疗乳腺癌。在体外试验中证实,这种以经典CD44配体HA为涂层的新材料克服了传统CD44抗体的缺点,可以区别正常细胞表达的CD44分子与乳腺癌肿瘤干细胞表达的CD44分子。而在异种移植了CD44高表达的乳腺癌细胞的小鼠模型中进行的实验则发现,在运用此种纳米材料的化疗中,乳腺癌组织体积明显减小,细胞坏死增加,且未观察到其他组织发生细胞毒性反应[32]。因此,通过寻找可区分正常组织与癌组织中CD44不同的良好的药物载体靶向CD44可能成为TNBC肿瘤干细胞清除的重要策略之一。
2.2 TNBC肿瘤干细胞增殖信号通路抑制剂的临床应用
区别于其他亚型的乳腺癌,TNBC肿瘤干细胞中更多与干细胞命运相关的信号转导路径被激活[19]。Wnt/β-catenin通路不仅在干细胞的增殖以及肿瘤形成中发挥重要的作用,在TNBC中也已被证明是其发生和进展的主要驱动力[32],并在维持肿瘤干细胞的活性,促进肿瘤的转移中起到了重要的作用。在经典的Wnt/β-catenin通路中,Wnt蛋白通过增加细胞内β-catenin水平,从而发挥调节肿瘤干细胞命运的作用[19]。在Wnt信号通路作用下,Axin对β-catenin正常的磷酸化被抑制,导致β-catenin难以被泛素-蛋白酶体途径所识别发生降解,在细胞内大量聚积。作为一种转录因子,β-catenin通过进入细胞核,提高例如vimentin,Twist等与肿瘤干细胞发生上皮-间质转换相关的基因的表达水平,进而促进肿瘤的转移(图2)[25]。同时,β-catenin还活化了肿瘤干细胞中耐药基因的表达,可能与TNBC肿瘤干细胞的耐药有密切关联。
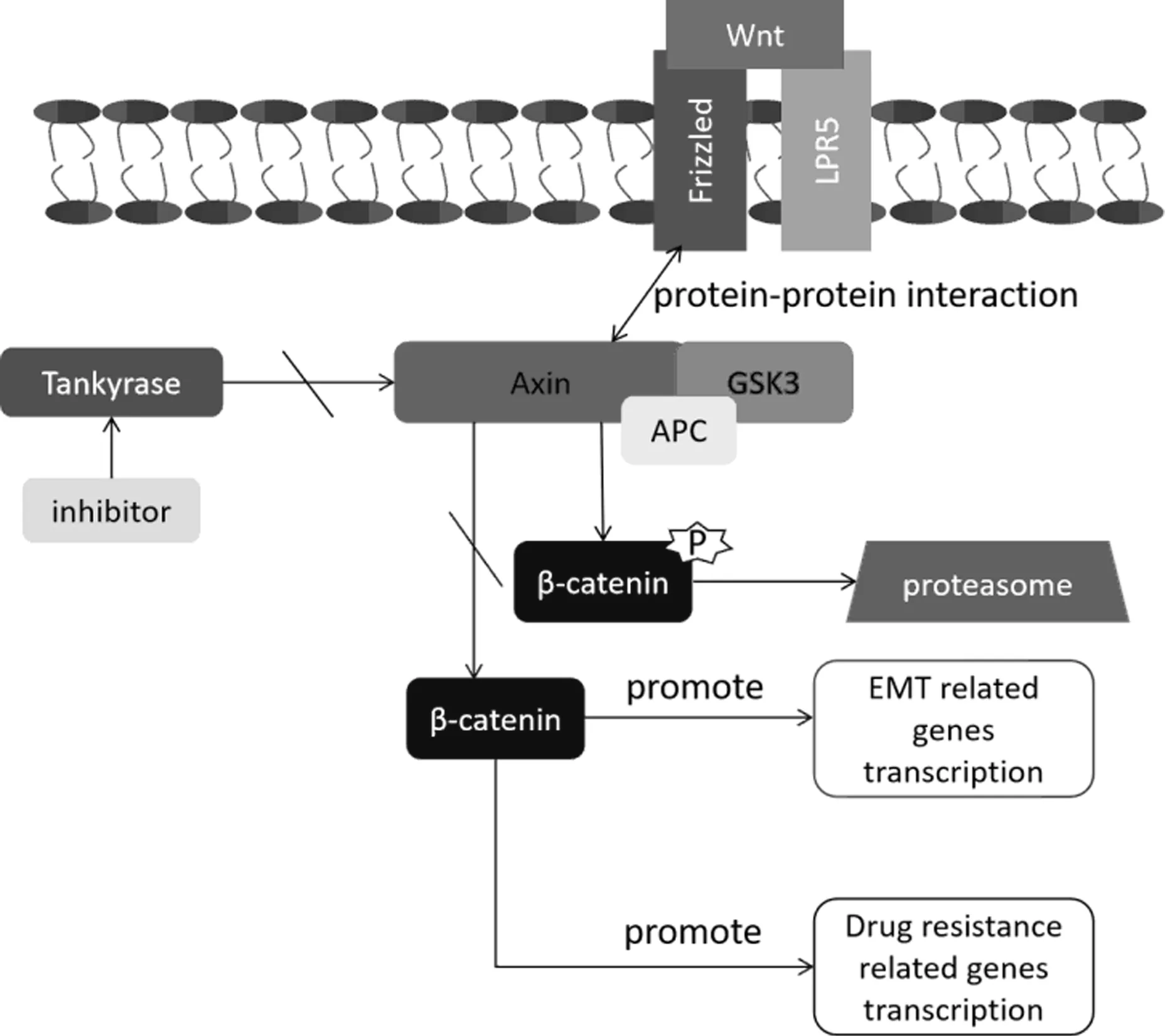
图2 Wnt/β-catenin对于上皮间质转换,耐药相关基因表达的调控,以及Axin相关酶抑制剂的使用对下游信号通路影响的模式图
TNBC是β-catenin在核内水平最高的乳腺癌亚型,β-catenin的表达水平升高与乳腺癌患者的预后较差有关[33]。因此,通过降低细胞内β-catenin水平进而降低Wnt通路下游基因的表达水平,从而降低TNBC肿瘤干细胞的转移能力,提高其化疗敏感度可能成为治疗策略之一。然而,区别于其他更多基于磷酸化级联反应激活的信号通路,Wnt通路的激活从而导致β-catenin在细胞内聚集,更多的依赖于蛋白质-蛋白质相互作用,前者可以通过寻找小分子抑制剂,通过抑制磷酸化阻断信号转导,而通过影响蛋白质-蛋白质相互作用调节Wnt通路就更具挑战性[31]。通过抑制二磷酸腺苷核糖多聚合酶(Tankyrase)的活性而阻止Axin蛋白的降解,从而促进Axin高效的磷酸化β-catenin,下调β-catenin在癌细胞内的水平的策略在近些年引起了大量关注,并在体内和体外试验中被证明是可行的[34]。而在乳腺癌肿瘤干细胞中,之前的一项研究验证了一种Tankyrase的小分子抑制剂:XAV939,可以通过上述方法下调β-catenin在乳腺癌细胞内的水平,有效地阻断了Wnt信号通路[35]。
除此之外,由于β-catenin是一种转录因子,其调控癌症干细胞命运的方式基于调节相关基因的转录,而目前的研究也发现,几种miRNA在Wnt通路活化的乳腺癌肿瘤干细胞中干扰了相关基因的表达[36]。有研究表明,加载miR-200c的纳米粒子可以显著提高乳腺癌组织中的miR-200c水平,纳米粒子可能作为将微RNA或小干扰RNA传递到乳腺癌干细胞靶点的有效载体[37]。因此,通过开发相关的miRNA药物,以纳米粒子为载体,进入乳腺癌肿瘤干细胞相应靶点,进而拮抗β-catenin作为转录因子的作用也是TNBC治疗的策略之一。需要注意的是,Wnt/β-catenin通路在发育以及正常干细胞的更新中起到了不可忽视的作用,Wnt基因敲除的小鼠在胚胎时期死亡[38]。因此,区别正常干细胞以及肿瘤干细胞中的Wnt/β-catenin相关基因转录或蛋白表达是设计靶向药物需要考虑的问题。
2.3 单细胞测序技术鉴定TNBC干细胞群
肿瘤干细胞的鉴定和特征对于个体化和有效的TNBC治疗的发展至关重要。运用传统的CD44+/CD24-表型和高ALDH活性鉴定肿瘤干细胞存在一定的局限性,而对于肿瘤干细胞转录组的测序则使其特征的识别更加准确。由于与TNBC肿瘤总细胞数相比,肿瘤干细胞的数量非常低,因此当肿瘤作为一个整体测序时,肿瘤干细胞的基因改变可能难以被准确测出。这个问题可以通过使用单细胞测序克服。单细胞测序是一种研究肿瘤进化和异质性的技术,有助于我们了解包括肿瘤干细胞在内的稀有肿瘤细胞在TNBC的启动、进展、入侵、转移、耐药和复发中起到的作用[39],从而指导临床TNBC治疗中更准确地早期发现和更有效的靶向药物的使用。目前对于TNBC的单细胞测序中主要发现了3个细胞群。这个由单细胞测序建立的模型对TNBC的肿瘤进化、诊断和治疗有重要的意义。此外,单细胞测序也被用于追踪TNBC中转移肿瘤细胞的起源。对来自6名非转移性乳腺癌患者的63个单细胞的基因组进行了测序,53%的细胞被定义为弥散性肿瘤细胞(DTCs),DTCs起源于主要肿瘤克隆、原发性肿瘤亚群或淋巴结转移亚群,与肿瘤干细胞转录水平上类似,揭示了DTCs的起源进一步证明了TNBC的转移与肿瘤干细胞的关系是密不可分的。除此之外,也有研究利用MDA-MB-231的scRNA-seq研究化疗药物治疗后TNBC转录异质性,解释了肿瘤耐药基因型由此进化而来,受到辅助化疗的选择而产生耐药性,但其转录水平由肿瘤微环境决定,可能在化疗药物的作用下去分化形成肿瘤干细胞,进而增强耐药性[40]。基于单细胞组学技术的相关科学研究也为解决临床中存在的TNBC的耐药及复发转移等问题提供潜在的治疗靶点[41]。虽然单细胞组学的应用中单细胞制备、全基因组扩增、库结构、测序或数据分析等过程仍存在一些问题,如覆盖面低、偏差、误差取决于不同的工作平台或方法;更好的WGA方法、更好的测序平台、更好的数据分析工具或算法,在未来仍需要开发。但单细胞平台不仅阐明了TNBC细胞谱系,而且为分析细胞异质性(包括肿瘤个体变异、CSC、肿瘤微环境的细胞成分)提供了一个强大而有效的手段。
3 未来与展望
TNBC是最具侵袭性的乳腺癌亚型,其特点是生存期低,远处转移发生率高。有限的治疗选择是导致TNBC预后不良的主要因素,虽然标准化疗仍是TNBC全身治疗的核心方案,然而,这些肿瘤往往对细胞毒性药物产生耐药性。迫切需要阐明TNBC耐药背后的分子驱动因素。当前的干细胞疗法极大地促进了对TNBC对化疗耐药的复杂机制的理解。本文综述了基于干细胞疗法对TNBC分子分型和转移复发耐药的复杂性,它是由多种因素和信号通路的相互作用和协作引起的。彻底解开这一网络仍然是一项重大挑战,但对确定新的治疗靶点至关重要。TNBC的未来临床研究显然需要关注生物标志物整合、患者精确分层和针对不同患者亚组量身定制有效的新组合方案。传统的肿瘤干细胞标志物仍是重要靶点,但单独靶向肿瘤干细胞的药物在异质性很高的肿瘤中可能不能起到良好的效果,所以,在TNBC的治疗中,肿瘤干细胞靶向药物与常规化疗药物的联合使用可能成为未来的方向。除此之外,利用新兴单细胞组学技术对TNBC肿瘤干细胞进行单细胞测序也为更好的了解TNBC异质性以及肿瘤干细胞特点,为选择更合适药物靶点提供了参考。综上,本文对TNBC肿瘤干细胞对于肿瘤转移、耐药、复发的机制进行了概述,并综述了基于干细胞分子机制和组学技术在肿瘤治疗的前景。

