基于TCGA数据库研究KCNT2在肺腺癌中的表达及与患者预后的相关性
刘 翼 吴 强 杨龙海 周孜孜 张晓明 曾 薇
肺癌是目前世界上最常见的恶性肿瘤之一,其发病率和死亡率均位于所有恶性肿瘤之首[1]。早期非小细胞肺癌患者缺乏特异症状且诊断方法有限,大多数患者被诊断时已处于肿瘤晚期,不适合进行手术切除,5 年生存期仅不足20%[2]。因此,确定与肺癌密切相关的新型分子靶点具有重大意义。KCNT2基因编码钠激活钾通道蛋白SLICK,SLICK具有较大的单导性并被细胞内钠离子和氯离子所激活,在细胞的去极化过程中表现出明显的活化动力,有助于钾离子向细胞外流动,从而降低和调节神经元的兴奋性[3]。既往的研究表明KCNT2突变与癫痫性脑病的发生有关[4-6]。最近的研究发现,KCNT2在胃癌[7]、黑色素瘤[8]组织中低表达,并且和预后相关,提示KCNT2 可作为潜在的预后预测因子。然而,关于KCNT2 在肺腺癌中的表达变化及意义目前仍缺乏研究报道。本研究通过下载整理癌症基因组图谱(TCGA) 数据库中2021 年5月30日之前纳入的肺腺癌表达谱数据及患者临床信息,分析KCNT2 在肺腺癌中的表达变化,探讨KCNT2 与临床病理特征及预后的相关性,并分析KCNT2 作用相关信号通路。
1 材料与方法
1.1 原始数据的下载及预处理
从TCGA 官方网站(https://portal.gdc.cancer.gov/) 检索并下载肺腺癌的表达谱数据及相应临床信息。其中,基因表达谱数据包括肺腺癌组织样本497例,正常肺组织样本59例,纳入相关临床样本385例。整理RNA-seq样本并使用R语言进行归一化处理,同时对患者临床数据进行筛选和整理,删除临床资料中失访及目标信息不完整的病例。提取KCNT2单基因样本及相对应的临床资料样本,分析目标基因在肿瘤和正常肺组织的表达差异。
1.2 KCNT2 表达与肺腺癌临床病理特征及预后的相关性分析及验证
从385例临床样本中选取性别、年龄、T 分期、N分期、 M分期、AJCC分期作为肺腺癌临床病理特征指标,去除临床病理特征缺失或者不完全的病例69例,以KCNT2 在肺腺癌组织中表达水平的中位值(0.143)为界限,将肺腺癌患者分为KCNT2 高表达组(150例)和KCNT2 低表达组(166例),通过χ2检验比较两组临床病理特征的差异。根据在TCGA数据库下载整理的肺腺癌患者的临床信息,结合KCNT2表达量,利用单因素及多因素COX 分析KCNT2 表达与肺腺癌患者临床病理特征相关性;将样本KCNT2表达量和生存信息结合,分析KCNT2高表达组、低表达组总体生存率(OS)的差异;利用Kaplan-Meier Plotter在线数据库对肺腺癌数据集进行生存分析,进一步验证KCNT2的预后价值。
1.3 基因富集分析(GSEA)
应用GSEA 4.1.0版本软件对应分析KCNT2高表达组和低表达组对相关基因的影响。选用GSEA中C2.cp.kegg.V7.4.symbols.gmt规范化基因集,运用缺省加权富集统计方法,每次分析对基因组进行1000次排列。
1.4 统计学方法
应用SPSS 25.0软件,用Mann-Whitney U检验分析KCNT2在肺腺癌组织和肺正常组织样本中的表达差异;对KCNT2表达水平与肺腺癌患者临床病理特征的相关性进行χ2检验;单因素及多因素COX比例风险回归模型用于评价KCNT2与肺腺癌预后的关系;生存分析使用Kaplan-Mier法,生存曲线比较采用Log-rank检验。P<0.05为差异有统计学意义。
2 结果
2.1 肺腺癌组织、正常肺组织中KCNT2 表达水平的比较
KCNT2表达水平肺腺癌组织低于正常肺组织(P<0.01)(图1)。在52对配对的肺腺癌组织与癌旁正常组织样本中,肿瘤组织KCNT2 表达水平较癌旁正常肺组织也显著下调(P<0.01)(图2)。
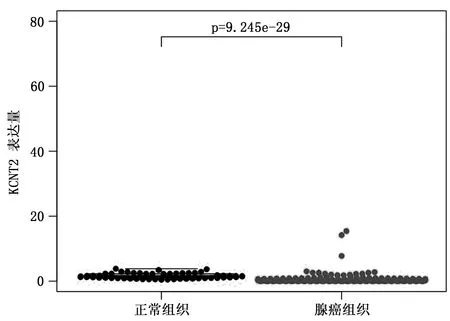
图1 TCGA-LUAD数据集中KCNT2在正常肺组织和肺腺癌组织中的表达比较
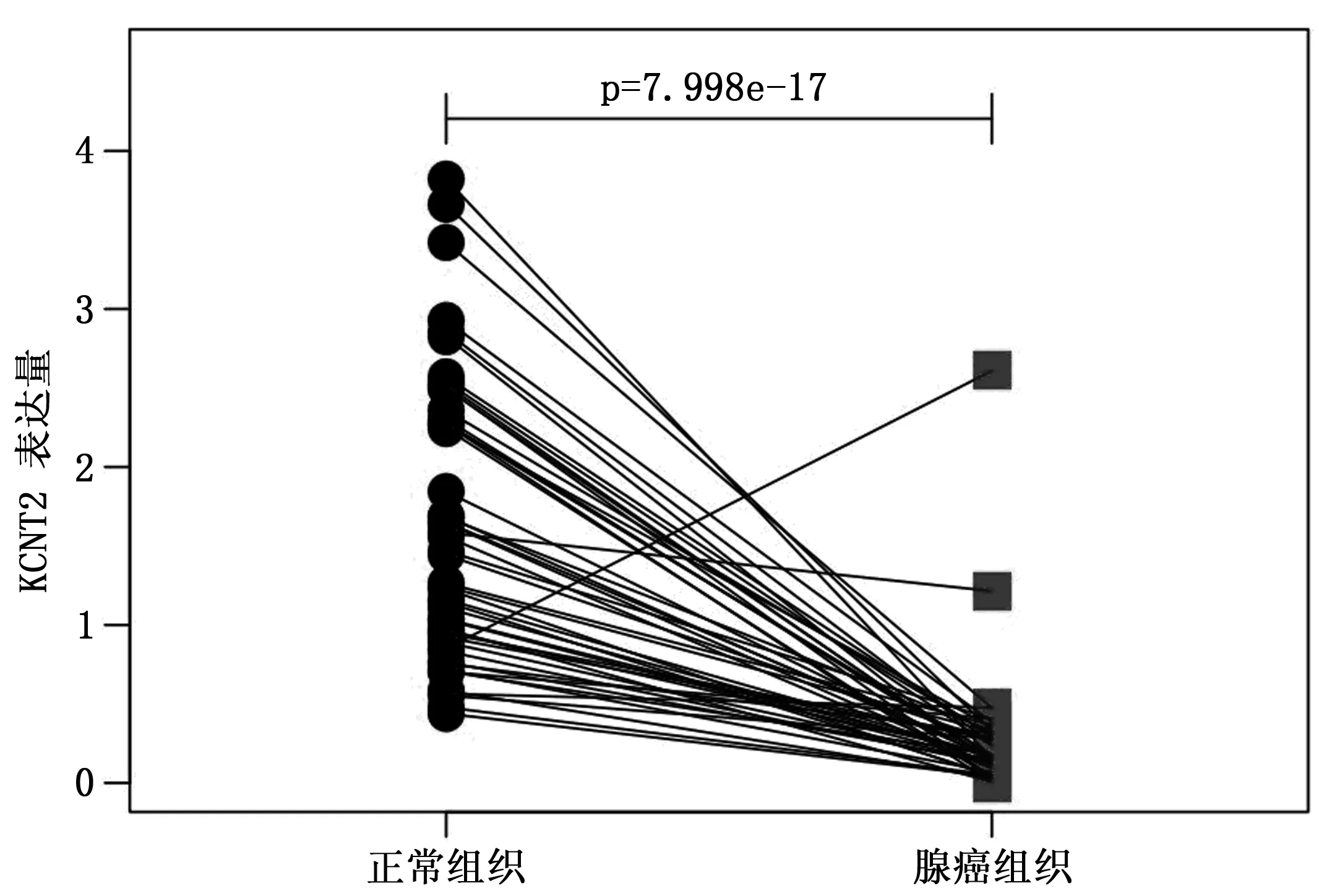
图2 TCGA-LUAD数据集中52对配对的肺癌组织和癌旁组织中KCNT2的表达比较
2.2 KCNT2基因表达与肺腺癌临床病理特征及预后的关系
肺腺癌组织中KCNT2基因表达水平与患者年龄、性别、Stage分期、T分期、M分期、N分期无相关性(P>0.05),与患者Stage分期相关(P<0.05),见表1;单因素COX分析结果显示,Stage分期、T分期、N分期均可以作为肺腺癌潜在的预后因素(P<0.01);多因素COX回归分析结果提示,Stage分期(HR=1.947,95% CI:1.236-3.066,P=0.004) 可以作为肺腺癌的独立预后影响因素(表2)。
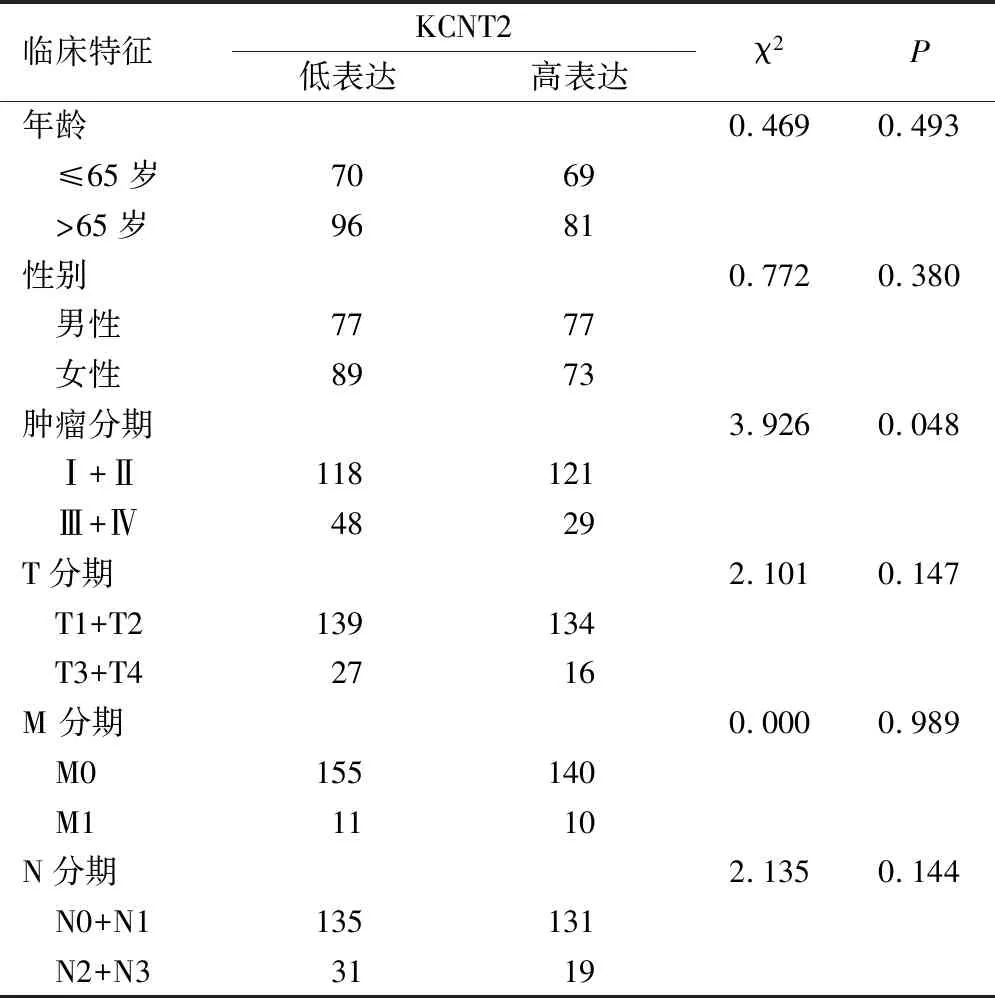
表1 KCNT2 基因表达与肺腺癌临床病理特征的关系/例
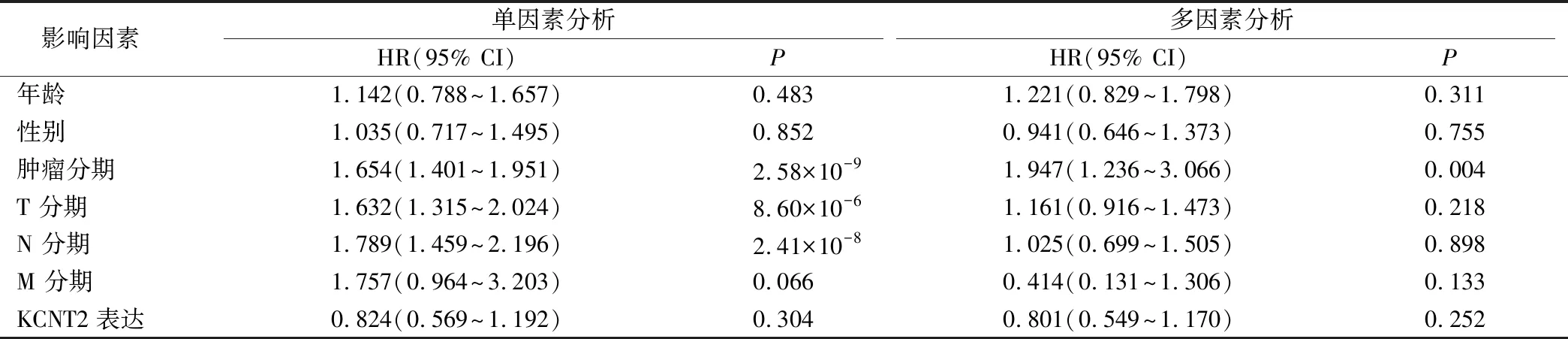
表2 肺腺癌患者单因素和多因素 COX 回归分析结果
2.3 KCNT2表达与肺腺癌预后的关系
KCNT2低表达与肺腺癌患者不良预后有关(P=0.035)(图3)。KaplanMeier-plotter 在线数据库分析结果表明,KCNT2低表达肺腺癌患者的OS 较低(P=0.017)(图4)。
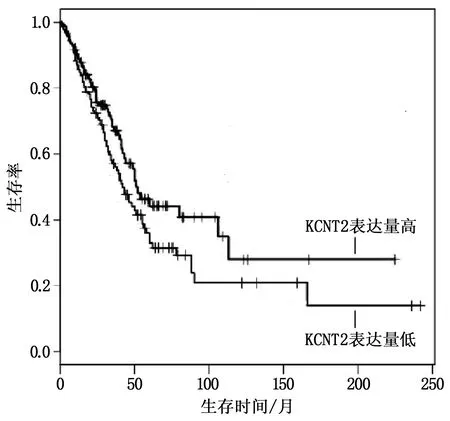
图3 TCGA-LUAD数据集中KCNT2表达量与患者预后的关系
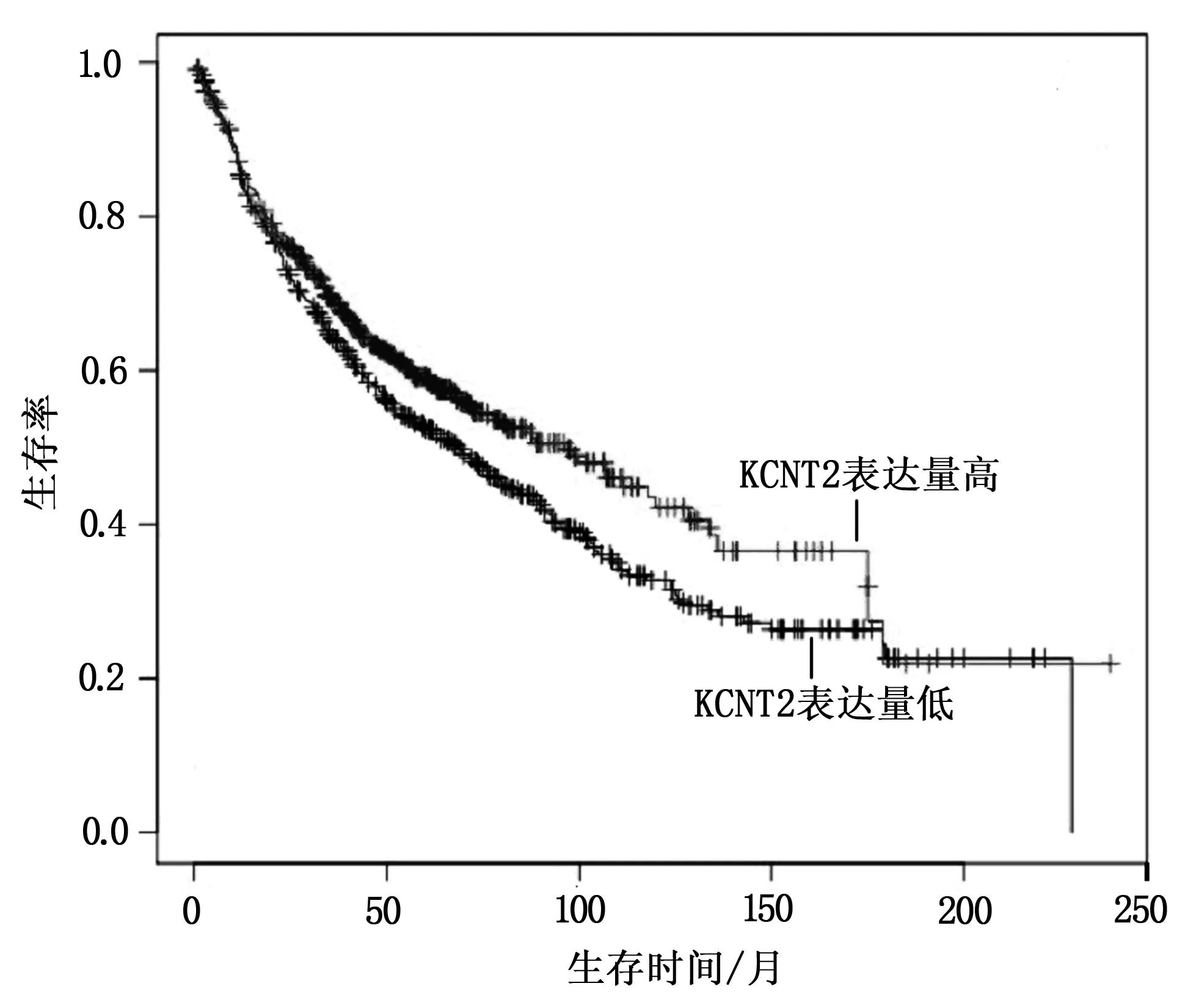
图4 KaplanMeier-plotter 在线数据库分析KCNT2表达量与患者预后的关系
2.4 KCNT2基因相关信号通路
KCNT2基因低表达样本主要富集在氧化磷酸化信号通路、核糖体、嘧啶代谢、精氨酸和脯氨酸代谢、谷胱甘肽代谢、RNA聚合酶等信号通路中(表3)。
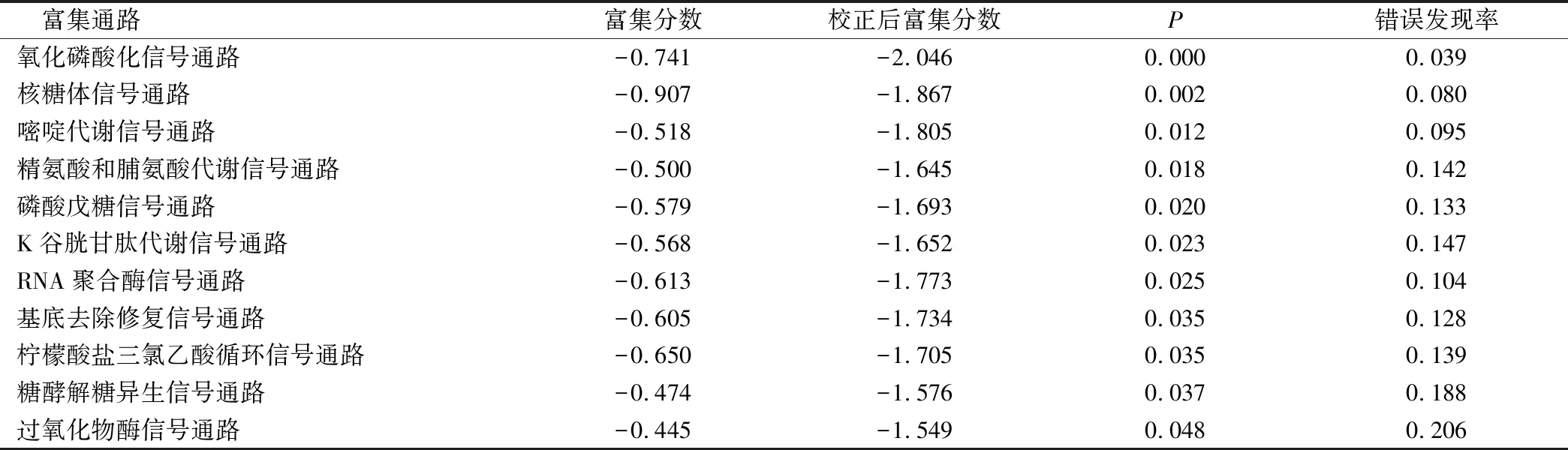
表3 KCNT2的功能富集分析
3 讨论
肺癌是全世界范围内发生率和死亡率最高的肿瘤,肺腺癌属于非小细胞肺癌的一类,是原发性肺癌中发生率最高的亚型,占到全部肺癌病例的40%且呈现持续上涨的趋势[9]。由于缺乏早期临床症状,很多肺癌患者确诊时已进入进展期,治疗效果不佳。发现新的分子标记物能够对肺癌的诊断及治疗提供理论依据,意义重大。
在电生理学或分子水平上有一类离子敏感性K离子通道,由细胞质Na离子升高而激活,这个家族,统称为钠激活钾离子通道(KNa )。该通道首先在豚鼠心肌细胞中被鉴定[10],随后,在各种神经元中报道了该通道[11-12]。KCNT1(SLACK)与 KCNT2(SLICK)同为编码钠激活钾离子通道家族蛋白的基因,有76%的结构相似性,两者共同形成一个四聚体通道,介导一系列神经元细胞的钠敏感性钾电流[13]。KCNT1 编码钠激活钾离子通道(KNa ),是目前已知最大的钾通道亚单位,在神经系统中广泛表达,参与癫痫的发病机制[14]。KCNT2和KCNT1具有类似的单通道电导作用,也可以通过细胞外Na离子激活。人类KCNT2基因约为400 kb,与大鼠氨基酸序列具有98%的同源性,表现出很强的进化保守性。与KCNT1相比,KCNT2通道对细胞内氯化物更敏感,KCNT2激活非常迅速[15]。研究显示,与KCNT1通道相比,KCNT2通道是唯一对细胞体积微小变化敏感的钾通道[16]。Danielle等研究显示KCNT2的表达受NFκB的控制,由于神经元NFκB的激活发生在缺氧和损伤等应激刺激过程中,因此KCNT2是一个神经保护基因[17]。最近的研究表明,KCNT2在一些肿瘤组织中也存在异常表达的情况,Lan等研究发现,胃癌组织及细胞系中KCNT2低表达,在胃癌细胞系中过表达KCNT2,可抑制细胞增殖,促进细胞凋亡[7]。我们的研究采用 TCGA 肺腺癌数据库分析正常肺组织与肺腺癌组织中KCNT2基因表达差异,并用临床数据分析其表达与预后的关系,发现肺腺癌组KCNT2 的表达水平低于正常对照组(P<0.05);KCNT2 低表达组生存率低于KCNT2 高表达组(P=0.035);单因素、 多因素 Cox 分析表明Stage 分期(HR=1.947,95% CI:1.236~3.066,P=0.004)可以作为肺腺癌的独立预后因素。GSEA分析首先运用预定义的基因集,将基因按照在两组样本中的表达差异程度进行排序,而后检验预定义的基因集是否富集在排序表的顶端或者底部,是当下研究基因表达差异富集信号通路的理想生物信息学方法。本研究利用GSEA方法预测KCNT2可能的调控信号通路,发现KCNT2 基因低表达样本主要富集在氧化磷酸化信号通路、核糖体、嘧啶代谢、精氨酸和脯氨酸代谢、谷胱甘肽代谢、RNA聚合酶等信号通路中。
综上所述,肺腺癌组织中 KCNT2 基因低表达,且与预后相关,可能是肺腺癌诊断和治疗的潜在生物标志物。 本研究利用 TCGA 数据库中肺腺癌的测序数据,纳入大量样本,临床资料相对完整,为后续研究KCNT2基因在肺腺癌中的发生机制及相关临床研究提供依据。在后续的研究中,课题组将采用 qPCR、Western blot和免疫组织化学法验证KCNT2(SLICK)的表达情况,并进一步研究其作用机制,为肺腺癌的基因靶向治疗提供新思路。

