间变型脑膜瘤临床病理分析
舒 炎 张 荣 李明娜 宋国新 李 海 潘敏鸿
间变型脑膜瘤(anaplastic meningioma,AM)非常少见,具有明显的恶性组织学特征:癌样、肉瘤样或恶性黑色素瘤样,以及高核分裂指数(≥20个/10HPF),相当于WHO Ⅲ级[1]。本文回顾17例AM患者临床资料,兹阐述其临床病理特征,旨在提高病理医师对该肿瘤的认识,减少误诊。
1 资料与方法
1.1 一般资料
病例来自南京医科大学第一附属医院病理科2014年1月至2020年12月手术诊治的脑膜瘤2144例,查阅病理报告,对Ⅱ级和Ⅲ级脑膜瘤切片重新复习,由两名以上高年资病理医师双盲阅片,参照中枢神经系统WHO分类(2016年修订版)[1],排除横纹肌样脑膜瘤及乳头状脑膜瘤,诊断AM共17例。临床病史和信息(包括性别、年龄、临床病史、手术情况)以及影像学资料(CT、MRI)均来自电子病历系统记录,随访资料来自门诊及电话随访。
1.2 方法
标本常规3.7%甲醛溶液固定,石蜡包埋切片,HE染色;免疫组化采用En Vision二步法。所用一抗:上皮细胞膜抗原(EMA)、波形蛋白(vimentin)、孕激素受体(PR)、S-100、Ki-67、神经胶质纤维酸性蛋白(GFAP)、广谱角蛋白(CKpan)、低分子角蛋白(CKL)、细胞角蛋白7(CK7)、CD34、生长抑素受体(SSTR2)、信号转导和转录激活因子6(STAT6)、D2-40、甲状腺转录因子1(TTF-1)、癌胚抗原(CEA),均购自福州迈新生物技术有限公司;采用艾德生物公司TERT/HRAS基因突变联合检测试剂盒,北京金菩嘉SYT基因断裂探针。NGS由江苏先声医学诊断有限公司检测。
2 结果
2.1 临床病理资料(表1)
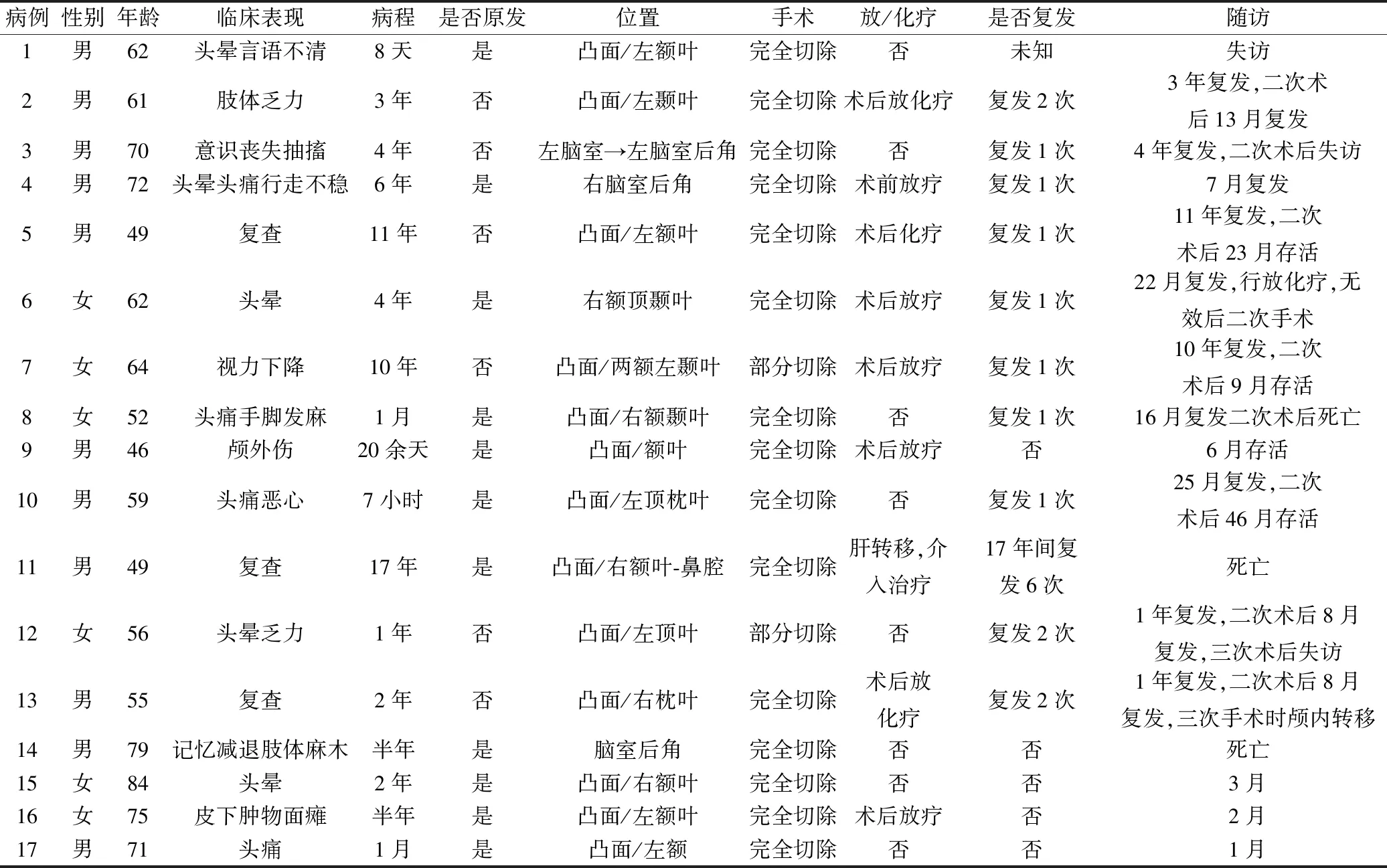
表1 17例AM临床病理特征
患者年龄46~84岁,平均年龄63岁,中位年龄62岁。男性11例,女性6例,男女比例为1.83∶1。临床表现为头晕、头痛、乏力、抽搐10例,视力下降1例,记忆力减退1例,形成皮下肿块伴面瘫1例,1例颅脑外伤时发现。12例病程相对较长,半年至17年不等,其中6例为低级别脑膜瘤术后突发症状加重或复查就诊;5例症状急、病程短。头颅MRI显示14例位于大脑凸面,其中额叶7例;脑室后角3例。增强扫描明显强化(15/17);肿块周围水肿(11/17);脑膜尾征(4/17)。影像学考虑脑膜瘤7例,其他考虑有转移瘤、胶质瘤、淋巴瘤、血管外皮瘤、脱髓鞘假瘤等。手术完全切除15例,部分切除2例。
2.2 病理检查
2.2.1 显微镜检查 本组病例表现出广泛的形态学谱系,瘤细胞间变显著,瘤细胞密集、多形性和异型性明显、核浆比升高、核分裂象≥20个/10 HPF。9例以脑膜上皮细胞为主,瘤细胞弥漫片状、巢团状或条索状排列(图1);7例以梭形细胞为主,呈席纹状、漩涡状或束状排列(图2);1例除可见脑膜上皮漩涡状结构、纤维肉瘤样成分以外,还可见类似于实体脏器的腺癌样成分,腺腔融合呈筛状(图3)或单个拉长、圆形、成角状散在分布于梭形细胞之间(图4),腺体之间未见明显的促纤维间质反应,腺体衬覆单层或复层立方上皮,核卵圆形或柱状,多位于基底部,核浆比升高,可见核分裂象,腺腔内侧可见明显的腔缘结构,局灶腔内可见黏液样分泌物,腔外侧未见明确的基底膜结构,说明该结构并非真正的腺腔,上皮与周围梭形细胞有移行现象。瘤细胞圆形、多角形或梭形;胞浆透明或嗜酸性;核圆形、卵圆形或梭形,核染色质空泡状或粗块状,核仁不明显到大红核仁均可见到,可见多核瘤巨细胞。9例可见典型的脑膜漩涡结构,7例可见沙砾体。间质血管丰富,圆形或鹿角状,厚薄不一,部分管壁透明变性,7例可见瘤细胞围绕厚壁血管呈乳头状排列,4例可见局灶血管外皮瘤样结构(图5),2例伴出血,2例伴局灶黏液变性。间质一般较少,常为局灶宽窄不等的硬化性胶原,1例显著胶原化类似于骨样基质(图6)。10例可见浸润脑实质,呈宽舌状、指状浸润或于VR间隙浸润,3例侵及骨组织,1例浸润横纹肌。15例可见大片状、地图状坏死。1例复发后行放化疗,术后标本可见大片状坏死伴泡沫细胞反应、点状钙化,新生的毛细血管呈结节状或栅栏状、屏障样排列。

图1 肿瘤呈弥漫片状、巢团状排列,瘤细胞间变特征明显(HE 低倍放大)
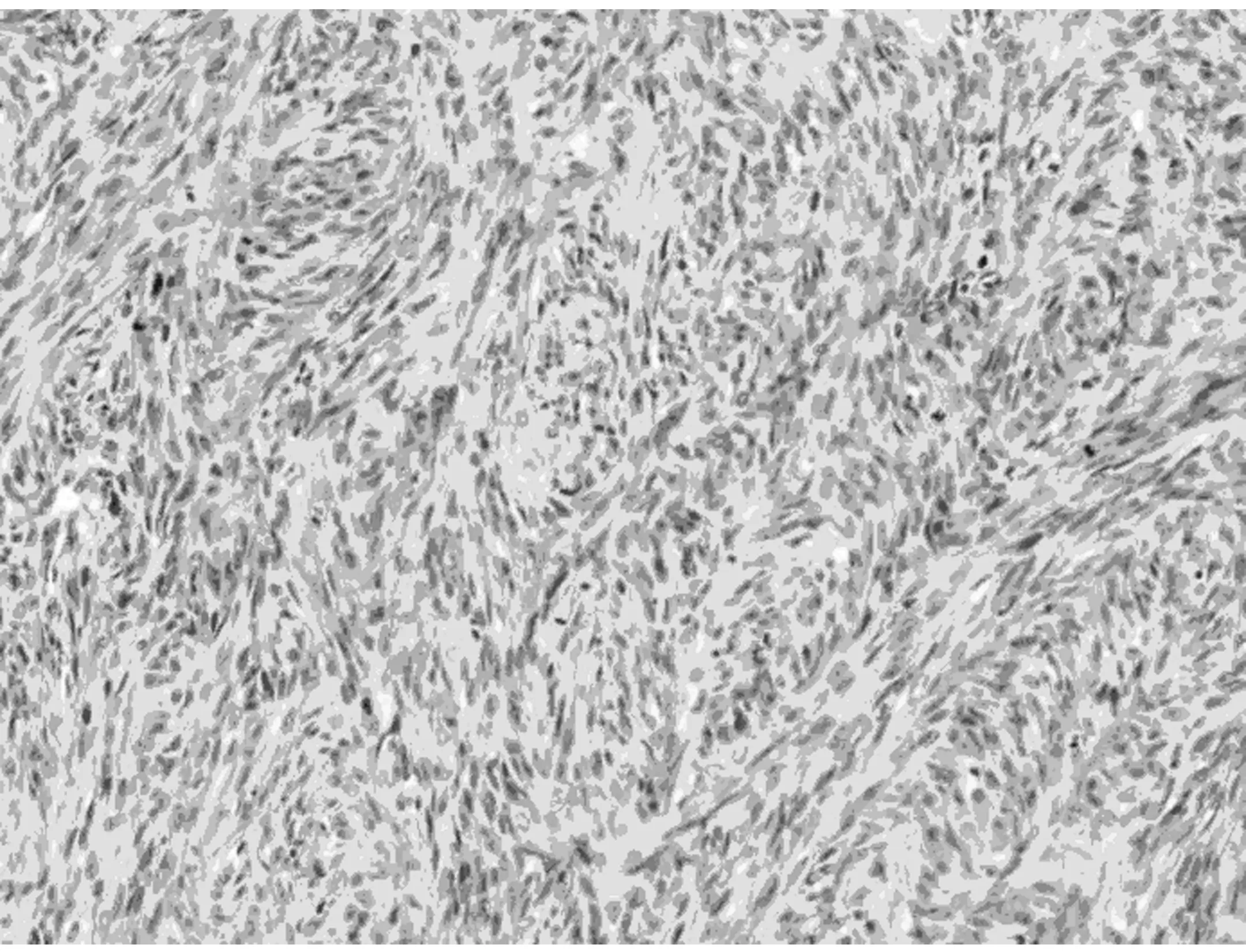
图2 肿瘤席纹状、束状排列,瘤细胞呈梭形,核分裂象易见(HE 中倍放大)
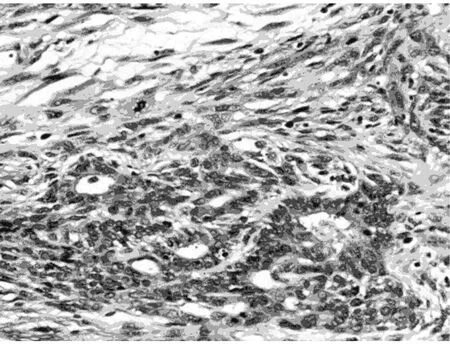
图3 腺腔样结构融合呈筛孔状,与周围梭形细胞有移行(HE 中倍放大)
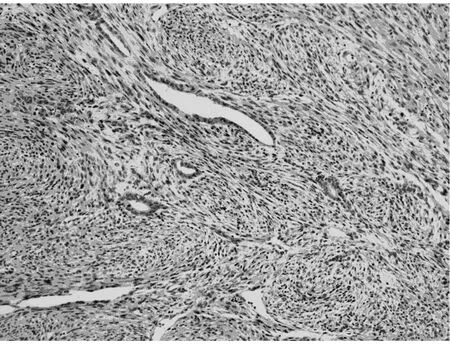
图4 腺腔样结构呈单个、成角状散在分布于梭形细胞中(HE 低倍放大)
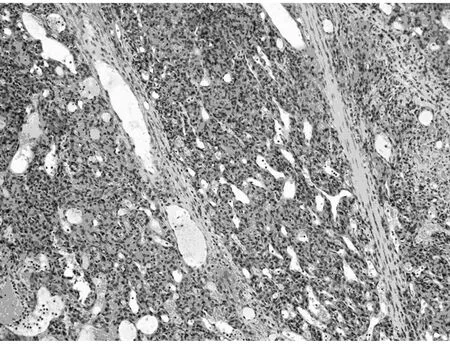
图5 肿瘤间质血管不规则扩张,呈血管外皮瘤样(HE 低倍放大)
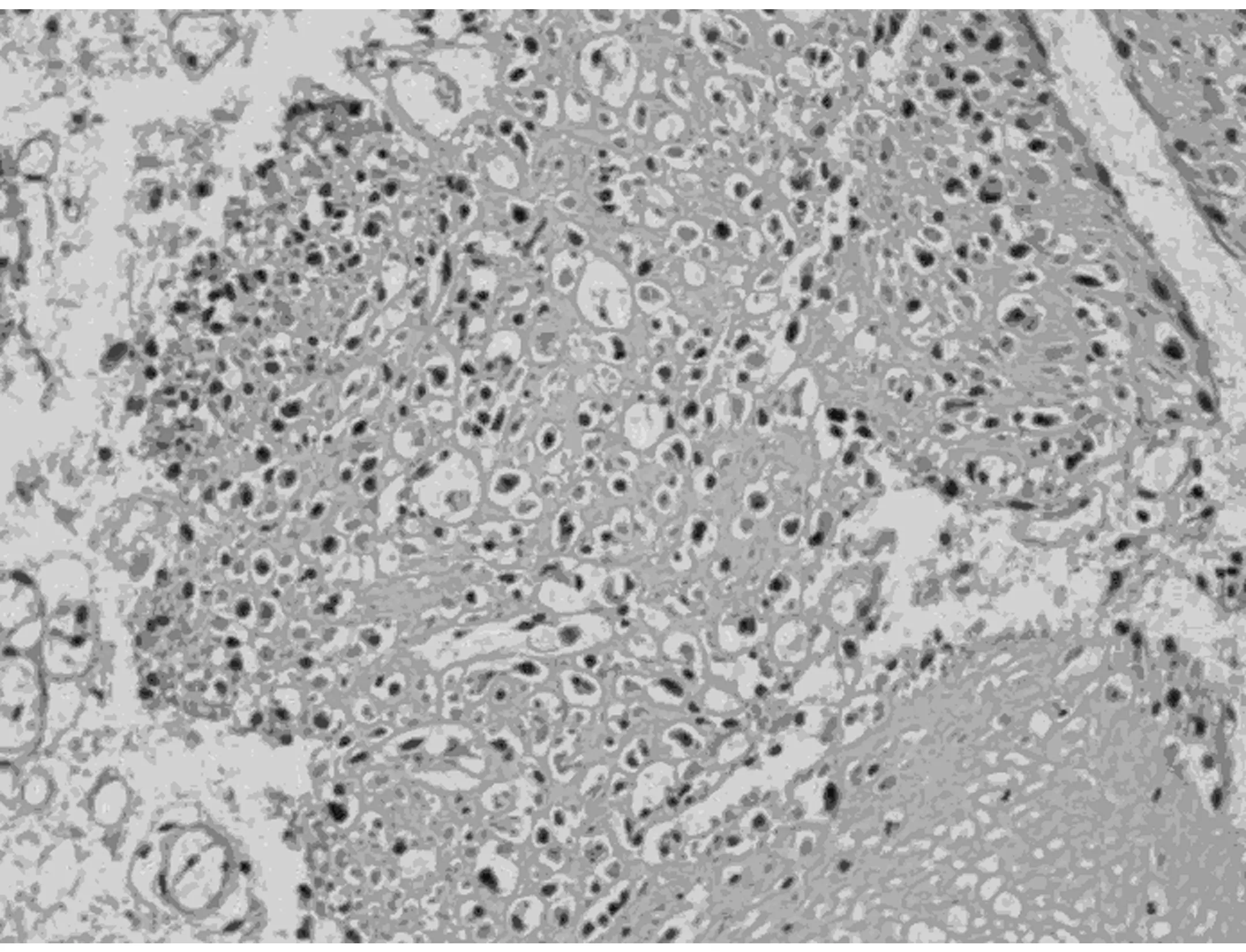
图6 肿瘤间质可见硬化的胶原,类似于骨样基质(HE 中倍放大)
2.2.2 免疫组织化学 肿瘤细胞不同程度表达SSTR2(16/17)、EMA(15/17)、vimentin(17/17)、CKpan(8/17)和PR(9/17),D2-40(16/17),CD34局灶阳性(4/17),S-100散在阳性(3/17),均不表达GFAP、STAT6,Ki-67 15%~80%。伴有腺癌样化生的1例中,脑膜瘤区SSTR2、EMA、vimentin阳性表达,腺癌样区EMA、vimentin散在阳性,SSTR2阴性;CKpan、CKL、E-cadherin在脑膜瘤区和腺癌样区中均呈阳性,但腺癌样区阳性更强;CK7仅在腺癌样区点状阳性,脑膜瘤区阴性;PR、CD34、STAT6、S-100、TTF-1、CEA均阴性。
2.2.3 分子遗传学 1例行NGS检测示:NF2缺失、PTEN缺失,1p、19q、10号染色体未见缺失,7号染色体未见扩增。2例行ARMS法检测,TERT 启动子C228T/C250T均为野生型。1例行FISH检测,SYT未见断裂重组。
2.3 随访
本组17例中6例于1~11年间由低级别脑膜瘤进展为AM,11例为原发性AM。原发性AM中 5例于7~25个月复发1~6次,转移2例,其中1例复发6次累及脑室、眼眶、鼻窦、鼻腔等,且影像学提示有肝转移行介入治疗,1例转移至小脑幕,3例死亡。5例行术后放疗,其中1例术后放疗1年后复发,再放化疗后肿瘤仍增大,遂再次手术;另有2例术后放化疗,其中1例随访13个月后影像学提示复发;1例发现占位6年,期间多次行伽马刀治疗无效后方行手术。
3 讨论
AM占所有脑膜瘤的2%~3%,近一半病例为低级别进展而来,亦可一开始即为原发[2],多见于50~59岁成年人,好发于男性,男女比例1.7∶1[1,3]。儿童脑膜瘤以非典型或恶性脑膜瘤居多,占20%~25%[4]。本组17例AM患者均为成人,中位年龄62岁,男女比例1.83∶1,占同期本科室确诊脑膜瘤的0.8%。脑膜瘤通常发生于大脑凸面或颅底,临床表现与肿瘤部位和大小有关,可出现头痛头晕、恶心呕吐、癫痫、听觉或视觉丧失[3,5]。影像学MRI可见瘤周水肿、脑膜尾征,增强扫描可见强化。
AM组织学异质性明显,如找到特征性的脑膜漩涡结构即可明确脑膜来源,瘤细胞嗜酸性,核卵圆形至梭形,通常具有中央透明的染色质,可见核内假包涵体,核仁明显。可见大片或地图状坏死,明显的脑实质浸润,亦可侵及颅外软组织,形成皮下肿块,可伴有黄色瘤样、软骨、骨、脂肪、间叶组织和黏液等多种化生[6]。本组1例可见腺腔样结构,该患者38岁首次手术,复习切片,核分裂象约7个/10 HPF,未见腺腔样结构,诊断非典型性脑膜瘤,术后11年间未见其他脏器恶性肿瘤病史,定期复查示脑膜瘤复发,再次手术病理可见腺腔与周围梭形细胞移行过渡,核分裂象>20个/10 HPF,诊断AM伴腺癌样化生,国内未见报道,国外文献仅报道5例[7]。腺癌样化生多见于高级别脑膜瘤(5/6例),男性多见(4/6例),多为肿瘤复发时出现腺癌样化生(4/6例),第一例为首次手术时即出现,其在影像学提示脑膜瘤后经历10年,由于肿块生长迅速方进行手术,镜下Ⅰ级脑膜瘤和腺癌样成分之间可见Ⅱ级脑膜瘤,提示为肿瘤的恶性转化。免疫组化显示脑膜瘤和腺癌样成分均表达AE1/AE3、CAM5.2,个别可表达肠型腺癌的标志物,分子遗传学22q、1p、14q染色体缺失提示二者同源[7]。
脑膜瘤常用的免疫组化标记有vimentin、EMA和SSTR2,70~80%表达PR。有学者对127例脑膜瘤研究发现SSTR2敏感性95.2%,特异性92%;SSTR2和(或)EMA敏感性100%,特异性94.8%[8]。恶性脑膜瘤可表达上皮性标志物,如p63、p40、CK和E-cadherin,D2-40表达不具有特异性,但几乎可见于所有脑膜瘤[9]。伴有腺癌样成分的病例中,CKpan、CKL、E-cadherin在脑膜瘤和腺癌样区中均阳性,但腺癌样区表达明显更强,EMA、vimentin在脑膜瘤区中阳性表达,腺癌样区散在个别细胞或弱阳性表达,提示脑膜瘤区和腺癌样区同源性,诊断名称使用腺癌样化生比较妥当。
分子遗传学研究显示,脑膜瘤分子改变与肿瘤位置、肿瘤级别密切相关。约50%散发性脑膜瘤可出现22号染色体上NF2基因等位突变或缺失,NF2突变常见于WHOⅠ级脑膜瘤,高级别脑膜瘤亦可发生[10]。几乎所有NF2突变和(或)22号染色体缺失的脑膜瘤更具有侵袭性、基因不稳定性,且男性多于女性,多位于大脑半球、小脑半球、脊髓部位[11]。本组1例NGS检测显示NF2缺失,该患者术后14月、21月分别复发,且第三次手术时已有颅内转移,证实NF2突变型脑膜瘤预后差。近年研究证实10%的Ⅰ级脑膜瘤,50%Ⅱ级脑膜瘤,95%Ⅲ级脑膜瘤可出现TERT活化,TERT启动子突变(g.228C>T和g.250C>T)与复发性脑膜瘤呈明显相关性,且在复发性脑膜瘤中TERT突变频率与组织学进展相关[10]。本组2例均未检测到TERT突变,可能与一代测序检测方法的局限性有关,有待今后加大样本量进一步研究。
AM形态学谱系复杂,需结合MRI及临床病史综合分析。本组伴有腺癌样化生的病例主要需与以下肿瘤鉴别:①腺癌转移到脑膜瘤中:脑膜瘤是最常见的受体病变,脑膜瘤常为良性,最常见的供体肿瘤是肺癌、乳腺癌,有实体脏器恶性肿瘤病史可鉴别[12]。②滑膜肉瘤:常见于四肢深部软组织,具有间叶和上皮双相分化,上皮样细胞常形成腺样结构,均表达EMA,大部分也表达SSTR2[8],但分子遗传学具有特征性SYT基因断裂重组。③分泌型脑膜瘤:形态学呈良性表现,可见多少不等的微腺腔,腔内见红染的分泌物,腺腔表达CK、CEA、EMA等上皮性标志物,几乎均能检测到TRAF7和KLF4K409Q突变[10]。④恶性黑色素瘤:转移至颅内可呈脑膜漩涡样排列,瘤细胞异型明显,如无已知病史与AM难以鉴别,应仔细寻找皮肤(特别是头皮)可疑的色素痣,瘤细胞内色素颗粒有助鉴别。免疫组化S-100、SOX-10、HMB45、MelanA常阳性。⑤孤立性纤维性肿瘤/血管周细胞瘤:临床表现及术前MRI无特异性,镜下形态谱系较宽,可从细胞丰富区和细胞疏松区交替分布,到富于细胞弥漫排列,间质可见不规则分支状、鹿角型血管,胶原宽带状或稀少,分子遗传学出现NAB2-STAT6基因融合,免疫组化STAT6核阳性。⑥恶性外周神经鞘膜瘤(MPNST):颅内罕见,常起源于桥小脑角神经鞘瘤,由排列紧密、条束状增生的梭形细胞组成,瘤细胞异型明显,核分裂易见,免疫组化S-100、SOX10不同程度阳性,p53常常阳性,69%存在H3K27Me3的缺失,上皮样MPNST可出现INI-1丢失[13]。
AM首选手术切除和放疗,肿瘤侵袭性强,即使完整切除后5年复发率仍高达80%[14],5年总体生存率30%~60%[2]。AM易侵犯脑组织,罕见颅外转移,当发生颅外转移时,常转移至肺,其次是肝、淋巴结及骨[3]。放疗价值存在争议,即使广泛切除加立体定向放疗,5年整体生存率仍低于60%,复发性脑膜瘤可选用化疗,但对手术和放疗难治性脑膜瘤效果不佳[6]。

