幽门螺杆菌6S RNA敲除菌株构建及对细胞毒性的影响
崔古贞,管玉祝,刘 芳,王鑫鑫,吴道艳,洪 伟,3,向 松,张峥嵘,张玉典,陈峥宏
幽门螺杆菌(Helicobacterpylori,Hp)是一类定植在人类胃粘膜上皮细胞可引起慢性胃炎、胃溃疡、十二指肠溃疡、胃癌等多种疾病的主要病原体[1-3]。全球约50%以上人口感染Hp,仅我国感染人数就达7亿之多,是人类最大的潜在危害因素之一,被世界卫生组织列为I类致癌因子[3-5]。深入研究Hp致病机理及其调控机制,对Hp感染、预防、治疗及疫苗研发等方面具有重要意义。
6SRNA是一类与RNA聚合酶(RNA polymerase,RNAP)全酶特异性结合干扰靶基因转录的非编码小调控RNA[6-7]。6SRNA由一个带有中间环的双链发卡结构组成,与解链的DNA启动子结构相似,可与解链的DNA启动子竞争结合RNAP,从而抑制靶基因表达。因此,6SRNA作为一类抗转录因子(Anti-Transcription Factor)调控RNAP活性[8-10](图1)。

A:幽门螺杆菌6S RNA(Hp-6S RNA)二级结构示意图;B:解链启动子结构示意图;C:6S RNA调控模型图1 6S RNA结构及调控模型Fig.1 6S RNA structure and regulation model
近来,利用差异RNA测序发现Hp也编码一类特殊的6SRNA(我们称之为Hp-6SRNA),能以自身RNA为模板转录产生两类不同的小产物RNA(pRNA),可能具有调节自身活性的功能[11]。此外,由于Hp缺乏多种常规操纵子,没有RNA分子伴侣(Hfq)辅助RNA加工和成熟,仅有3种RNA聚合酶转录调控因子(σ80、σ54和σ28),编码的转录调控因子极其有限[12-13]。因此,我们推测Hp-6SRNA可能具有调控多种细胞表型的重要功能。
为了研究Hp-6SRNA的生物学功能及其对Hp毒力的影响,本文构建了Hp-6SRNA敲除载体,并利用同源重组技术敲除了Hp-6SRNA基因,成功获得了HpΔ6SRNA工程菌株,并检测了Hp-6SRNA敲除对幽门螺杆菌生长及细胞毒力的影响,为Hp-6SRNA生物学功能及转录调控机制研究奠定了基础。
1 材料与方法
1.1 实验材料
1.1.1 培养基及培养方法 大肠杆菌E.coliDH5ɑ菌株在LB液体培养基(1%氯化钠,1% 胰蛋白胨,0.5% 酵母抽提物)中置于180 r/min、37 ℃条件下震荡培养。菌落筛选时利用LB固体培养基(LB液体培养基中补充1.5%琼脂),置于37 ℃恒温培养箱中静置培养,必要时补充终浓度50 μg/mL的卡那霉素。
幽门螺杆菌(ATCC_700392)利用BHI液体培养基(含10%胎牛血清)置于10% CO2、120 r/min、37 ℃微需氧条件下振荡培养。菌落筛选时利用含10%脱脂棉羊血的BHI固体培养基(1.5%琼脂)于10% CO2、37 ℃微氧条件下培养,必要时补充终浓度25 μg/mL的卡那霉素。
1.1.2 主要试剂及仪器
1.1.2.1 主要试剂 限制性核酸内切酶、T4连接酶购自赛默飞世尔科技(中国),细菌基因组DNA提取试剂盒、质粒提取试剂盒、琼脂糖凝胶DNA回收试剂盒购自天根生化科技(北京)有限公司,抗生素、胰蛋白胨、酵母抽提物等常规生化耗材购自索莱宝科技有限公司,引物均由上海生物工程有限公司合成。
1.1.2.2 主要仪器 隔水式培养箱(武汉精华,303A13-4型),全温振荡器(朗越仪器,RH-Q型),光学显微镜(重庆奥特光学仪器,SMART系列),基因导入仪(东芝-SCIENTZ),PCR仪、离心机(赛默飞世尔科技有限公司),电泳仪(北京六一,DYY-7C型),凝胶成像分析系统系统(北京百晶生物技术有限公司),CO2培养箱(Heal Force,HF151型),实时荧光定量PCR仪(Applied Biosystems)。
1.1.3 引物 本研究所用引物详见表1。

表1 本研究所用的引物Tab.1 Primers used in this study
1.2 质粒构建 首先,以Hp26695基因组DNA为模板,以6S-QU1/6S-QD1为引物,PCR扩增6SRNA基因上游同源臂(Up),利用EcoRI与PstI酶切后与经同源酶切的pSD质粒连接,构建上游同源臂载体pSD-6S-U;然后,以Hp26695基因组DNA为模板,以6S-QU2/6S-QD2为引物,PCR扩增6SRNA基因下游同源臂(Down),利用BamH I与ClaI酶切后与经同源酶切的pSD-6S-U质粒连接,构建6SRNA基因敲除载体pSD-6S(图2A)。将6SRNA基因与CatP基因链接后经XbaI和BglII双酶切后与经同样双酶切的pSD-LctP质粒链接构建回补质粒pGZ-6SRNA。PCR扩增条件:预变性94 ℃ 2 min;94 ℃ 30 s、55 ℃ 30 s、72 ℃ 30 s,循环30次;终延伸72 ℃ 2 min。
1.3 感受态细胞制备及转化子筛选 感受态细胞制备:首先,接种Hp26695菌种至BHI 血琼脂平板,置于37 ℃微需氧(10% CO2、5% O2、85% N2)条件下培养1~2 d;然后,用接种环刮取Hp菌体至预冷的感受态制备缓冲液(15%甘油,9%蔗糖),菌悬液浓度稀释至1×108~1×109CFU/mL,然后利用预冷的感受态制备缓冲液离心(4 ℃,5 000 r/min,5 min)洗涤3次;最后,将菌悬液以50 μL/管进行分装,-80 ℃冻存备用。
遗传转化及转化子筛选:首先,取-80 ℃冻存的感受态细胞于冰上解冻,加入0.5~2 μg质粒混匀后置于冰上2~5 min,吸取混合液至预冷的0.2 mm的电击杯中,冰上继续放置1 min;然后,利用电转化方法进行基因转移,电转条件设置为2.5 kV、50 Ω、1 F,电转后立即向电击杯中加入100 μL胎牛血清,混匀后吸出接种至BHI血琼脂平板,于37 ℃、微需氧条件培养24 h,收集菌体于0.85%生理盐水中,混匀接种于含卡那霉素的BHI血平板,37 ℃、微需氧继续培养5~7 d;最后,挑取卡那霉素抗性平板上生长的菌落,液体培养后提取基因组DNA,利用引物Kan-1/Kan-2、6S-QD1/6S-QU2进行PCR鉴定,同时以野生型Hp26695基因组DNA做对照,利用琼脂糖凝胶电泳检测6SRNA基因敲除情况。
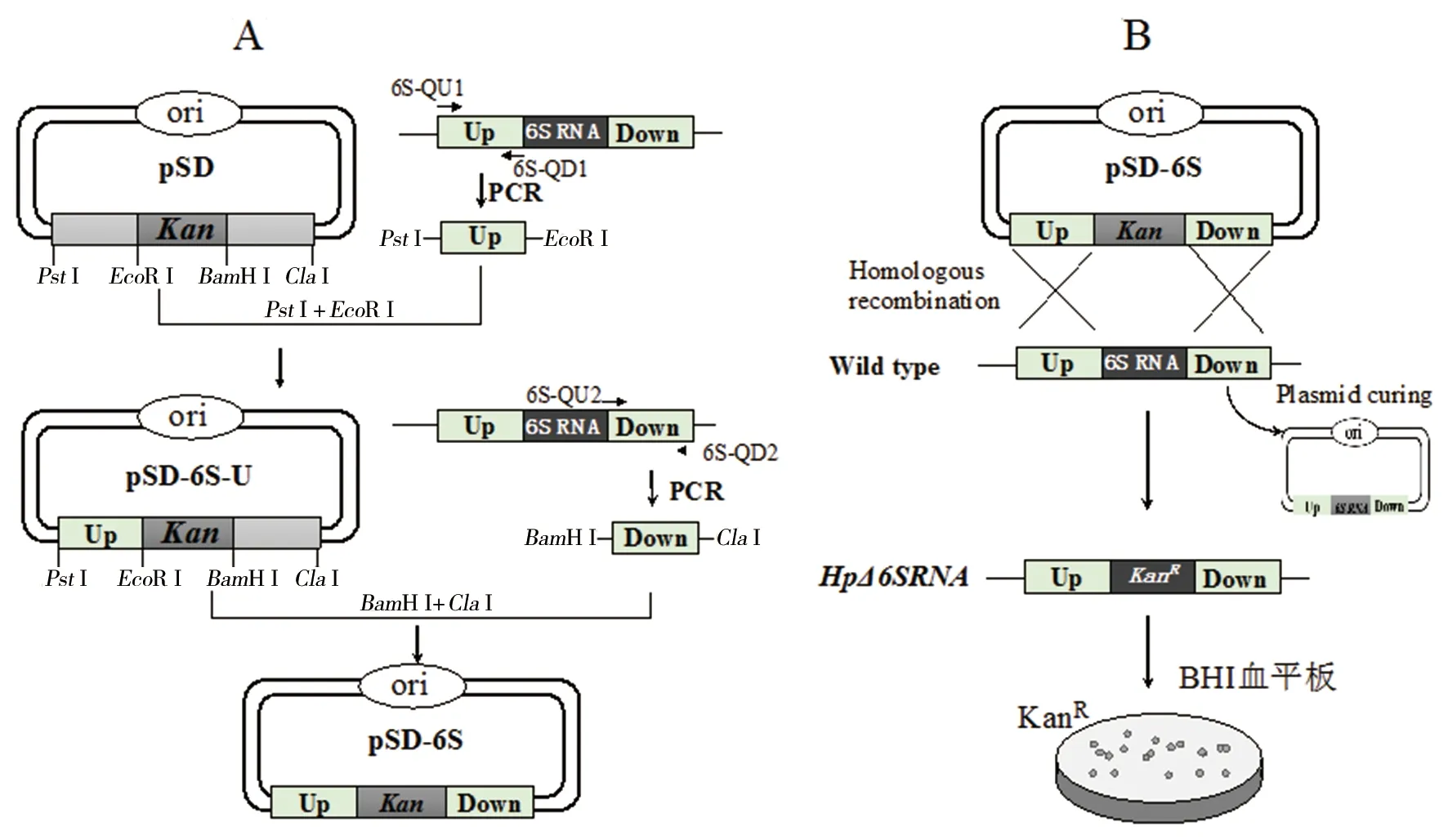
A:6S RNA敲除质粒构建示意图;B:6S RNA敲除菌株筛选示意图图2 幽门螺杆菌6S RNA敲除质粒构建及敲除菌株筛选示意图Fig.2 Construction of the 6S RNA knockout plasmid for H. pylori and screening of the knockout strain
1.4 RNA制备及qRT-PCR 根据总RNA制备试剂盒(RNAprep Pure,天根生化科技有限公司)操作说明提取野生菌株及工程菌株的总RNA,利用HiFiScript cDNA试剂盒(北京康为世纪,CW2569M)制备cDNA,最后,根据UltraSYBR mixture试剂盒操作说明进行qRT-PCR扩增。
1.5 扫描电镜观察 将-80 ℃保存的幽门螺杆菌接种至BHI固体培养基,挑取单菌落与BHI液体培养基中置于37 ℃、微需氧条件下培养24 h,离心收集菌体,1×PBS缓冲液洗涤2~3次,加2.5%固定液固定过夜,电镜观察幽门螺杆菌细胞表面形态的变化。
1.6 生长曲线 首先,将-80 ℃保存的幽门螺杆菌接种于BHI血琼脂固体培养基上,37 ℃、10% CO2微需氧条件下培养2~3 d,挑选固体培养基上透明针尖样菌落接种至新鲜的BHI血琼脂固体培养基继续培养2~3 d后;然后,用接种环取适量细菌至0.85%无菌生理盐水中,制备麦氏2.0的菌悬液,按1∶100比例接种至含10%胎牛血清的BHI液体培养基(pH7.5)中,于37 ℃、120 r/min、微需氧条件下振荡培养,绘制不同菌株的生长曲线。
1.7 幽门螺杆菌胞内提取物制备 分别取100 mL培养 24 h、36 h、48 h和60 h的细菌培养液于4 ℃、5 000 r/min条件下离心收集菌体,加入10 mL RPMI 1640培养液混匀后置冰上超声破碎(10 s/10 s,30 min),离心后收集上清并用 0.22 μm 滤膜过滤,利用BCA法测定蛋白浓度。
1.8 细胞培养及细胞毒性分析 取100 L GES-1胃粘膜上皮细胞悬液(5103)加入96孔板中,置于37 ℃、5% CO2培养箱中培养24 h,然后分别取10 L幽门螺杆菌培养上清液及胞内提取物(蛋白浓度为2.5 mg/mL)加入细胞培养孔中,充分混匀后继续培养48 h,在每孔内加入10 L的CCK-8试剂(日本DOJINDO 公司),在培养箱内继续培养4 h,利用酶标仪检测450 nm处的吸光度。
2 结 果
2.1Hp-6SRNA转录分析 取培养至对数期的幽门螺杆菌分别接种至BHI培养基中于37 ℃、150 r/min、微需氧(10% CO2,5% O2,85% N2)条件下培养,提取总RNA,利用qRT-PCR分析Hp-6SRNA转录的影响。结果如图3所示,Hp-6SRNA在对数期转录最丰富,随细胞生长其转录强度逐渐降低,至生长末期几乎不转录,表明Hp-6SRNA可能在生长前期对幽门螺杆菌起主要调控作用。

图3 6S RNA在不同生长阶段转录分析Fig.3 Transcriptional analysis of 6S RNA at different growth stages
2.2Hp-6SRNA敲除菌株及回补菌株构建 以pSD自杀质粒为基础,将6SRNA上下游同源臂构建到卡那霉素抗性基因两侧,构建6SRNA基因敲除质粒pSD-6S(质粒构建流程详见图2),利用PCR检测敲除质粒,如图4A所示,测序证实质粒构建成功。然后,将敲除质粒pSD-6S利用电转化方法转化Hp26695,涂布卡那霉素抗性平板,筛选阳性菌株,利用PCR进行检测,琼脂糖凝胶电泳分析条带大小与预期一致(图4B),表明Hp-6SRNA敲除菌株构建成功,工程菌株命名为:HpΔ6SRNA。利用同样方法将回补质粒pGZ-6S RNA转化到HpΔ6SRNA中,构建回补菌株HpΔ6SRNA::6SRNA,氯霉素抗性筛选及PCR检测与预期结果一致(图4C),表明回补菌株构建成功。

A:6S RNA敲除载体PCR检测,泳道1:引物6S-QU1和6S-QD1;泳道2:引物6S-QU2和6S-QD2。B:6S RNA敲除菌株(HpΔ6S RNA)PCR检测,引物6S-QD1和6S-QU2,泳道1:野生型对照;泳道2:HpΔ6S RNA。C:6S RNA回补菌株(HpΔ6S RNA::6S RNA)PCR检测,泳道1:引物pGZ-1和pGZ-2,HpΔ6S RNA::6S RNA;泳道2:引物pGZ-6sTY1和pGZ-6sTY2,HpΔ6S RNA::6S RNA;泳道3:引物pGZ-1和pGZ-2,野生型对照;泳道4:引物pGZ-6sTY1和pGZ-6sTY2,野生型对照;泳道5-6:空白对照。图4 6S RNA敲除菌株及回补菌株PCR检测Fig.4 PCR detection of the Hp-6S RNA knockout vector and strain
2.3Hp-6SRNA敲除对幽门螺杆菌生长的影响 如图5所示,6SRNA敲除后细菌生长方式显著改变,细菌生长迟缓期延长,表明6SRNA可能在幽门螺杆菌生长初期起重要的调控作用。然而,6SRNA基因回补之后,回补菌株的生长方式与敲除菌株类似,并没有恢复到野生型(图5)。

图5 幽门螺杆菌生长曲线Fig.5 Growth curve of H. pylori
2.4Hp-6SRNA敲除影响了幽门螺杆菌上游基因表达 为了检测6SRNA敲除对幽门螺杆菌上下游基因表达的影响,我们提取细菌总RNA后逆转录为cDNA,通过实时荧光定量PCR进行检测。如图6所示,6SRNA敲除后对下游基因Hp1217和Hp1218表达水平影响较小,但显著增强了其上游基因Hp1220和Hp1221的表达。尽管6SRNA基因回补能够恢复Hp1220和Hp1221的表达,但Hp1220基因的表达仍显著增强(图6)。上述结果表明6SRNA基因敲除影响其上游基因的表达,可能与上游基因存在一定的连锁关系。

A:6S RNA基因所在位置示意图。Hp1218编码甘氨酰胺核苷酸合成酶基因purD,Hp1220编码ABC家族转运酶基因yhcG;B:6S RNA上下游基因相对转录水平图6 6S RNA敲除对上下游基因水平表达的影响Fig.6 Effects of 6S RNA knockout on the expression of upstream and downstream genes
2.5Hp-6SRNA敲除对细菌形态的影响 为了检测6SRNA敲除对细菌形态的影响,我们取对数生长期的幽门螺杆菌进行了扫描电镜观察(图7)。电镜观察结果表明,野生菌株与敲除菌株其细菌形态均呈现弯曲杆状,未见显著变化。尽管电镜下发现部分菌体出现球变现象,但球变是多数幽门螺杆菌培养过程中经常出现的正常现象,且野生株与突变株均存在球变现象。总之,扫描电镜结果表明6SRNA敲除对细菌表面形态无显著影响。

A:6S RNA野生型;B:6S RNA敲除菌株图7 扫描电镜观察幽门螺杆菌Fig.7 Scanning electron microscopy for H.pylori
2.6Hp-6SRNA敲除降低了幽门螺杆菌对GES-1细胞的毒性 为了分析6SRNA敲除对幽门螺杆菌毒力的影响,我们利用CCK8实验比较分析了野生菌株与6SRNA敲除菌株的培养上清液及细胞内容物对GES-1胃粘膜上皮细胞毒性的影响。如图8所示,6SRNA敲除后,细菌培养上清液对GES-1细胞的毒性降低(OD450的吸光度增加),尽管在培养36 h时上清液毒性变化不显著,但在整个细菌生长周期敲除菌株的毒性均有所下降(图8A)。此外,6SRNA敲除后,细胞内容物的毒性也显著降低,尤其是在细菌生长中后期(48 h和60 h),其细胞毒性降低更为显著(图8B)。从图3可知,6SRNA在细菌生长中后期显著下降,预示6SRNA不仅对细菌生长周期具有调控功能,而且可能负调控细菌毒力相关基因的表达。
另外,我们发现无论是野生菌株还是突变菌株,利用培养上清液处理组的OD450吸光度显著低于细胞内容物处理组,表明幽门螺杆菌培养上清液对GES-1细胞的毒性显著高于细胞内容物的毒性,进一步说明幽门螺杆菌可能合成大量的胞外毒力因子辅助细菌的定植和其他生理功能。总之,6SRNA敲除降低了幽门螺杆菌对GES-1胃粘膜上皮细胞的毒性,表明6SRNA在调控细菌毒力因子方面具有重要功能。

A:幽门螺杆菌培养上清液对GES-1细胞毒性的影响;B:幽门螺杆菌细胞内容物对GES-1细胞毒性的影响图8 6S RNA敲除对GES-1细胞毒性的影响Fig.8 Effect of 6S RNA knockout on the cytotoxicity of GES-1
3 讨 论
6SRNA作为一种非编码小调控RNA在多个物种中具有重要的调控功能。本文敲除6SRNA后,发现幽门螺杆菌生长迟缓期显著延长,表明6SRNA参与幽门螺杆菌生长调控的变化,并影响幽门螺杆菌培养上清液和细胞内容物对GSE-1胃粘膜上皮细胞的毒力,表明6SRNA具有转录调控功能,能够调控幽门螺杆菌毒力相关的因子。然而,幽门螺杆菌编码多种细胞毒力因子,例如尿素酶、过氧化氢酶、过氧化物歧化酶、CagA、VacA等数十种,6SRNA具体调控哪种或哪些细胞毒力因子,其调控网络、调控机制及生物学功能是什么,6SRNA是如何调控众多的毒力因子影响其生长繁殖及在胃粘膜的定植,诸如上述问题的解决仍需大量实验深入分析和研究。
此外,大量研究表明,6SRNA可对多种信号做出反应。例如,在大肠杆菌中,当细菌从指数期向稳定期过渡或营养匮乏时,6SRNA大量积累,抑制σ70-RNAP活性,激活σ38-RNAP依赖的靶基因表达[14-15];6SRNA还受胞内嘌呤核苷酸浓度、ppGpp信号、anti-σ因子等多个信号的调控,从而对噬菌感染、饥饿、酸碱度、氧胁迫等做出反应,调控生物膜形成、细胞生长、芽胞形成及多种细胞代谢[16]。幽门螺杆菌定植在胃内极复杂的环境中,受饮食、pH等多种因素的影响,上述因素是否可以通过调控Hp-6SRNA的转录而调控幽门螺杆菌的定植和毒力。另外,本研究发现,当6SRNA基因敲除后,其上游基因(Hp1220,Hp1221)的表达受到一定的影响(图6),这种影响是6SRNA基因的直接影响还是6SRNA基因通过调控其他基因间接影响上游基因的表达,仍需要进一步验证。因此,在后续工作中,我们需从生理生化、转录组、蛋白组、代谢组、细胞功能以及动物模型等多方面进一步深入分析6SRNA的生物学功能及调控机制。总之,本研究为幽门螺杆菌的转录调控机制研究提供了新思路,为幽门螺杆菌致病机理研究提供了新视野。
利益冲突:无

