弓形虫ROP16蛋白对人乳腺癌MCF-7细胞增殖、周期和凋亡的影响
马慧慧,汪鹏涛,刘春兰,李佳铭,王艺璇,兰 敏,赵志军,3
乳腺癌(breast cancer,BC),女性最好发的肿瘤之一,对女性的健康造成巨大威胁,多年来,是导致女性死亡的最主要病因[1]。其中,以激素受体阳性乳腺癌发病率最高[2]。癌细胞的无限增殖、抗凋亡特性是目前肿瘤治疗的一大难题,针对这些特性研发的抗肿瘤药物能有效抑制肿瘤细胞的增殖[3],但因肿瘤治疗周期较长,导致肿瘤细胞产生不同程度的耐药性,严重影响了肿瘤的治疗及预后。因此,研究新的抗肿瘤药物和方法是肿瘤治疗的关键。近年来,随着对抗肿瘤药物研究的深入,寄生虫虫体蛋白成为肿瘤治疗的研究热点。因其具有成分单一、高效、低毒的优势,同时避免了全虫因成分复杂、毒性大带来的危害。为临床治疗肿瘤带来新思路。
2007年,研究者们通过构建小鼠模型首次发现并报道了弓形虫 ROP16 基因。其位于基因组Ⅶb染色体上,在弓形虫入侵宿主细胞时,通过核易位序列,从细胞质转移到细胞核中发挥作用。ROP16 蛋白具有丝氨酸/苏氨酸激酶活性,可通过调节细胞内的信号传导和转录活化因子 STAT3/STAT6 的磷酸化影响细胞的增殖、分化和凋亡。但不同虫株间存在差异,如Ⅰ型虫株可通过促进宿主细胞 STAT3/STAT6 快速、持续的磷酸化,Ⅱ型虫株则正好与Ⅰ 型虫株相反,由于其激酶区一个关键氨基酸被替代,因此 II 型虫株不引起 STAT3/STAT6 磷酸化[4-6]。前期研究表明,弓形虫 RH 株速殖子与人乳腺癌 MCF-7 细胞共培养可以抑制肿瘤细胞增殖[7],但其具体调节机制尚不明确。而 ROP16 作为速殖子中的关键分子,与弓形虫抗肿瘤作用密切相关。
因此,本研究拟采用过表达 ROP16 蛋白的慢病毒载体(MCF-7-RH ROP16),通过 CCK-8、流式细胞术及 Western-blot 方法,探究 ROP16 蛋白对 MCF-7 细胞增殖、周期及凋亡的影响,并探讨其作用机制。
1 材料与方法
1.1 材料 人乳腺癌 MCF-7 细胞株由本实验室保存;ROP16 过表达及空载体慢病毒购自汉恒生物公司;胎牛血清和 DMEM 培养基购于 BI 公司;Caspase-9、His-tag 抗体购于 Abcam 公司;Caspase-3、CyclinA1、CDK2、Bax、Bcl-2、p21、p53、β-actin 抗体购于武汉爱博泰克生物科技有限公司;Annexin V-APC/7-AAD apoptosis 试剂盒购于杭州联科生物技术有限公司;Real Time PCR 反转录试剂盒购于大连 TaKaRa生物工程公司;RT-PCR引物由上海生工生物工程有限公司合成。
1.2 细胞培养及稳转细胞株构建 取出冻存于液氮罐中的MCF-7 细胞,立即复苏,DMEM 培养基培养。待 MCF-7 细胞生长至对数期,将其接种在 12 孔板上,每孔细胞数为 6×104,每组 3 个复孔。实验分为 ROP16过表达组(MCF-7-RH ROP16)、阴性对照组(MCF-7-HBLV)和空白组(MCF-7)。当细胞的融合程度约为 50%时,将过表达慢病毒和阴性对照慢病毒按病毒说明书添加到 12 孔板中,置于细胞培养箱中培养,72 h后,用荧光显微镜对细胞进行荧光蛋白检测。在成功感染慢病毒后,以加入嘌呤霉素(3 μg/mL)的 DMEM 完全培养基进行筛选至过表达组、阴性对照组未见细胞死亡,说明获得 ROP16 稳定表达的 MCF-7 细胞株,可进行下一步的试验。
1.3 RT-PCR法验证ROP16 mRNA在MCF-7细胞中的表达情况 收集并用Trizol法提取MCF-7、MCF-7-HBLV、MCF-7-RH ROP16细胞组RNA,检测其含量及纯度,逆转录后,以获得的cDNA为模板。反应体系为(20 μL):DNA 1 μL,上、下游引物各1 μL,Taq PCR Master Mix 10 μL,无酶水补足。GAPDH为内参基因,调整参数(95 ℃ 5 min;95 ℃ 25 s,55 ℃ 20 s,72 ℃ 20 s,40个循环),通过SYBR Green荧光定量PCR检测ROP16(上游引物:5′-CGGCTGGTCTCGG-3′;下游引物:5′-GGTGAAAGCTGGGTTTGGT-3′)mRNA相对表达量。
1.4 Western blot法验证ROP16蛋白在MCF-7细胞中的表达情况 收集细胞并提取 MCF-7、MCF-7-HBLV、MCF-7-RH ROP16细胞组蛋白。蛋白浓度经BCA试剂检测后,以每孔30 μg蛋白上样后用80 V恒压电泳30 min,再以120 V恒压、300 mA恒流冰浴转膜90 min后,膜用50 g/L的BSA封闭1.5 h。分别加入His-tag和β-actin一抗。置摇床4 ℃孵育18 h左右。TBST洗膜3次(10 min/次),加入HRP标记的二抗,室温孵育1.5 h。3次TBST清洗(15 min/次),加入ECL显色液,避光环境下曝光拍照,以β-actin为内参,分析各组蛋白的相对表达量。
1.5 CCK-8法检测MCF-7 细胞增殖 收集 MCF-7、MCF-7-HBLV、MCF-7-RH ROP16 细胞组细胞,以 8×103个/孔细胞量接种到 96 孔板。置于恒温培养箱分别培养 24 h、48 h、72 h 后,加 CCK8 检测液,继续孵育2 h 后,于 450 nm 波长的酶标仪测定各孔吸光度值。
1.6 流式细胞仪测定MCF-7细胞周期及凋亡 收集生长状态良好的 MCF-7、MCF-7-HBLV、MCF-7-RH ROP16 细胞组细胞,调整数量至 2×105~1×106个。加入预冷 75%乙醇,4 ℃固定 18 h,离心,弃上清,加 PBS 洗涤。加入 PI 和 RNaseA,室温避光放置 30 min,采用最小进样速度测定细胞周期。对各组检测细胞均未作细胞周期同步化处理。利用 AnnexinV-PE/7-AAD 试剂盒,将稀释后的 1×工作液重悬待检细胞,于每管中加 5 μL AnnexinV-APC、10 μL 7-AAD后,轻柔混匀。待其反应 10 min,以最低上样速度上流式细胞仪观察细胞的凋亡。
1.7 Western blot法检测MCF-7细胞中p-STAT3、细胞凋亡和周期相关蛋白的表达水平 收集细胞并提取 MCF-7、MCF-7-HBLV、MCF-7-RH ROP16 细胞组蛋白。以每孔 30 μg 蛋白上样后用 80 V 恒压电泳 30 min,再以 120 V 恒压电泳,300 mA 恒流冰浴转膜2 h后,膜用50 g/L的BSA封闭1.5 h。分别加入 p-STAT3、Bcl-2、Bax、Caspases-3、Caspase9、p53、p21、CDK2、CyclinA1 和β-actin 一抗。置摇床4 ℃孵育 18 h左右。TBST 洗膜 3 次(10 min/次),加入HRP 标记的二抗,室温孵育1.5 h。3 次 TBST 清洗(15 min/次),加入 ECL 显色液,避光环境下爆光拍照,以β-actin 为内参,分析各组蛋白的相对表达量。

2 结 果
2.1 构建ROP16过表达的MCF-7细胞 为了构建ROP16稳转的MCF-7细胞株,采用空载体(HBLV)和过表达ROP16蛋白的慢病毒载体(HBLV-RH ROP16)分别感染MCF-7细胞。收集细胞,培养到一定数目并状况良好,荧光显微镜观察,视野范围内95%以上的细胞发出强荧光(图1A)。进一步通过Western blot和RT-PCR法,验证ROP16在MCF-7细胞中蛋白和mRNA的表达水平。结果显示,相比于MCF-7-HBLV和MCF-7细胞组,MCF-7-RH ROP16细胞组的ROP16蛋白(图1B)和mRNA(图1C)表达明显增高(FROP16=893.6,P<0.001;FmRNA=83 065,P<0.001)。表明ROP16蛋白成功表达于MCF-7细胞。

A为荧光显微镜观察ROP16蛋白感染MCF-7细胞情况,a-c为GFP表达(透射光,×40);a'-c'为细胞形态(荧光,×40);B为Western blot检测MCF-7细胞中ROP16蛋白表达,1为空白组;2为阴性对照组;3为过表达组;C为q-PCR检测MCF-7细胞中ROP16 mRNA表达。图1 荧光显微镜、Western blot和RT-PCR检测ROP16在MCF-7细胞中的表达情况Fig.1 Expression of ROP16 in MCF-7 cells,detected by fluorescence microscopy,RT-PCR and Western blotting
2.2 ROP16蛋白对MCF-7 细胞增殖的影响 CCK-8法测定ROP16蛋白对各组细胞增殖的影响。如图2所示,感染Ⅰ型 ROP16 蛋白24 h 后,MCF-7 细胞的生长受到抑制(F=97.28,P<0.01),而在 48 h、72 h 后,MCF-7 的生长受到显著抑制(F48 h=157.2,P<0.001;F72 h=280.7,P<0.001)。结果表明,过表达Ⅰ型 ROP16 蛋白可抑制 MCF-7 细胞增殖。
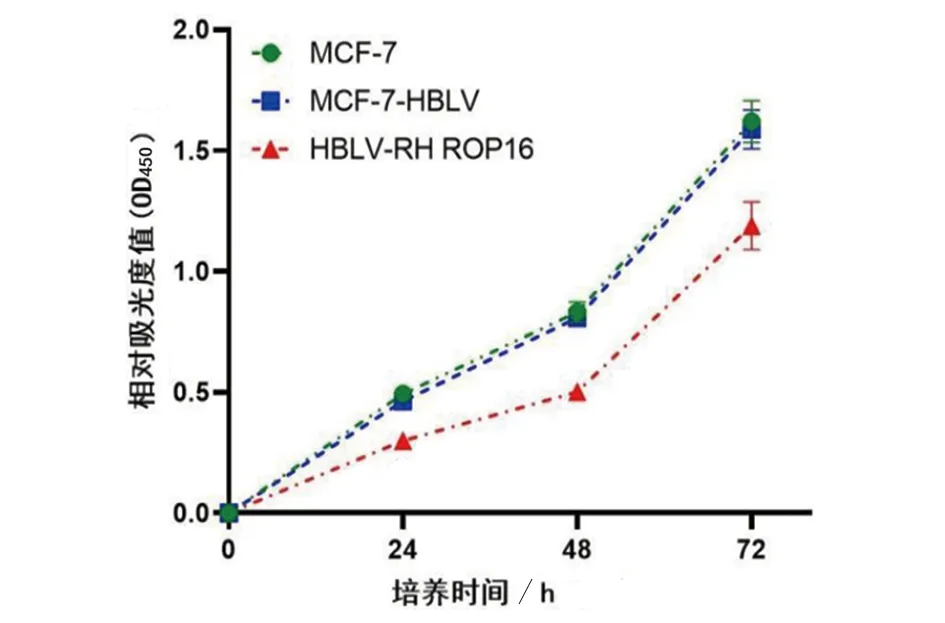
图2 CCK-8 检测ROP16对MCF-7细胞增殖的影响Fig.2 Effect of ROP16 on the proliferation of MCF-7 cells,detected with CCK-8 assays
2.3 ROP16蛋白对MCF-7细胞周期的影响 以上结果证明ROP16蛋白可显著抑制MCF-7细胞增殖。由于细胞增殖受到细胞周期调控,于是进一步探究ROP16蛋白对 MCF-7 细胞周期的影响。由流式分析结果(图3A、B)可见,Ⅰ型过表达组中 G1 期细胞比例由 67.11%下降到 53.92%,S 期比例由 22.94%上升到 36.78%,G2 期的比例没有明显变化。进一步通过Western blot法测定 ROP16 过表达后的 MCF-7 稳转细胞株周期蛋白表达情况,以明确 ROP16 蛋白诱导MCF-7 细胞发生周期阻滞的机制。如图3C、D所示,与MCF-7-HBLV、MCF-7 细胞组相比,MCF-7-RH ROP16 细胞组细胞周期蛋白依赖激酶抑制因子p21 的表达水平增高(F=371.5,P<0.001),周期相关蛋白 CDK2、CyclinA1的表达水平降低(FCDK2=748.9,P<0.001;FCyclinA1=633.1,P<0.001)。表明Ⅰ型ROP16 蛋白对 MCF-7 细胞中周期蛋白的表达有一定的调控作用,并使其停止在S期。

A:流式分析 ROP16 过表达后对 MCF-7 细胞周期影响情况;B:MCF-7 细胞周期蛋白流式结果分析;C:Western blot检测ROP16过表达后对 MCF-7 细胞中 S 期相关蛋白 p21、CDK2和CyclinA1的表达情况;D:MCF-7 细胞周期蛋白的细胞水平的定量分析。图3 流式细胞术、Western-blot检测ROP16蛋白对MCF-7细胞周期的影响Fig.3 Effect of ROP16 protein on the MCF-7 cell cycle,detected by flow cytometry and Western blotting
2.4 ROP16蛋白对 MCF-7 细胞凋亡的影响 根据以上结果,猜测 ROP16 蛋白对 MCF-7 细胞凋亡有一定的影响,因此通过流式细胞术进行检测。如图4A、B所示,MCF-7-RH ROP16 细胞组凋亡率为 11.4%,相较于MCF-7-HBLV、MCF-7细胞组升高(F=172.1,P<0.001)。进一步通过Western blot 检测凋亡相关蛋白,以明确 ROP16 蛋白诱导 MCF-7 细胞发生凋亡机制。相较于MCF-7-HBLV、MCF-7细胞组,ROP16蛋白过表达载体感染MCF-7 细胞,可使 Bax、Caspase9、Caspase3、p53蛋白高表达(FBax=37.88,Fcaspase9=20.21,Fcaspase3=38.10,Fp53=49.72,均P<0.01),而Bcl-2低表达(F=19.44,P<0.01)(图4C、D),Bcl-2/Bax 蛋白比例降低。表明Ⅰ型 ROP16 蛋白可诱导 MCF-7 细胞凋亡。

A:流式分析 ROP16 过表达后对 MCF-7 细胞凋亡影响情况;B:MCF-7 细胞周期蛋白流式结果分析;C:Western blot检测 ROP16 过表达后对 MCF-7 细胞中凋亡相关蛋白 Bcl-2、Bax、Caspases-3、Caspase9、p53 蛋白的表达情况;D:MCF-7 细胞凋亡蛋白的细胞水平的定量分析。图4 流式细胞术、Western blot检测ROP16蛋白对MCF-7细胞凋亡的影响Fig.4 Effect of ROP16 on MCF-7 apoptosis,detected by flow cytometry and Western blotting
2.5 ROP16对MCF-7 细胞 STAT3 蛋白的激活作用 以上实验结果表明,弓形虫 ROP16 蛋白对人乳腺癌 MCF-7 细胞增殖、周期、凋亡有显著影响。为了进一步探讨其作用机制,我们检测了 JAK/STAT3 通路中关键蛋白STAT3 的表达,以明确 ROP16 蛋白具体的抗肿瘤机制。相较于MCF-7-HBLV、MCF-7 细胞组,ROP16 蛋白过表达组中 p-STAT3 的表达上调(F=4 705,P<0.001)(图5A、B)。表明Ⅰ型 ROP16 蛋白可诱导 STAT3 磷酸化进而激活 STAT3。

A:Western blot 检测 ROP16 过表达后 MCF-7 中 p-STAT3 蛋白的表达情况;B:MCF-7 细胞中 p-STAT3 细胞水平的定量分析。图5 Western blot 检测 ROP16 过表达后 MCF-7 中 p-STAT3 蛋白的表达情况Fig.5 Western blot detection of p-STAT3 protein expression in MCF-7 cells after ROP16 overexpression
3 讨 论
弓形虫蛋白ROP16作为一个外源蛋白,在调节肿瘤细胞生长、增殖和凋亡等方面发挥重要作用。Chang等报道了ROP16蛋白通过调节Bax、Bcl-2、P21、CDKs等凋亡、周期相关蛋白的表达水平,导致人神经母细胞瘤SH-SY5Y细胞发生凋亡和周期阻滞[8]。本团队前期研究发现,弓形虫Ⅱ型ROP16蛋白可通过调节凋亡蛋白Bcl-2、Bax 等的表达,抑制THP-1细胞增殖,诱导其凋亡;Ⅰ型ROP16蛋白可通过促进STAT3磷酸化,调节Bcl-2、Bax、Cleaved Caspases-3、Caspases-9、p53、p21、CDK6、CyclinD1等与凋亡、周期相关的细胞因子,诱导人肺腺癌A549细胞凋亡,引起细胞周期阻滞[9-10]。本研究结果显示,Ⅰ型ROP16蛋白可通过磷酸化激活STAT3,调节凋亡、周期相关蛋白的表达,诱导人乳腺癌MCF-7细胞凋亡,引起细胞周期阻滞。说明ROP16蛋白对不同肿瘤细胞有一定的杀伤作用。
JAK/STAT3信号通路在肿瘤的发生发展中起着关键作用,其在绝大多数人类肿瘤中呈异常活化状态。其中,STAT3 作为关键的转录因子,被激活后以入核的方式,通过调节下游与细胞周期、凋亡等相关基因的表达,诱导脑胶质瘤及消化道肿瘤细胞增殖、使其凋亡减少,正向调控细胞周期进程[11-12]。且在 60%肝癌组织样本中发现了 STAT3 表达升高[13]。目前已有研究表明,ROP16 蛋白可通过干扰人体 JAK/STAT3 信号通路,影响人体细胞的增殖、分化、调亡等功能[14]。因此,本研究猜测,ROP16 可能参与了 JAK/STAT3 信号途径的调控,进而发挥抗肿瘤作用。STAT3 可诱导凋亡蛋白 Bcl-2 的表达,使 Caspase9 和 Caspase3 蛋白表达降低,诱导肿瘤细胞增殖;使其凋亡减少,并通过直接调节 CyclinA1、CDK2、p21 等因子的表达,正向调控 MCF-7 细胞周期。而弓形虫 ROP16 蛋白相当于 JAK/STAT3 信号通路抑制剂,通过调节 STAT3 细胞因子,使 MCF-7 细胞凋亡增加,增殖减少,并导致其 S 期细胞阻滞。
本实验探究了弓形虫Ⅰ型 ROP16 蛋白对激素受体阳性乳腺癌 MCF-7 细胞的表型影响,从体外细胞水平证明 ROP16 可以诱导 MCF-7 细胞发生凋亡,抑制其增殖并发生周期阻滞。后续计划通过正常乳腺上皮 MCF-10 细胞、三阴性乳腺癌 MDA-MB-231 细胞及 HER2 阳性乳腺癌 SKBR-3 细胞,观察 ROP16 对正常乳腺上皮及其它亚型乳腺癌细胞的影响及其具体机制。并进行体内动物实验,将细胞混悬液注射于实验裸鼠体内,进一步验证弓形虫ROP16 蛋白对瘤体生长是否有抑制作用。
综上所述,弓形虫Ⅰ型(RH 株)ROP16 蛋白可在人乳腺癌 MCF-7 细胞中表达,通过促进JAK/STAT3 信号通路中关键蛋白 STAT3 的磷酸化,诱导 MCF-7 凋亡、抑制其增殖并引起细胞 S 期阻滞。此项研究为未来利用寄生虫虫体蛋白治疗乳腺癌提供理想生物治疗候选分子奠定基础。
利益冲突:无

