siRNA靶向下调RhoA基因对慢性高眼压小鼠视功能的保护作用
刘茜,刘长庚,李海军,董仰曾,张颖
(河南省人民医院/河南省立眼科医院/河南省眼科研究所/郑州大学人民医院 眼科,河南 郑州 450000)
青光眼是视网膜神经节细胞(retinal ganglion cells,RGCs)及其在视神经内的轴突丢失造成的眼部疾病,是一种复杂的神经退行性疾病,也是全球不可逆盲的主要原因之一[1-3]。眼压升高是导致视网膜神经节细胞及其轴突丢失的主要危险因素,视神经保护及其治疗靶点的干预治疗是青光眼防盲治盲的关键[4-5]。Rho是与Ras相关的小分子鸟苷三磷酸酶(guanosine triphosphatase,GTPase)超家族Rho家族的成员,Rho有3种异构体类型:RhoA、RhoB和RhoC[6]。Rho通路的激活会导致小梁网(trabecular meshwork,TM)收缩,并且该通路的抑制将引起TM的松弛,随后增加流出量,从而降低眼内压(intraocular pressure,IOP)[7]。其中,RhoA存在于培养的TM细胞,并且RhoA信号通路广泛参与人体多种生理和疾病病理以及视神经保护过程[8]。研究表明,Y-27632能够特异性抑制丝氨酸/苏氨酸激酶(Rho-associated kinase,ROCK)及其下游的肌球蛋白轻链磷酸酶(myosin light chain phosphatase,MLCP),改变人眼TM细胞的肌动蛋白结构和细胞黏附力,降低应力纤维的收缩,促进房水的外引流,降低眼压[9]。因此,确定靶向TM细胞的机制可能有助于开发治疗青光眼的有效策略。本研究拟玻璃体腔注射RhoA siRNA(siRhoA),探讨RNA干扰技术治疗青光眼的可行性,为深入研究siRhoA青光眼视神经保护的应用奠定基础。
1 材料与方法
1.1 实验主要材料C57小鼠由河南省实验动物质量监督监测站提供,为无特定病原体动物,饲养于室温24 ℃的环境中,维持明/暗12 h循环交替光照条件。靶向RhoA的小干扰RNA片段(siRhoA)和siRNA阴性对照片段由上海吉玛制药技术有限公司合成,其中正义链F:5’-GAAGUCAAGCAUUUCUGUCdTdT-3’,反义链R:3’-dTdTCUUCAGUUCGUAAAGACAG-5’。CCK-8试剂盒购自厦门仑昌硕生物科技有限公司,地塞米松(dexamethasone,DEX)购自西安康诺化工有限公司,RhoA抗体购自Abcam公司。采用APS-2000AER视觉电生理检查仪(德国蔡司)对受试者闪光视觉诱发电位(flash visual evoked potential,f-VEP)进行分析。
1.2 实验方法
1.2.1实验动物模型建立与分组 实验动物饲养和使用遵守“眼与视觉研究协会动物使用声明”相关规定,经河南省立眼科医院中心伦理审查委员会通过(HNEECA-2021-11)。实验动物模型拟采用既往实验建立的方法[10]。选取21只4~6周的C57小鼠(雌雄各半),随机分为3组(A组,B组,C组)。3组小鼠以1 g·L-1DEX持续低浓度点左眼(处理眼,DEX),右眼接受生理盐水持续点眼(对照眼,NS)。使用Tonopen眼压计测量小鼠眼压。采用定量反转录聚合酶链反应(quantitative reverse transcription polymerase chain reaction,qRT-PCR)和Western blot检测第 28天DEX处理眼和对照眼中RhoA基因和RhoA蛋白表达量。
1.2.2玻璃体腔注射 体内转染siRNA的配制采用既往实验建立的方法[11]。第28天时,小鼠左眼行体内转染实验。以40 g·L-1水合氯醛麻醉动物,盐酸丁卡因进行局部麻醉,体视显微镜下,经角巩膜缘前约0.5 mm进行前房穿刺,放出少量房水,用25 G的微量注射器将5 μL siRNA距离角巩膜缘1 mm处行玻璃体腔注射。其中A组(实验组)注射siRhoA,B组(阴性对照组)注射阴性对照siRNA(NC siRNA),C组(对照组)注射PBS缓冲液,术后于1、4、7、14、28 d测量小鼠术眼眼压。
1.2.3视觉电生理检查 注射后28 d对各实验组视觉功能进行f-VEP检测[12],将小鼠麻醉后固定于固定架上,在暗室内使用EP1000 Pro型眼电生理检查仪(日本Tomey公司),于小鼠头部后方相对应眼的螺旋钉上接作用电极,前部螺旋钉上接参考电极,接地电极不锈钢针插入小鼠尾部上方。小鼠眼睛距离闪光刺激源10 cm,共测量3次,每次间隔5 min,取测量平均值,比较视网膜功能恢复情况。
1.2.4体内转染效率检测 siRhoA注射后,于第28天利用qRT-PCR检测视网膜组织RhoA基因变化情况(其中正义链F:5’-CCCGTTCTATACCGGGTGAA-3’,反义链R:3’-CAAAAGTTTGTGGCACCCGT-5’,以β-actin基因作为管家基因,各基因的相对表达量参照2-△△Ct方法),使用SPSS 24.0统计软件对基因表达水平进行定量分析。采用Western blot检测RhoA蛋白表达情况:使用匀浆器提取总蛋白,BCA试剂盒测定蛋白浓度。取50 μg总蛋白变性处理10 min后,行凝胶电泳,蛋白电泳分离后转移至PVDF膜。使用40 g·L-1的脱脂牛奶于室温条件下封闭1 h,再经一、二抗孵育后加入显色剂曝光,于冷CCD凝胶成像系统中拍摄扫描图片,用Image J-Pro Plus 6.0软件分析条带灰度值。
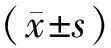
2 结果
2.1 DEX诱导实验动物眼压及RhoA表达量变化处理前小鼠基线眼压为(10.26±1.52)mmHg(1 mmHg=0.133 kPa)。生理盐水处理眼与对照眼眼压差异无统计学意义(F=0.209,P=0.928)。1 g·L-1DEX持续点眼可引起持续眼压升高,眼压在第1天即出现较高水平,持续至第28天(F=71.752,P<0.001)(图1A)。DEX处理眼与对照眼眼压差异有统计学意义(F时间=43.872,P时间<0.001;F组间=263.333,P组间<0.001;F交互=38.228,P交互<0.001)(图1A)。qRT-PCR和Western blot结果显示,DEX处理28 d后左眼视网膜组织RhoA基因(F=67.434,P=0.001)和RhoA蛋白(F=150.482,P<0.001)的表达量与对照眼相比差异有统计学意义(图1B、C、D)。

A为0~28 d小鼠眼压变化情况;B为qRT-PCR检测小鼠视网膜组织RhoA基因表达量变化情况;C、D为Western blot检测小鼠视网膜组织RhoA蛋白表达量变化;DEX代表地塞米松处理眼,NS代表生理盐水处理眼;**P<0.01。
2.2 siRNA注射后眼压变化情况注射siRhoA后,A组小鼠的眼压在初期(1、4、7 d)略有下降,但与对照眼相比差异无统计学意义(P>0.05),与B组和C组相比,差异无统计学意义(P>0.05)。见表1。

表1 3组眼压变化情况
2.3 siRNA注射后RhoA基因和RhoA蛋白表达量变化注射siRNA和PBS后第28天,检测各组小鼠双眼视网膜组织中RhoA基因和RhoA蛋白表达量。结果显示,A组小鼠左眼中RhoA基因(F=0.004,P=0.995)和RhoA蛋白表达量(F=0.004,P=0.995)相较对照眼差异无统计学意义;B组小鼠左眼中RhoA基因(F=47.336,P=0.002)和RhoA蛋白表达量(F=37.701,P=0.004)相较对照眼有较高的表达,C组小鼠左眼中RhoA基因(F=70.141,P=0.001)和RhoA蛋白表达量(F=70.141,P=0.001)也比对照眼表达高(图2)。

A为qRT-PCR检测高眼压模型小鼠玻璃体腔注射后RhoA基因表达量相较对照眼的变化;B和C为Western blot检测高眼压模型玻璃体腔注射治疗后RhoA蛋白表达量相较对照眼的变化;DEX代表地塞米松处理眼,NS代表生理盐水处理眼;**P<0.01。
2.4 各组小鼠的视觉功能变化玻璃体腔注射后,A组小鼠左眼f-VEP 的N波潜伏期、P波潜伏期和P波振幅逐渐恢复,相较B组和C组差异有统计学意义(P<0.05),而B组和C组小鼠左眼f-VEP的P波和N波潜伏期延长,P波振幅降低(P<0.05)。见表2。

表2 注射后第28天与对照眼f-VEP情况的比较
3 讨论
青光眼是一类影响人类和动物的复杂视神经病变。眼压的调节对视功能至关重要,其升高仍然是青光眼发病的主要危险因素[13-14]。由于TM在维持正常房水流出和调节IOP中起关键作用,所以干预TM组织可能是降低IOP的重要临床治疗方式[15]。在以前的研究中,DEX显示出诱导TM细胞中RhoA的瞬时激活[7,16],进一步激活了下游效应器ROCK。研究表明,RhoA/ROCK在调节IOP中起重要作用,RhoA抑制剂C3转移酶和ROCK抑制剂Y-27632能够特异性抑制ROCK激酶及其下游的肌球蛋白轻链磷酸酶,改变人眼小梁细胞的肌动蛋白结构和细胞黏附力,降低应力纤维的收缩,促进房水的外引流[17-18]。基于这些,证明了DEX不仅增加了RhoA的表达,而且激活了ROCK,DEX可能通过RhoA/ROCK途径诱导,升高眼压,进一步表明RhoA可能作为降低眼内压的干预因子[19-20]。
本研究通过DEX诱导慢性高眼压小鼠模型,经qRT-PCR和Western blot检测RhoA基因和RhoA蛋白表达量,结果显示所有小鼠DEX诱导后眼压升高(7、14、21、28 d),初步构建慢性高眼压动物模型,DEX诱导眼视网膜组织与生理盐水处理后对照眼的RhoA基因和RhoA蛋白的表达量差异有统计学意义。王艳华等[21]研究发现,在眼部急性高眼压大鼠模型实验损伤后的视网膜中,RhoA蛋白表达高于正常大鼠视网膜组织,随损伤时间的延长蛋白表达量上升;此外,在去核猪眼中RhoA介导的TM收缩导致眼压快速升高[22]。其他研究表明,在前房注射转化生长因子-β1后的前3 d内,RhoA的mRNA表达上调,同时也观察到眼压的早期升高[23]。这些结果进一步支持了RhoA与青光眼之间的关系。
此外,通过siRhoA玻璃体腔注射治疗后,注射siRhoA组小鼠的RhoA基因表达量和RhoA蛋白表达量下调,且均低于NC siRNA和PBS组表达量;本研究结果显示,siRhoA玻璃体腔注射降低DEX诱导后视网膜神经节细胞RhoA基因和RhoA蛋白表达量。与对照组相比,siRhoA更及时有效地预防了眼压升高,表明正常小鼠和DEX处理小鼠之间IOP变化的差异可能是由于DEX诱导的TM功能障碍[7]。此外,本研究通过f-VEP检测玻璃体腔注射后实验动物视觉功能的情况。已有研究证实f-VEP可用于动物视神经传导功能的监护,是客观、可靠地评价视功能的一种方法[12,24]。f-VEP是视网膜受到闪烁光刺激后,在枕叶视皮层产生的电活动,枕皮层首先直接反映了视皮层的活动以及视皮层和其的联系;其次,间接反映了从视网膜神经节细胞开始,以及从节细胞到中枢的视信息处理系统,尤其是中心视功能系统的状态[25]。本研究中A、B、C组小鼠左眼的f-VEP中P波潜伏期和P波振幅与对照眼相比差异有统计学意义,表明慢性高眼压小鼠模型的神经节细胞的丢失较多导致光敏度降低,从而导致P波幅降低、潜伏期延长视力水平低于对照眼。经siRhoA治疗后,A组实验动物N波、P波潜伏期和P波振幅逐渐恢复,虽未完全至正常水平,但相较B和C组而言,f-VEP异常减轻,表明其神经节细胞丢失可能得到改善,视觉通路神经兴奋的传导速度加快,异常组织结构与功能趋于恢复。本研究表明,利用siRhoA方法治疗与TM相关的疾病是可行的,如青光眼。
本研究通过玻璃体腔注射干扰siRhoA表达,相较NC siRNA和PBS组RhoA基因和RhoA蛋白表达量降低。同时,相较阴性对照组,siRhoA组实验动物的视觉功能恢复。本研究为青光眼基因治疗的临床应用提供了一定的理论基础。

