258.15 K下五元体系Li+,Na+,Mg2+∥SO42-,Cl--H2O相平衡研究
闫芳宁,郭锦春,黄雪莉,周婷婷,王雪莹,罗清龙,邹雪净
(新疆大学化工学院,新疆煤炭清洁转化与化工过程自治区重点实验室,新疆乌鲁木齐 830017)
锂被誉为21世纪的“高科技金属”之一,在新兴 技术领域中发挥重要作用[1]。中国锂资源量排名世界第四,以液体锂矿为主[2]。在传统盐湖开发技术中,盐田一般通过自然蒸发富集目标离子。鉴于中国含锂盐湖大部分位于青海、西藏及新疆等干旱少雨、冬季寒冷且漫长的地区,若能利用冬季冷能实现目标离子的富集,既可获得目标产品,又能实现节水节能。因此,研究低温盐湖化工技术具有重要意义。
水盐体系相平衡关系的研究可为低温下盐湖化工技术的开发提供指导。近年来,已有不少学者对含锂水盐体系的相平衡关系进行研究,崔瑞芝等[3-4]在298.15 K下对3个含锂四元体系的溶解度进行实验测定和模型计算,发现两者结果吻合度较高;ZHUGE等[5]对交互四元体系Li+,Rb+∥Cl-,Borate-H2O在323.2 K时的固液相关系进行了研究,发现在该体系中LiCl·H2O结晶区最小,对其他共存盐有盐析作用,Li2B4O7·3H2O结晶区最大,更易从溶液中分离出来;YUAN等[6]研究了五元体系Li+,Na+,Mg2+∥Cl-,SO42--H2O在273.15 K时的稳定相平衡关系,并通过热力学模型计算了该五元体系的溶解度,发现实验和模型计算结果吻合度较高;ZENG等[7]通过研究K+,Na+,Li+∥SO42--H2O四元体系,发现复盐钾芒硝在273.15 K时消失形成了复盐硫酸铝钾;QI等[8]研究了在288.15 K下四元体系LiBr-NaBr-KBr-H2O及其2个三元体系(LiBr-NaBr-H2O、LiBr-KBr-H2O)的固液平衡关系,发现3种体系均未出现固溶体和复盐。
实际含锂卤水多为高元复杂体系,而目前含锂水盐体系相平衡研究多为三元、四元等简单体系且主要集中在常温及以上的温度范围,对低温下的高元含锂水盐体系相平衡研究较少。此外,中国含锂盐湖多位于冬季寒冷且漫长的地区,冬季冷能尚未充分利用。文献[9-10]表明,常温及高温下存在的大多数硫酸型复盐在低温下容易消失,使得多元体系的相关系在低温下趋于简单,说明低温有利于简化生产工艺,从而降低生产成本,因此开展低温下的相关系研究具有实际意义。青海、西藏、新疆地区含锂盐湖多属于Li+,Na+,K+,Mg2+∥SO42-,Cl--H2O复杂六元体系,而五元体系Li+,Na+,Mg2+∥SO42-,Cl--H2O是其重要的次级体系之一。对Li+,Na+,Mg2+∥SO42-,Cl--H2O五元体系在258.15 K下的相平衡关系展开研究,不仅能为相关复杂六元体系的研究提供必要的理论基础,还能充分利用当地冬季冷能,为钾含量低的硫酸盐型盐湖及提钾后含锂老卤的低温提锂工艺的开发和设计提供理论指导。此外,在大多数卤水中,氯化钠是其主要成分且常处于饱和状态,虽然其溶解度会随温度的降低而降低,但变化不大,所以降温过程中氯化钠一直处于饱和状态。因此,在氯化钠饱和条件下对Li+,Na+,Mg2+∥SO42-,Cl--H2O五元体系进行相平衡研究,不仅贴合实际,还可简化研究过程。
本工作采用等温溶解平衡法[11],研究了258.15 K、二水氯化钠饱和条件下五元体系Li+,Na+,Mg2+∥SO42-,Cl--H2O的相平衡关系。根据溶解度数据绘制出相图,并对该五元体系在258.15 K和273.15 K下的相图进行对比分析。此外,在此五元体系相图基础上,还研究了典型含锂硫酸盐型盐湖(涩聂湖)卤水在降温过程中的液相组成变化和析盐路线,为低温盐湖提锂工艺提供了理论基础。
1 实验部分
1.1 实验试剂和装置
试 剂:LiCl、Li2SO4·H2O、Na2SO4、NaCl、KCl、MgCl2·6H2O、MgSO4·7H2O,均为分析纯;去离子水,pH≈6.6、电导率<1×10-4S·m-1。
仪器:DHJF-4010型低温恒温搅拌反应浴(精度±0.2 K);T6新世纪型紫外可见分光光度计;AA-7001型原子吸收光谱仪;NTY-10A型数字式千分温度计;LE204E/02型电子天平;D8 Advance型X射线衍射仪(XRD)。
1.2 实验方法
采用等温溶解平衡法,以次级体系共饱点为起始点,计算配比并进行精确称量,然后加入另一种盐和去离子水配制成溶液,搅拌溶解后置于258.15 K的低温恒温反应浴,搅拌直至溶液达到平衡。该五元体系平衡时间为36 h,静置时间至少为3 h。待固液两相完全分离后,用在258.15 K下预冷过的取样器吸取一定量的平衡液相,转移至250 mL容量瓶中进行稀释,然后分析其组成;用在258.15 K下预冷过的漏斗快速抽滤固相进行组分鉴定。
1.3 相图指数的计算方法
本文所研究的五元体系的耶涅克指数(J)计算公式如下:
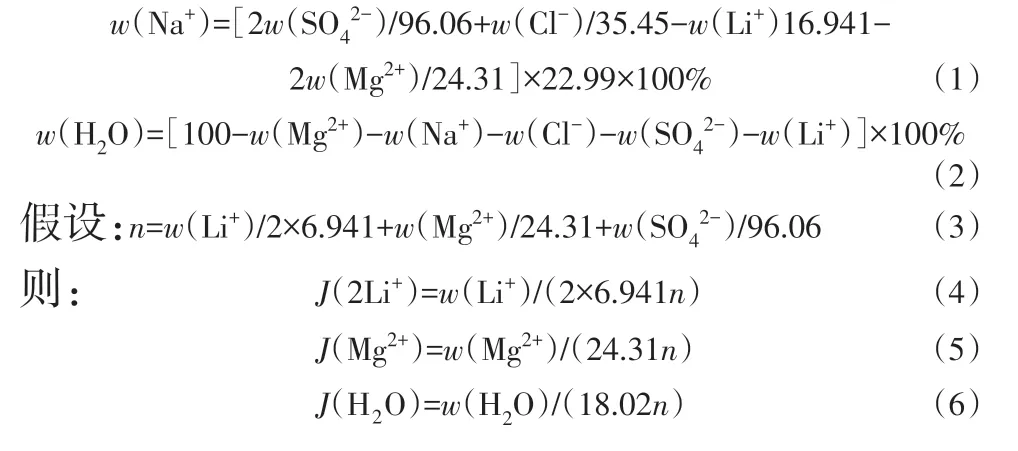
式中:w(x)表示x在液相中的质量分数,%;n表示Li+、Mg2+、SO42-3种离子的总物质的量,mol;J(x)表示x的相图指数,%(以2Li++Mg2++SO42-物质的量计)。
1.4 分析方法[12-13]
Cl-采用硝酸银容量法测定;Mg2+采用EDTA容量法测定;SO42-采用比浊法测定;Li+采用火焰原子吸收光谱法测定;K+采用四苯硼钠重量法测定;Na+采用差减法测定。在测定离子含量时,对每个样品进行3次测定,并取结果的平均值,以确保测定结果的准确性。采用X射线衍射仪分析样品的固相组成。
2 结果与讨论
2.1 相平衡数据与相图
表1为五元体系Li+,Na+,Mg2+∥SO42-,Cl--H2O在258.15 K、二水氯化钠饱和条件下的溶解度数据,据此绘制出该五元体系的相图及局部放大图见图1。由表1和图1可知,在258.15 K、二水氯化钠饱和条件下,该五元体系的平衡相图有4个共饱点、9条单变量溶解度曲线、6个两盐结晶区及1种复盐。相图中的4个共饱点分别为A1、A2、A3、A4,其平衡相组成均为3个固相和1个液相,其中A1、A2、A3为不相称共饱点,A4为相称共饱点。A1的平衡液相组成为w(Li+)=1.244%,w(Mg2+)=2.656%,w(Na+)=3.245%,w(Cl-)=16.50%,w(SO42-)=3.531%,对应的平衡固相为Na2SO4·10H2O+MgSO4·7H2O+Li2SO4·H2O+NaCl·2H2O;A2的平衡液相组成为w(Li+)=1.482%,w(Mg2+)=6.439%,w(Na+)=0.606%,w(Cl-)=27.00%,w(SO42-)=0.389%,对应的平衡固相为MgCl2·8H2O+MgSO4·7H2O+Li2SO4·H2O+NaCl·2H2O;A3的平衡液相组成为w(Li+)=4.790%,w(Mg2+)=2.425%,w(Na+)=0.547%,w(Cl-)=32.36%,w(SO42-)=0.026%,对应的平衡固相为MgCl2·8H2O+Li2SO4·H2O+LiCl·MgCl2·7H2O+NaC·l NaCl·2H2O;A4的平衡液相组成为w(Li+)=4.985%,w(Mg2+)=2.452%,w(Na+)=0.017%,w(Cl-)=32.62%,w(SO42-)=0.027%,对应的平衡固相为LiCl·MgCl2·7H2O+LiCl·2H2O+Li2SO4·H2O+NaCl·2H2O。相 图 中的9条单变量溶解度曲线及其对应的平衡固相分别为Na2SO4·10H2O+MgSO4·7H2O+NaCl·2H2O(C3A1)、Li2SO4·H2O+NaCl·2H2O+Na2SO4·10H2O(A1C1)、MgCl·2Cl2·8H2O+MgSO4·7H2O+NaCl·2H2O(C4A2)、NaCl·2H2O+LiCl·MgCl2·7H2O+MgCl2·8H2O(A3C5)、LiCl·2H2O+LiCl·MgCl2·7H2O+NaCl·2H2O(A4C6)、Li2SO4·H2O+NaCl·2H2O+MgCl2·8H2O(A2A3)、NaCl·2H2O+Li2SO4·H2O+MgSO4·7H2O(A1A2)、Li2SO4·H2O+LiCl·2H2O+NaCl·2H2O(A4C2)、NaCl·2H2O+Li2SO4·H2O+LiCl·MgCl·27H2O(A3A4)。
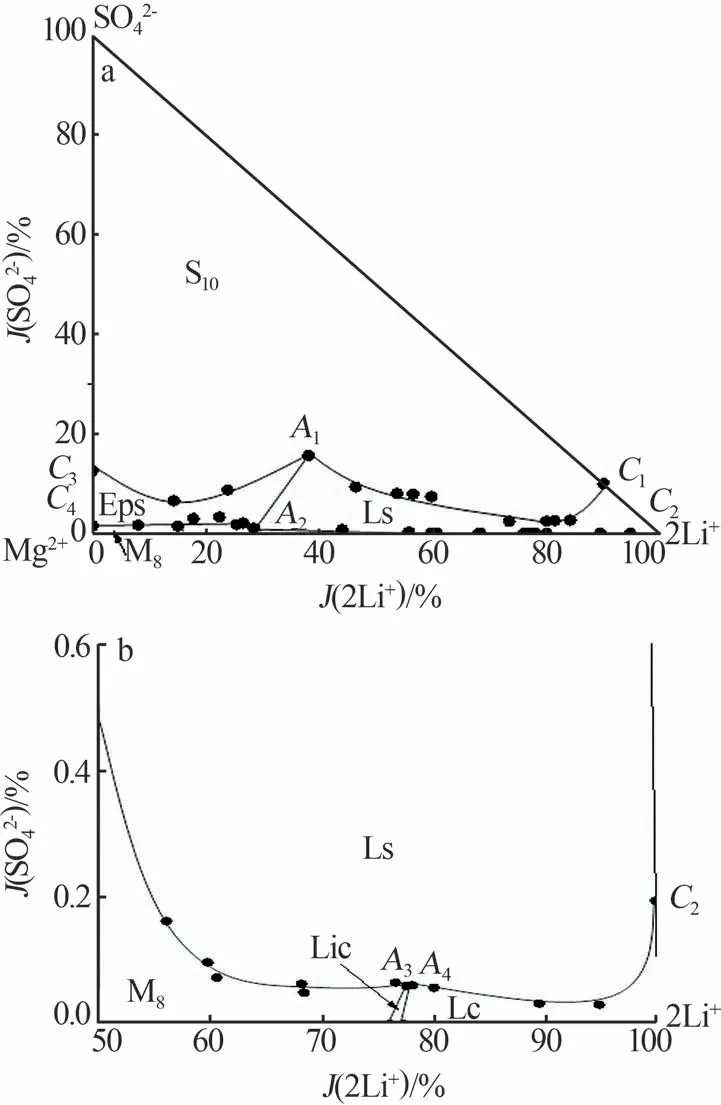
图1 258.15 K、二水氯化钠饱和下五元体系Li+,Na+,Mg2+∥SO42-,Cl--H2O的相图(a)及其局部放大图(b)Fig.1 Phase diagram of Li+,Na+,Mg2+∥SO42-,Cl--H2O system saturated with NaCl·2H2O at 258.15 K(a)and partial enlargement diagram(b)
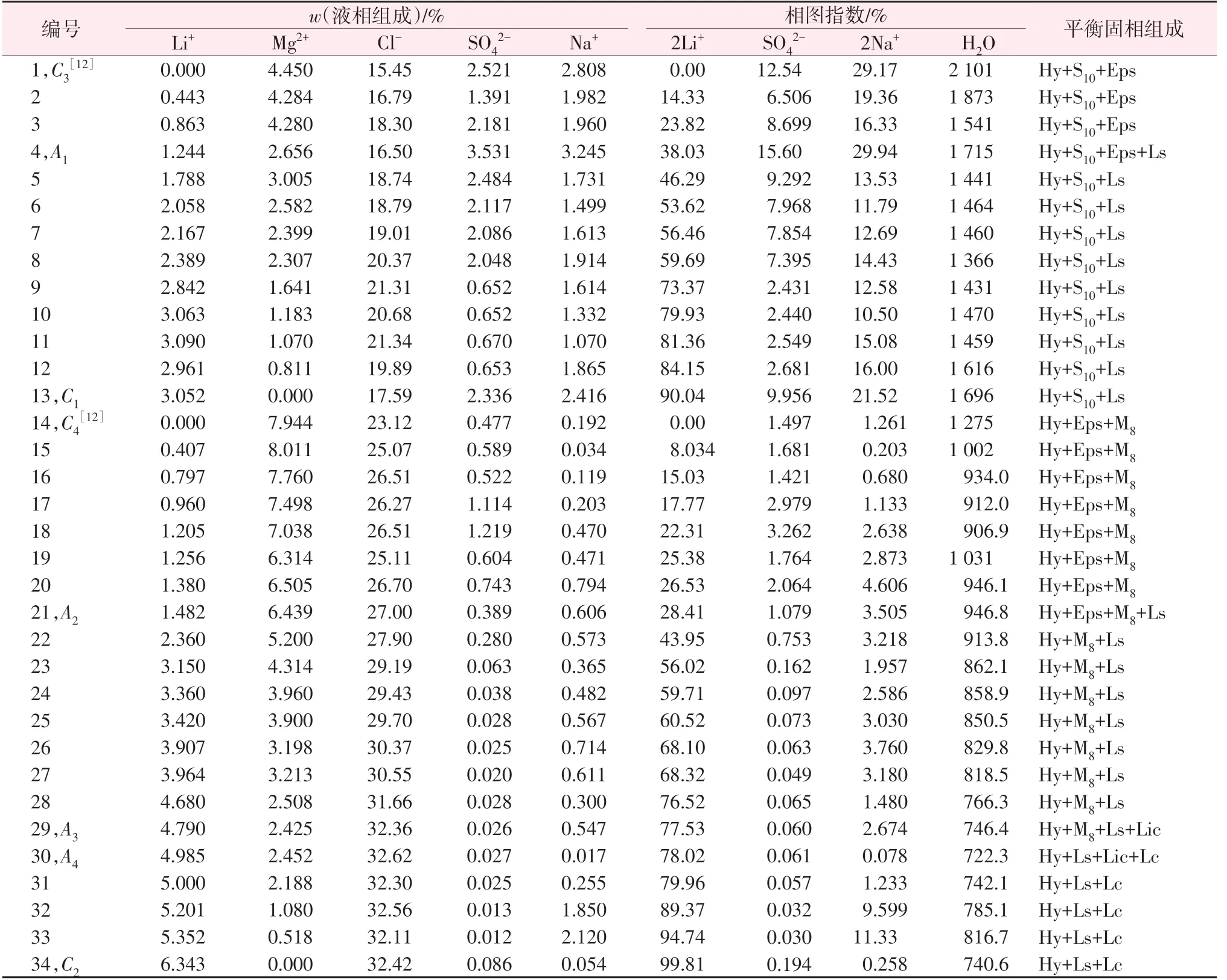
表1 258.15 K、二水氯化钠饱和条件下Li+,Na+,Mg2+∥SO42-,Cl--H2O体系溶解度Table 1 Solubilities of Li +,Na+,Mg2+∥SO42-,Cl--H2O system saturated with NaCl·2H2O at 258.15 K
相图中6个两盐结晶区分别为LiCl·MgCl2·7H2O+NaCl·2H2O、LiCl·2H2O+NaCl·2H2O、NaCl·2H2O+MgCl2·8H2O、MgSO4·7H2O+NaCl·2H2O、Na2SO4·10H2O+NaCl·2H2O、Li2SO4·H2O+NaCl·2H2O。由图1可知,在258.15 K、二水氯化钠饱和条件下,相图中的结晶区由大到小的顺序依次为Na2SO4·10H2O、Li2SO4·H2O、MgSO4·7H2O、MgCl2·8H2O、LiCl·2H2O、LiCl·MgCl2·7H2O,表明在该体系中Na2SO4·10H2O的溶解度最小,最易从溶液中析出,LiCl·MgCl2·7H2O的溶解度最大,最不易析出。
2.2 相图分析与讨论
图2为共饱点对应固相的XRD谱图。结合图2及文献[9-10,13]可知,在258.15 K时该体系中NaCl、MgCl、MgSO4、LiCl分别以NaCl·2H2O、MgCl2·8H2O、MgSO4·7H2O和LiCl·2H2O的形式析出。由于部分水合盐对温度比较敏感,其水合形式会随温度变化而发生改变,因此本实验采用XRD检测出的NaCl、MgCl2和LiCl分 别 以NaCl、MgCl2·6H2O、LiCl·H2O的形式出现。

图2 共饱点A1、A2、A3和A4的XRD谱图Fig.2 XRD patterns of solid phase of invariant points A1,A2,A3 and A4
2.3 不同温度下的相图对比
图3为五元体系Li+,Na+,Mg2+∥SO42-,Cl--H2O在258.15 K和273.15 K下的相图对比。由图3可知,温度由273.15 K降至258.15 K后,共饱点个数从5个减少为4个,复盐种类由2种减少为1种,水合单盐中只有氯化镁的水合盐发生转变,相图结构得以简化[6]。在3种硫酸单盐中,Na2SO4·10H2O结晶面积激增,MgSO4·7H2O与Li2SO4·H2O结晶面积均减小,表明温度降低促使Na2SO4·10H2O在该五元体系中的溶解度显著降低,使得Na2SO4·10H2O更容易析出。硫酸盐型复盐Li2SO4·3Na2SO4·12H2O结晶区消失,非硫酸盐型复盐结晶面积减小,但变化不大,这一现象与文献[14]报道结果一致。因此,在实际生产中可利用硫酸钠溶解度随温度降低而降低的特点,指导含锂硫酸盐型卤水的低温脱硫工艺设计。
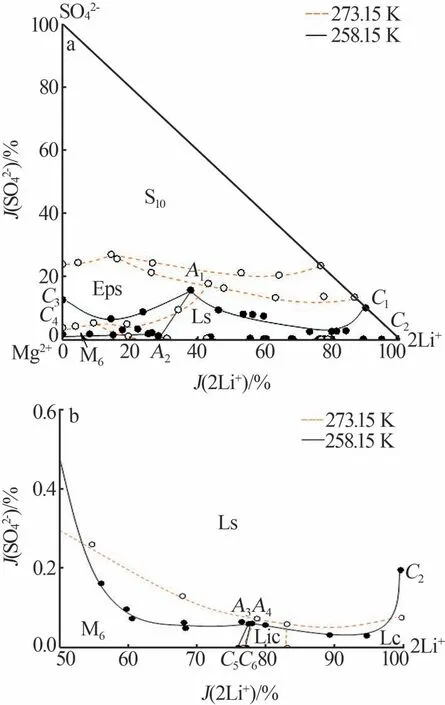
图3 273.15、258.15 K下五元体系Li+,Na+,Mg2+∥ SO42-,Cl--H2O相图(a)及其局部放大图(b)Fig.3 Phase diagram of Li+,Na+,Mg2+∥ SO42-,Cl--H2O system at 273.15,258.15 K(a) and partial enlargement diagram(b)
2.4 涩聂湖卤水降温研究
依照涩聂湖卤水组成[15]配制模拟卤水样品1#,开展降温实验,模拟卤水组成见表2。因该模拟卤水中K+含量不高,故在分析降温过程中液相变化时,将该五元体系简化为Li+,Na+,Mg2+∥Cl-,SO42--H2O,并将实验过程中液相移动路径标在相图上,如图4所示。降温过程中各离子的质量分数变化列于表3中。1#卤水样品在258.15 K的固相组成见图5。
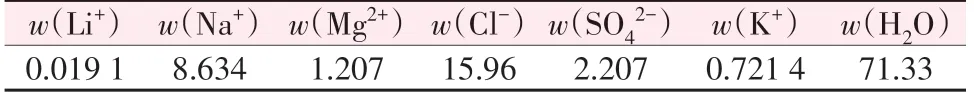
表2 1#卤水样品液相组成Table 2 Liquid phase composition of 1# brine %
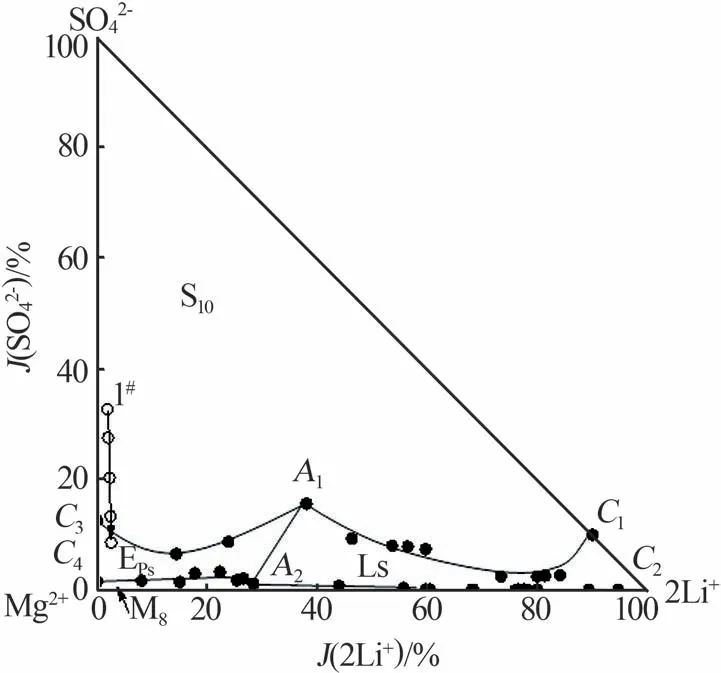
图4 1#卤水样品降温过程中液相组成变化Fig.4 Change of liquid composition of 1# brine in cooling process

表3 1#卤水样品降温过程中液相组成Table 3 Liquid composition of 1# brine in cooling process %
由表3和图4可知,卤水样品液相点落在了Na2SO4·10H2O的结晶区中。降温过程中液相组成点持续向下移动,Na+和SO42-的含量持续减少,当温度降至268.15 K时SO42-的质量分数减小到1.276%,而Li+、Mg2+、Cl-的含量明显增加。根据固相XRD谱图(图5)结果推断,这是因为降温过程中Na2SO4·10H2O的析出带走了液相中的水分,致使Li+、Mg2+、Cl-含量增加。从图4中还发现,当温度为258.15 K时液相组成点移动到了MgSO4·7H2O结晶区中,液相中SO42-含量持续减少。由图5可知,样品中存在MgSO4·7H2O和Na2SO4·10H2O,说明在258.15 K时Na2SO4·10H2O部分转溶为MgSO4·7H2O。因此,涩聂湖卤水在降温过程中盐的结晶顺序为NaCl(NaCl·2H2O)+Na2SO4·10H2O、NaCl·2H2O+MgSO4·7H2O。降温过程中的液相组成变化及析盐规律与理论结果基本一致,但略有不同,主要是因为相图研究的是平衡体系,而降温是非平衡过程。

图5 1#卤水样品固相的XRD谱图Fig.5 XRD patterns of solid phase of 1# brine
由表3可知,降温后,SO42-的质量分数由2.207%降低至0.505%,Li+的质量分数由0.019 1%升高为0.021 9%,浓度增长了4.66%,镁锂质量比由63.2降低为60.7,说明对涩聂湖卤水进行降温能脱除大量的硫酸根,有效富集锂离子,降低镁锂比。因此,对涩聂湖进行除杂工艺设计时,可将该卤水置于盐田中,利用冬季冷能脱除硫酸根获得富锂卤水。
3 结论
1)交互五元体系Li+,Na+,Mg2+∥SO42-,Cl--H2O 在258.15 K、二水氯化钠饱和条件下的稳定平衡相图中有4个共饱点、6个两盐结晶区和9条单变量溶解度曲线。2)与该体系在273.15 K下的稳定相图相比,硫酸盐型复盐消失,只存在一种复盐为LiCl·MgCl2·7H2O,共饱点个数从5个减少为4个,复盐种类由2种减少为1种,相图结构得以简化。3)降温实验表明,当含锂硫酸盐型盐湖降温至258.15 K时,能脱除大量的硫酸根,有效富集锂离子;降温过程中的盐结晶顺序为NaCl(NaCl·2H2O)+Na2SO4·10H2O、NaCl·2H2O+MgSO4·7H2O。4)该五元体系在258.15 K的相平衡研究可以为低温盐湖提锂工艺的开发及实际生产中的降温或蒸发过程提供理论基础。

