麦羟基硅钠石的可控合成及其阳离子交换性能研究
郭展展,周文元,杨韵斐,吴俊书,王金淑,孙领民,张志刚,杜玉成
(1.北京工业大学,北京 100124;2.中国恩菲工程技术有限公司,北京 100038)
水污染治理是环境生态保护的重要组成部分。废水中排放的大量剧毒、不可降解和生物累积的重金属离子严重影响了生态环境,对人类健康构成巨大威胁,因此消除污水中的重金属离子已经成为研究人员的一项重要课题[1]。目前,常见的处理水中重金属的方法有化学沉淀法、电解法、离子交换法、生物法和吸附法[2],相较而言,基于无机非金属矿物的吸附法因其原料丰富、成本低、高效、操作简便、易于工业化且绿色环保的优点而备受关注[3],已经成为环境污染控制和修复领域的研究热点[4]。层状硅酸盐黏土如高岭土、膨润土,是一类重要的无机非金属天然矿物,在自然界储量多、种类多、制备简单、价格低廉,已被广泛用作重金属吸附剂[5-8]。相比其他层状黏土矿物材料,层状硅酸钠材料麦羟基硅钠石(magadiite,Na2Si14O29·10H2O)成分均一、结构规整,具有更好的化学、热力学稳定性以及生物相容性[9]。麦羟基硅钠石的骨架结构主要由[SiO4]四面体构成,层板负电荷由SiO基团产生,而非源于同晶置换过程。麦羟基硅钠石层间骨架电荷由水合钠离子、氢离子平衡[10-11],位于层板表面的高活性Si—OH可显著提高层间电荷密度,因此其阳离子交换能力达1.56 meq/g,远大于膨润土等常规层状材料[12]。此外,麦羟基硅钠石层状材料具有较好的膨胀性,层间作用力较弱,其层间硅羟基可以和大尺寸的阳离子键合以调节层间距[13]。因此,可依据纳米晶组装化学相关原理对麦羟基硅钠石的层间结构进行改性,并基于离子交换反应有效构筑多种硅酸盐功能材料或直接用于重金属移除[14-17]。
目前,合成麦羟基硅钠石的主要原料有硅溶胶、水玻璃、正硅酸甲酯、正硅酸乙酯等化工产品,如JIANG等[18]使用硅溶胶、NaOH和Na2CO3在150 ℃下水热反应96 h得到了表面富含硅醇基团的麦羟基硅钠石纳米片,并以强配位形式实现钆离子的去除;YUAN等[19]在NaF存在的情况下,以胶体SiO2为硅源,与聚乙二醇300和NaOH形成混合体系,在160 ℃下水热反应24 h,合成高度分散的麦羟基硅钠石;ATTAR等[20]以硅胶为硅源,在NaOH和Na2CO3溶液中,于150 ℃水热反应96 h也可实现麦羟基硅钠石的合成,其与海藻酸的复合可有效去除水溶液中铅离子和镍离子;JÚNIOR等[21]以SiO2和NaOH为原料,采用原位共沉淀法,在150 ℃下水热反应48 h制备了麦羟基硅钠石异质结构光催化剂;SHI等[22]以水玻璃为原料在160 ℃下水热反应42 h得到麦羟基硅钠石,并经离子交换得到丝光沸石;NARASIMHARAO等[23]将SiO2和Na2CO3形成的致密凝胶在140 ℃下水热处理48 h得到麦羟基硅钠石及其相应的铜、铁、锰氧化物的插层衍生物。由此可以看出,麦羟基硅钠石的合成过程比较依赖硅源化学试剂,成本高、能耗高、要求严格,并可能造成二次污染[24],阻碍了麦羟基硅钠石的规模化制备和应用。硅藻土是一种较为理想的合成原料,在中国储量极为丰富,其主要成分为非晶态SiO2。硅藻土的三维骨架结构由角共享的[SiO4]四面体构成,其结构网络中存在的配位缺陷和氧桥缺陷使硅藻土具有较高的反应活性,可直接用于各类硅酸盐材料的合成以降低成本。本课题组前期以硅藻土为原料成功合成了P型沸石[Na3.552(Al3.6Si12.4O32)(H2O)10.656]与方钠石[Na8(AlSiO4)6(OH)2·4H2O],并表现出较好的Pb2+吸附、固定性能[25-26]。因此,本研究采用二次擦洗提纯后的硅藻土(SiO2质量分数为97%)作为硅源,选择性地合成片状麦羟基硅钠石(Na2Si14O29·10H2O)。同时,通过调整硅藻土原料的化学处理途径,实现硅藻土的沸石化,得到方沸石[Na(AlSi2O6)H2O]。通过比较麦羟基硅钠石与方沸石的形成能,证实硅藻土中铝对麦羟基硅钠石合成的影响。选择麦羟基硅钠石片状材料作为重金属离子吸附剂,系统考察麦羟基硅钠石的层间阳离子交换性能,为其进一步的结构探索与吸附应用提供可靠的实验依据。
1 实验部分
1.1 麦羟基硅钠石的可控制备
在典型的合成过程中,首先将5 g二次擦洗后的硅藻土(吉林白山靖宇县,盘状)分散到100 mL NaOH溶液(0.5 mol/L,分析纯)中,水浴加热至80 ℃,以450 r/min的转速磁力搅拌3 h,得到澄清溶液(称为ACW)。然后,取10 mL ACW、0.3 g硅藻土在室温下混合搅拌20 min,放入高压釜中于180 ℃反应24 h。反应结束,待高压釜冷却至室温后进行过滤,过滤产物经蒸馏水和无水乙醇(分析纯)多次洗涤,并在60 ℃下干燥12 h,最终得到方沸石。
首先将5 g二次擦洗后的硅藻土分散到100 mL HCl溶液(5 mol/L,分析纯)中,水浴加热至80 ℃,以450 r/min的转速磁力搅拌5 h,离心、洗涤、干燥得到HCl酸洗除杂后的硅藻土(BCW)。然后,称取0.9 g BCW、0.2 g NaOH和10 mL蒸馏水混合并搅拌20 min,再放入高压釜中于180 ℃反应24 h。反应结束,待高压釜冷却至室温后进行过滤,过滤产物经蒸馏水和无水乙醇(分析纯)多次洗涤,并在60 ℃下干燥12 h,最终得到麦羟基硅钠石。
1.2 材料的表征
采用XRD-7000型X射线衍射仪(XRD)对样品的晶体结构进行物相分析,测试条件:Cu靶,管电压为40 kV,管电流为30 mA,扫描方式为步进扫描,扫描步宽为0.02°,扫描范围为5~80°,每次采集时间为0.5 s;采用SU 8020型扫描电子显微镜(SEM)在10 kV的加速电压下观察样品表面形貌,并用能谱仪(EDS)测定样品的元素组成;采用JEM-2100型场发射透射电子显微镜(TEM)在200 kV的加速电压下检测样品形态信息和微结构;金属元素含量通过IRIS Intrepid ER/S型电感耦合等离子体原子发射光谱仪(ICP-AES)测定;采用Thermo Scientific Escalab 250Xi型光电子能谱仪(XPS)分析样品组分。
1.3 性能测试
首先利用Co(NO3)2·6H2O、Ni(NO3)2·6H2O配制含Co2+、Ni2+的水溶液,然后各取60 mL的Co2+、Ni2+溶液倒入烧杯中,随后各加入30 mg麦羟基硅钠石粉末,再将烧杯密封,在磁力搅拌器上以550 r/min的转速搅拌直至达到吸附平衡。抽取2 mL悬浮液进行离心,并采用ICP-AES测试吸附前后溶液中Co2+、Ni2+的浓度。平衡吸附容量qe的计算公式如下:
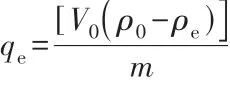
式中:ρ0和ρe分别为重金属离子的初始质量浓度和平衡质量浓度,mg/L;V0为溶液的初始体积,L;m为吸附剂的用量,g。
另 外,分 别 称 取0.4 g的LiCl、MgCl2·6H2O、Zn(NO3)2·6H2O、Co(NO3)2·6H2O、Ni(NO3)2·6H2O、Cu(NO3)2·3H2O、AgNO3于聚四氟乙烯内衬中,再分别加入200 mg麦羟基硅钠石粉末,在25 ℃下以550 r/min的转速搅拌20 min,然后在160 ℃的水热条件下反应24 h进行离子交换。
2 结果与讨论
2.1 方沸石和麦羟基硅钠石样品的表征
对方沸石和麦羟基硅钠石样品进行物相分析,如图1所示。图1a为二次擦洗后硅藻土原料的XRD谱图,从图1a可知,硅藻土是非晶态物质,在2θ=26.3°处的衍射峰归属于石英杂质的(101)晶面。以该类硅藻土为硅源采用水热合成法制备的麦羟基硅钠石的XRD谱图如图1b所示。由图1b可知,该合成样品的衍射光谱与标准麦羟基硅钠石的衍射光谱(JCPDS 42-1350)相吻合,没有其他杂质峰,证实合成了纯净的麦羟基硅钠石产品。由此说明,二次洗涤后的硅藻土需要用盐酸进一步洗涤,以去除Ca、Mg、Fe、Al等氧化物杂质,尤其是Al氧化物杂质。如果没有用盐酸进一步洗涤,Al元素杂质在强碱性环境中(合成使用了NaOH)能够掺入Si—O结构网络形成硅铝酸盐进而通过后续反应得到方沸石,其XRD谱图与方沸石标准衍射光谱(JCPDS 74-2219)相匹配。
上述结果表明,用盐酸对硅藻土进行杂质元素脱除对制备麦羟基硅钠石至关重要。硅藻土原料的化学成分如表1所示,由表1可知Al元素的质量分数仅为1.03%,但其仍然可以使铝硅酸盐方沸石结晶,这表明方沸石的形成能低于麦羟基硅钠石。方沸石和麦羟基硅钠石相的XRD拟合谱图及晶体结构如图1c、d所示。采用VASP软件包进行广义梯度近似泛函(GGA)模拟计算,以获取方沸石和麦羟基硅钠石的形成能。模拟计算条件:平面波截断能ENCUT设置为450 eV;所有原子都进行优化弛豫,原子间相互作用力的收敛标准为0.1 eV/nm;布里渊区K点设置精度为0.3(20×π/nm);自洽收敛标准EDIFF=5E-7。模拟计算公式如下:
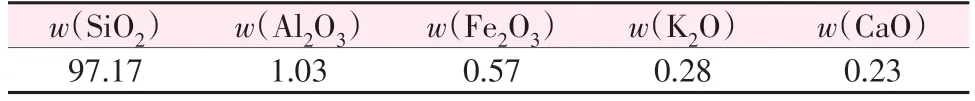
表1 二次擦洗后硅藻土原料的化学组成Table 1 Chemical compositions of raw diatomite after secondary scrubbing %
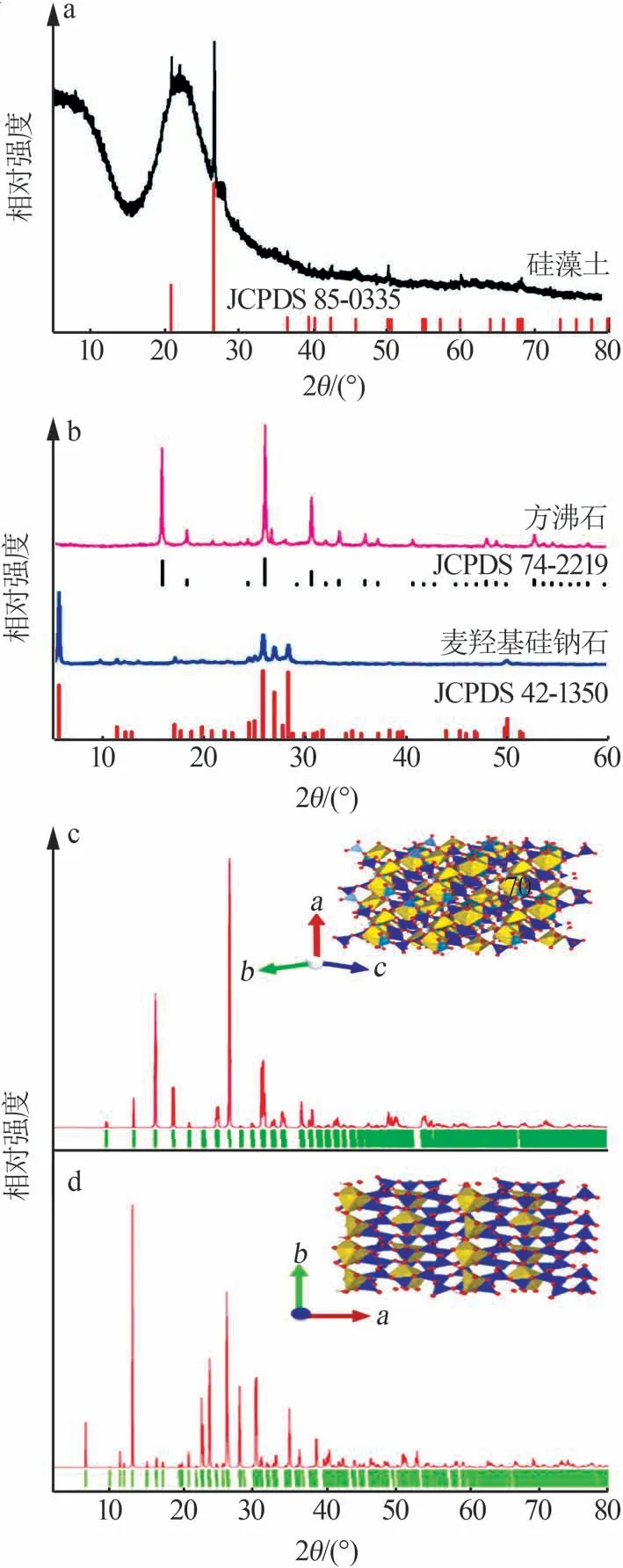
图1 经二次擦洗提纯后硅藻土的XRD谱图(a);不同反应条件下所制备样品的XRD谱图(b);方沸石和麦羟基硅钠石样品的XRD拟合谱图及结构图(c、d)Fig.1 XRD patterns of diatomite after secondary scrubbing and purification(a)and the as-prepared samples with different conditions(b);XRD fitting spectra and structural diagrams of analcime and magadiite samples(c,d)
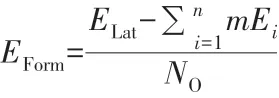
式中:EForm表示物相的形成能;ELat表示结构的总能量;Ei为结构中1 mol对应单元氧化物i的能量;m表示对应单元氧化物i在结构中的物质的量;n为结构中氧化物的种类;NO为结构中总的氧原子数量。由上式计算可得:方沸石的EForm=0.436 8 eV/atom;麦羟基硅钠石的EForm=0.180 9 eV/atom。因此,在相同环境且Al元素存在的情况下,方沸石相较于麦羟基硅钠石具有更小的形成能,因此更容易形成结晶。
图2为水热条件下合成的方沸石和麦羟基硅钠石样品的形貌图以及元素分布图。从图2a中可以发现,方沸石粉末较为均一,具有梭形形貌,由长度约为2.5 μm的纳米级棒状单元紧密有序堆叠而成。高倍率的TEM照片(图2b)进一步揭示了方沸石的微观结构,并证实方沸石由纳米棒自组装而成。经成分分析表明,方沸石由Na、Al、Si、O 4种元素组成且分布均匀(图2c)。由图2d可见,麦羟基硅钠石呈玫瑰花瓣状形貌,由片状结构单元有序堆叠而成,与文献所报道的麦羟基硅钠石形貌相似[15],是典型的热力学稳定态麦羟基硅钠石晶体形貌。TEM照片(图2e)进一步证实了麦羟基硅钠石具有有序的片状等级结构。由图2f可知,麦羟基硅钠石由3种化学元素(Na、Si和O)组成且分布均匀。因此,利用原硅藻土的Al组分可以选择性地获得方沸石和麦羟基硅钠石层状结构,这将为原硅藻土的进一步应用提供更大的空间。

图2 方沸石样品的SEM照片(a)、TEM照片(b)以及元素分布图(c);麦羟基硅钠石样品的SEM照片(d)、TEM照片(e)以及元素分布图(f)Fig.2 SEM image(a),TEM image(b)and element mapping images of analcime sample(c);SEM image(d),TEM image(e)and element mapping images of magadiite sample(f)
通过XPS表征分析了方沸石和麦羟基硅钠石的表面元素价态,结果如图3所示。由图3a可知,方沸石和麦羟基硅钠石材料表面都含有Na、Si、O。此外,方沸石还含有Al元素,而在麦羟基硅钠石中未检测到Al及其他杂质元素,表明硅藻土原料中的Al杂质已被彻底去除。Al元素的XPS谱图进一步证实了方沸石中Al元素的存在(图3b)。由图3c可知,方沸石的高分辨率O 1s光谱被拟合分峰成3个不同的峰,即在533.41 eV和532.11 eV处的峰分别归属于Si—O—Si和Al—O—Si,532.96 eV处的峰归属于—OH。对于麦羟基硅钠石,O 1s光谱被拟合分峰成2个不同的峰,即在532.9 eV和532.15 eV处的峰分别归属于Si—O—Si和—OH。类似地,方沸石与麦羟基硅钠石的Si 2p光谱进一步证实了Al元素对于材料结构成键方式和状态的影响(图3d)。方沸石的高分辨率Si 2p光谱被拟合分峰成3个不同的峰,即在104.01、103.36、102.71 eV处的峰分别归属于Si—OH、Si—O—Si和Al—O—Si,而麦羟基硅钠石的Si 2p光谱被拟合分峰成2个不同的峰,即在103.55 eV和103.1 eV处的峰分别归属于Si—OH和Si—O—Si。因此,合成麦羟基硅钠石材料必须考虑Al元素对于材料结晶与成键的影响,在Al元素存在的条件下,热力学稳定相为Na(AlSi2O6)H2O。
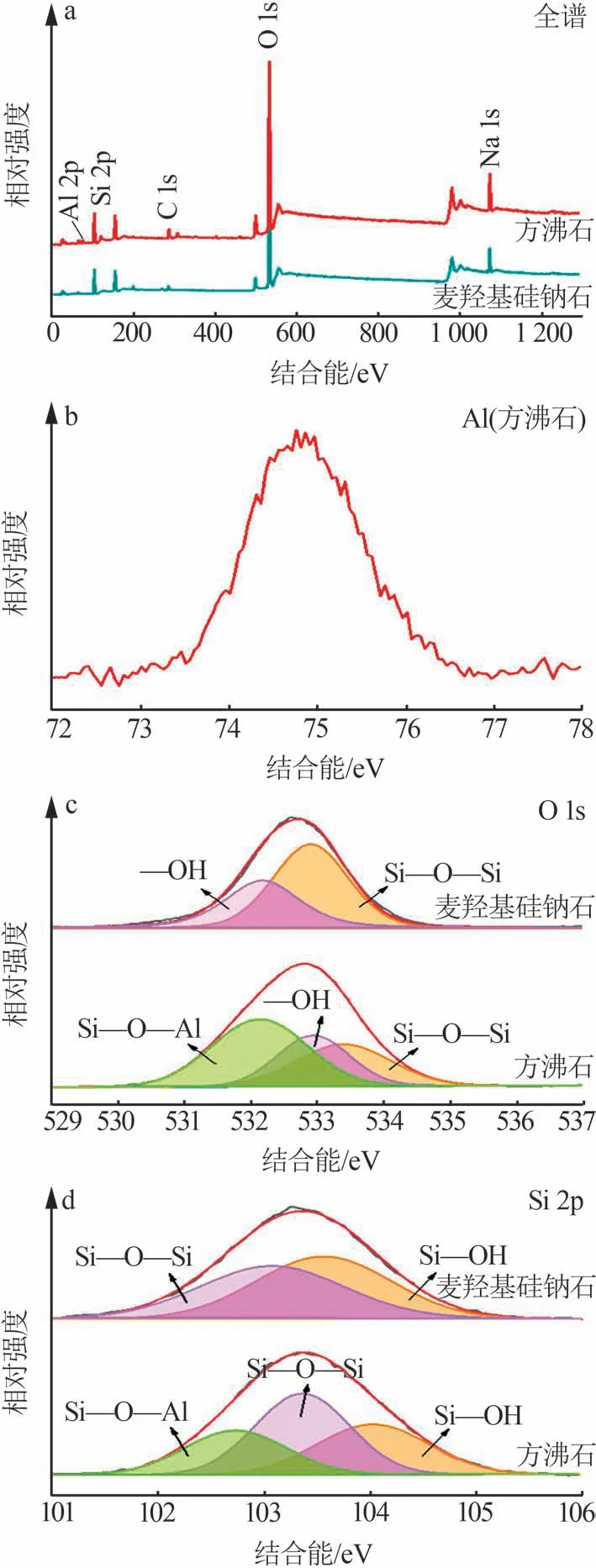
图3 方沸石和麦羟基硅钠石的XPS图Fig.3 XPS spectra of analcime and magadiite
2.2 麦羟基硅钠石的金属阳离子交换性能研究
选择麦羟基硅钠石为研究对象,考察其在25 ℃和160 ℃条件下与不同价态金属离子(Li+、Mg2+、Zn2+、Co2+、Ni2+、Cu2+)的层间交换性能,交换后的产物命名为M-magadiite(M=Li、Mg、Zn、Co、Ni、Cu)。采用XRD对上述6种金属阳离子交换后的产物进行表征,如图4a、b所示。由图4a、b可知,与原始的麦羟基硅钠石XRD谱图相比,两种温度下的6种金属阳离子交换产物的XRD谱图均发生改变,尤其是麦羟基硅钠石的(001)特征峰(2θ=5.7°),交换后其强度明显减弱且向高角度偏移,说明麦羟基硅钠石的层间距变小,Na+被取代,上述金属离子分别交换至麦羟基硅钠石的层间中。在水溶液中,金属离子的波恩半径(RBorn)与金属阳离子的微观溶剂结构(如水分子的极化、水合配位数、溶剂的介电响应等)相关,能更好地反映金属离子在水溶液中的行为。Na+、Li+、Mg2+、Zn2+、Co2+、Ni2+、Cu2+的波恩半径分别为0.167 2、0.127 4、0.140 8、0.141 8、0.142 8、0.137 9、0.145 7 nm[27],6种金属阳离子与层间Na+交换以后,离子半径更小的水合金属离子进入层间,使层间距缩小,这一现象与XRD结果一致。两种温度下,离子交换前后的形貌对比如图4c、d所示。由图4c、d可以看出,Na+和其他金属离子交换后材料形貌没有发生明显变化,说明麦羟基硅钠石框架在离子进出过程中化学稳定性较好,且在离子交换过程中温度对结构和形貌的影响不大。
为了进一步证明麦羟基硅钠石的层间阳离子交换性能,以吸附Co2+、Ni2+为例考察了其吸附稳定性、吸附动力学、吸附机制等。图5为原麦羟基硅钠石及其吸附Co2+、Ni2+后的形貌及元素分布图。由图5a1可以清晰地看到麦羟基硅钠石呈玫瑰花瓣状形貌。吸附Co2+、Ni2+后,麦羟基硅钠石形貌没有发生明显变化,均是由厚度约为50 nm的纳米片堆叠形成的层状团簇结构,形态均匀(图5b1、c1)。原始的麦羟基硅钠石的松散结构不仅有利于缓冲离子插层过程中产生的应力,还可以减少离子扩散距离,为离子交换提供丰富的活性位点,从而提高材料的活性。通过TEM表征进一步观察了原始的麦羟基硅钠石及其吸附Co2+、Ni2+后的微观结构,如图5a2~c2所示。由图5a2~c2可知,吸附Co2+、Ni2+后,麦羟基硅钠石内部仍具有非常均匀的层状结构,层厚度与SEM表征结果一致。图中清晰可见的层状条纹说明麦羟基硅钠石的层状结构在与Co2+、Ni2+进行离子交换后并未受损,仍具有规整的层间结构。原始的麦羟基硅钠石层间距为1.56 nm,在Co2+、Ni2+与Na+交换后,层间距分别降低至0.24 nm和0.23 nm,说明Co2+、Ni2+分别交换到麦羟基硅钠石的层空间中,得到Co2+交换后的麦羟基硅钠石(Co-magadiite)和Ni2+交换后的麦羟基硅钠石(Ni-magadiite)。理论上热力学稳定的水合钠离子半径为0.167 2 nm,而Co2+、Ni2+的热力学稳定的波恩离子半径分别为0.1428、0.1379 nm,层间交换离子后,理论上层间距会发生变化,这一点已由XRD表征的谱峰位移得到证实(见图4)。图5d、e为麦羟基硅钠石吸附Co2+、Ni2+后的元素分布图。由图5d、e可知,Co-magadiite和Ni-magadiite分别由Co、Na、Si、O和Na、Ni、Si、O元素组成,且分布均匀,其中Na元素的存在说明仍有Na+残留在麦羟基硅钠石层间,离子交换进行得不彻底。
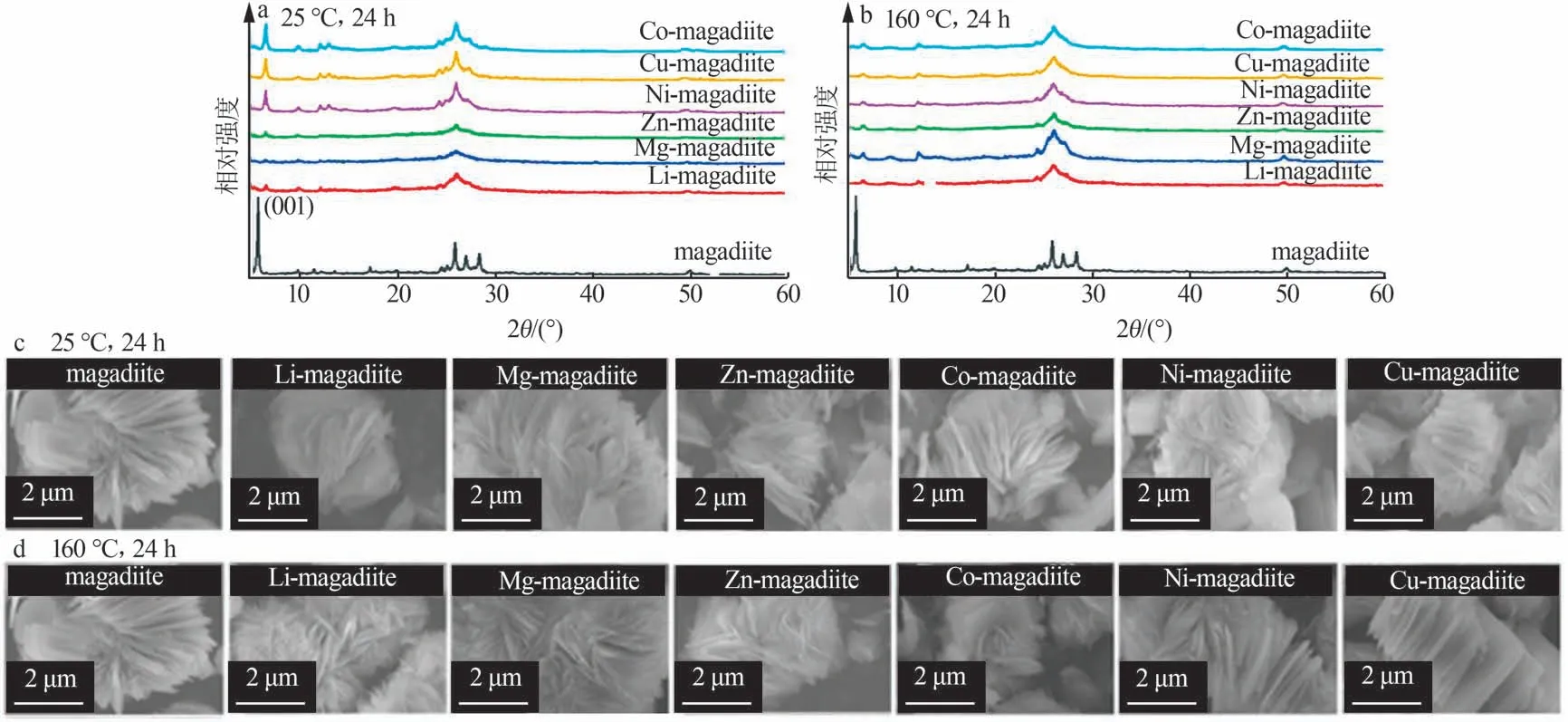
图4 不同温度条件下金属阳离子(Li+、Mg2+、Zn2+、Co2+、Ni2+、Cu2+)交换24 h后的麦羟基硅钠石的XRD谱图(a、b)和SEM照片(c、d)Fig.4 XRD patterns(a,b)and SEM images(c,d)of magadiite after metal cation(Li+,Mg2+,Zn2+,Co2+,Ni2+,Cu2+)exchanged at different temperature for 24 h
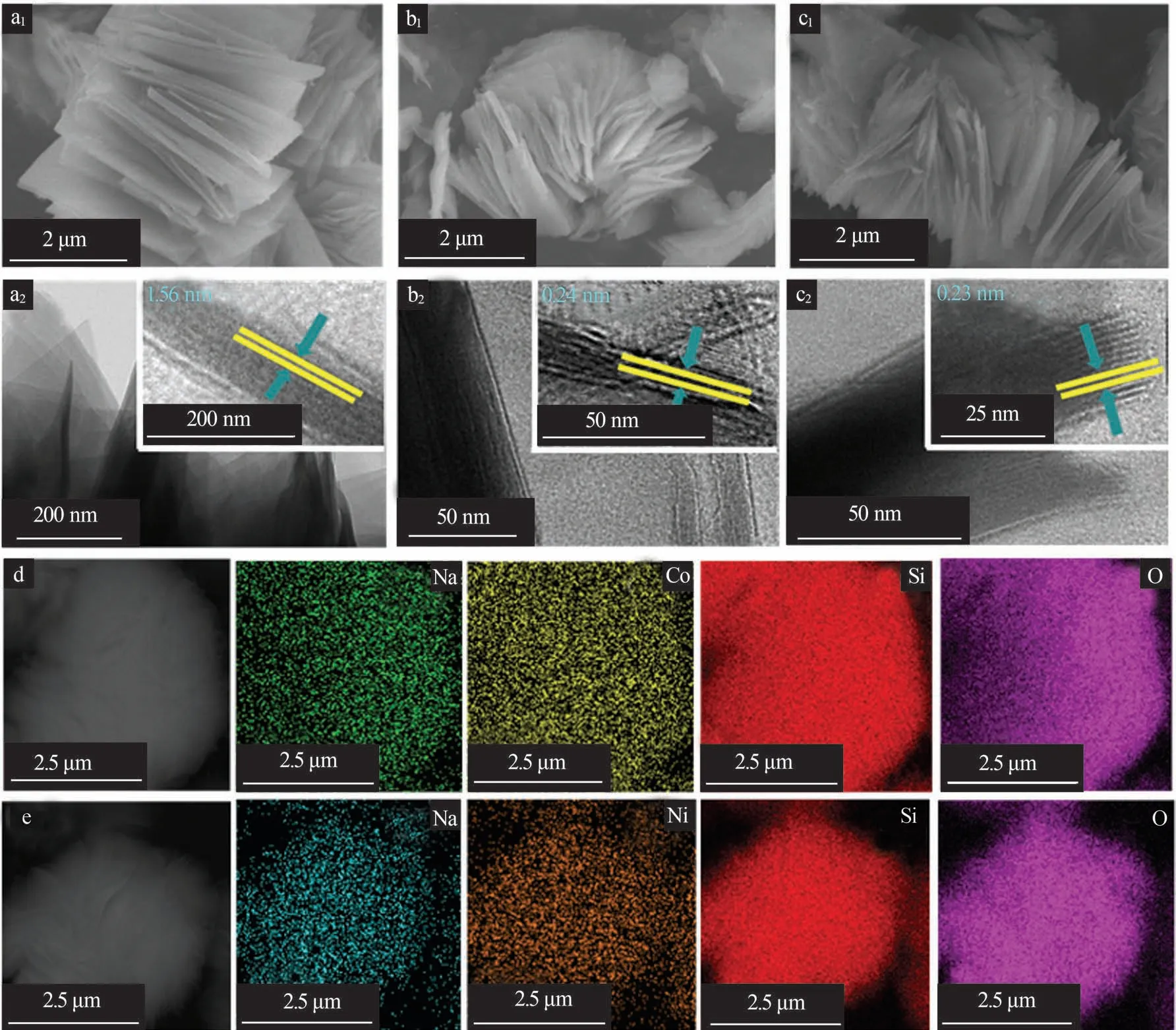
图5 麦羟基硅钠石及其在160 ℃吸附Co2+、Ni2+ 24 h后的SEM、TEM照片及元素分布图Fig.5 SEM,TEM images and element distributions of magadiite and its adsorption of Co2+ and Ni2+ at 160 ℃ for 24 h
采用XPS表征分析了麦羟基硅钠石吸附Co2+、Ni2+后的组分和价态,如图6所示。麦羟基硅钠石的XPS全谱图中存在Si、O、Na元素,而Co-magadiite和Ni-magadiite的XPS全谱图中除Si、O外还有相应金属元素Co和Ni(图6a)。Co-magadiite和Ni-magadiite的O 1s光谱(图6b)可以分解为2个峰分别归属为Si—O和M—O(M=Co、Ni)。对于Co-magadiite,位于532.68 eV处的峰归属于Si—O,位于532.18 eV处的峰归属于Co—O;对于Ni-magadiite,位于532.88 eV处的峰归属于Si—O,位于532.28 eV处的峰归属于Ni—O。在Co-magadiite的Co 2p光谱中(图6c)位于798.03 eV和782.03 eV处的峰分别为Co 2p1/2和Co 2p3/2,位于803.43 eV和786.98 eV处的峰为特征卫星峰(sat.)[28-29]。Co 2p1/2和Co 2p3/2的自旋轨道分裂值为16 eV,这充分证明了二价Co的存在。在Ni-magadiite的Ni 2p光谱中(图6d)位于874.28 eV和856.68 eV处的峰分别为Ni 2p1/2和Ni 2p3/2,位于880.43 eV和862.13 eV处的峰为特征卫星峰[30-31]。Ni 2p1/2和Ni 2p3/2的自旋轨道分裂值为17.6 eV。与此同时,其特征卫星峰值比主峰值高约6 eV,进一步证明了二价Ni的存在。
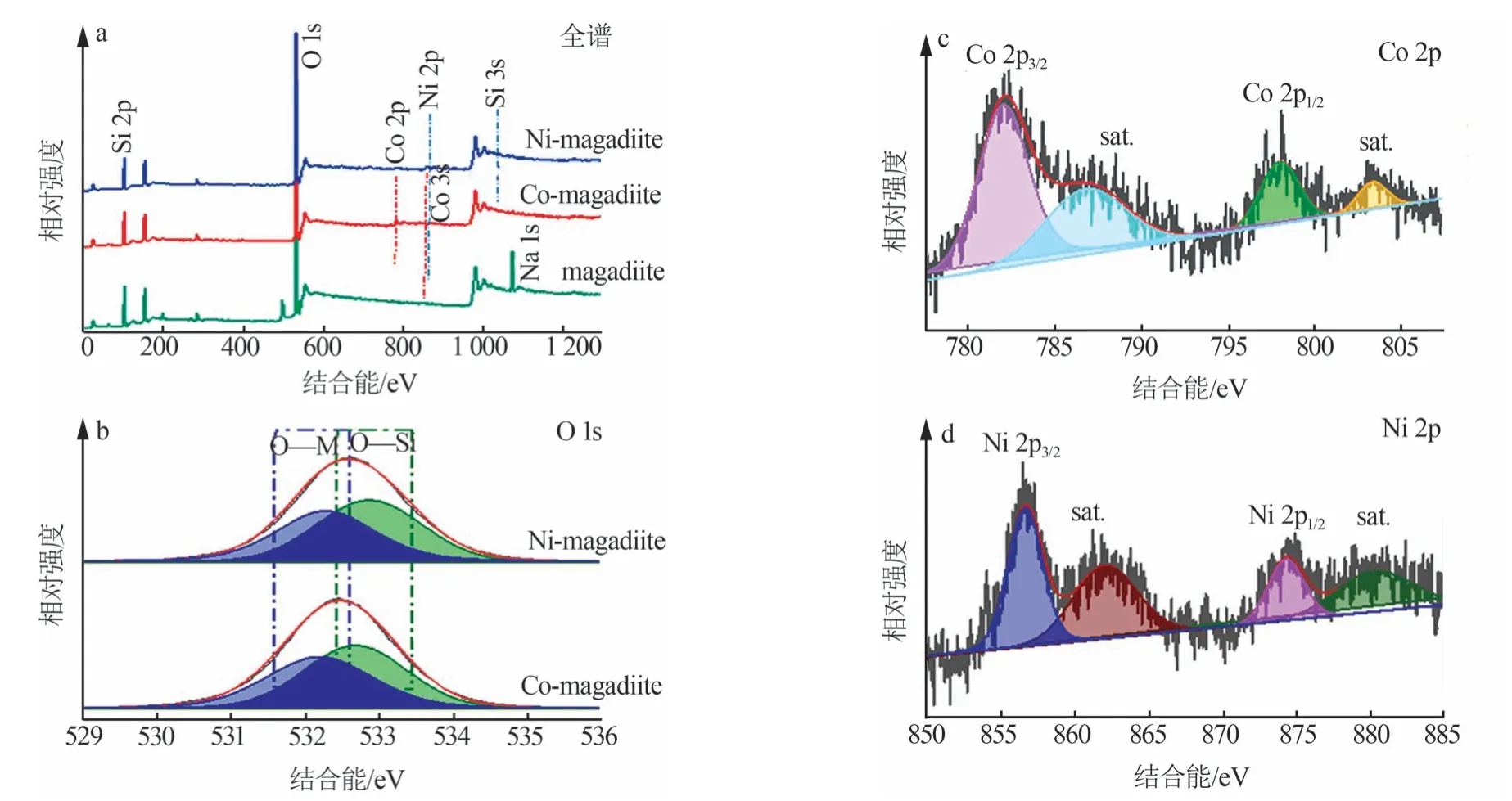
图6 麦羟基硅钠石、Co-magadiite和Ni-magadiite的XPS图Fig.6 XPS spectra of magadiite,Co-magadiite and Ni-magadiite
2.3 麦羟基硅钠石的吸附动力学
根据Co2+、Ni2+两种金属离子的吸附数据,研究了重金属离子在麦羟基硅钠石上的吸附动力学,如图7所示。从图7a1、a2可以看出,麦羟基硅钠石对Co2+的最大吸附容量为45 mg/g,对Ni2+的最大吸附容量为39 mg/g。此外,qe随着初始浓度的增加而迅速增大,这是由于初始离子浓度梯度高,导致水相中金属离子传质的驱动力增强;当Co2+、Ni2+初始质量浓度增加至50 mg/L时,这一变化趋于平稳,表明结合位点已经接近饱和,对Co2+和Ni2+的吸附过程减慢。因此,吸附的有效性取决于吸附体系中吸附剂和吸附质的平衡状态。图7a1、a2中插图为25 ℃条件下一定量的麦羟基硅钠石(30 mg)对Co2+(30 mg/L,60 mL)和Ni2+(20 mg/L,60 mL)的吸附速率变化趋势。结果表明,在起始阶段麦羟基硅钠石的吸附位点足够多,对金属离子的吸附速率较快,半个小时后,活性位点被耗尽,吸附过程达到平衡。这是因为在最初阶段吸附位点足够多,麦羟基硅钠石与Co2+、Ni2+之间碰撞概率增加引起了聚集效应,然而随着时间的延长,Co2+、Ni2+与麦羟基硅钠石之间碰撞概率相对减小,吸附趋于平衡。调整Co2+、Ni2+的初始浓度,当初始质量浓度分别降低至20、10 mg/L时,麦羟基硅钠石对Co2+、Ni2+的吸附率最高分别可达到87.34%和98.17%(图7b1、7b2),表明在吸附体系中加入一定量的吸附剂后,初始浓度较低的Co2+、Ni2+能够与吸附剂麦羟基硅钠石表面充分相互作用,因而在低浓度下具有较高的吸附率。随着Co2+、Ni2+浓度的增加,Co2+、Ni2+与吸附剂之间有效碰撞的概率逐渐降低,导致吸附率减小。由图7c1可知,Co2+、Ni2+的线性相关系数分别为0.989、0.983,表明实验数据与Langmuir模型拟合良好,重金属离子在麦羟基硅钠石上的整个吸附过程是单层吸附。利用准二级动力学模型拟合来推断麦羟基硅钠石对重金属离子的吸附过程,结果表明Co2+、Ni2+的线性相关系数均在0.99以上(图7c2),因此该吸附过程以化学吸附为主。
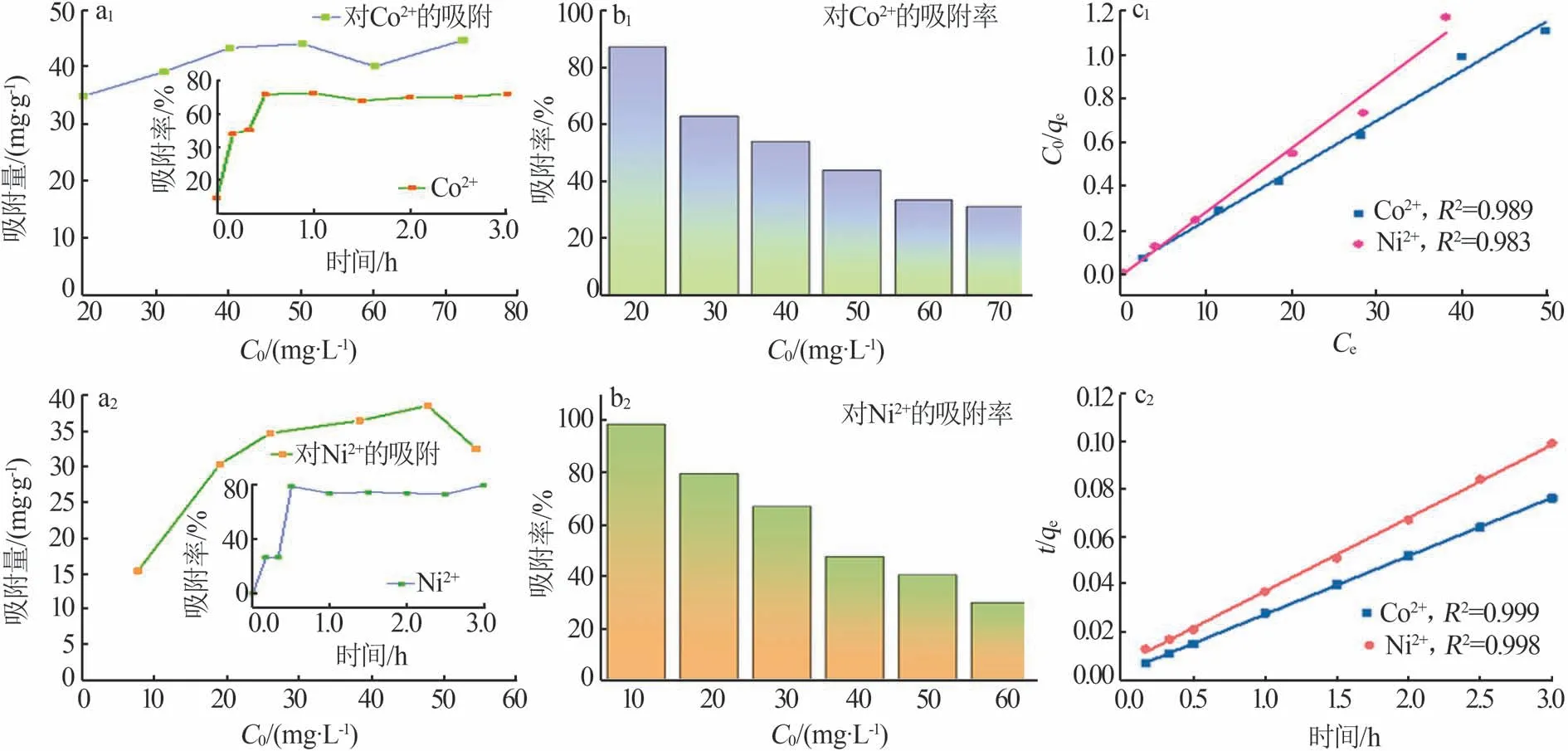
图7 Co2+、Ni2+的平衡吸附量随初始浓度C0的变化趋势(a1、a2),插图为吸附率随时间的变化曲线;Co2+、Ni2+的吸附率随初始浓度C0的变化趋势(b1、b2);Co2+、Ni2+吸附过程的Langmuir吸附等温线拟合(c1);Co2+、Ni2+吸附过程的准二级模型拟合(c2)Fig.7 Equilibrium adsorption capacity as a function of initial concentration C0 of Co2+ and Ni2+ (a1,a2),insets are change of adsorption efficiency towards time;Change of adsorption rate as a function of initial concentration C0 of Co2+ and Ni2+ (b1,b2);Langmuir adsorption isotherms of Co2+ and Ni2+(c1);Pseudo second order model fitting of Co2+ and Ni2+ adsorption data(c2)
2.4 金属离子吸附固定机理
在不同浓度的Co2+、Ni2+溶液中,加入30 mg的麦羟基硅钠石,室温条件下吸附一段时间后,对溶液中释放的Na+以及剩余的Co2+、Ni2+进行检测,结果如图8所示。由图8a可知,当Co2+初始质量浓度为20 mg/L时,吸附一段时间后Na+浓度为0.69 mmol/L,吸附的Co2+浓度为0.3 mmol/L,释放的Na+量大约是吸附的Co2+量的2倍;当Co2+初始质量浓度增加(C0为30~70 mg/L)时,仍存在类似的规律,即释放的Na+量约为吸附的Co2+量的2倍,存在的偏差源于随着Co2+初始浓度的增加,外表面的吸附也会同时存在[25],导致两者并非是完美的2倍关系;此外盐溶液中H+也会与Na+进行交换,这在阳离子型层状化合物中较为常见。Ni2+吸附数据也存在类似的现象(图8b),即由于H+作用以及外表面的化学吸附等因素导致释放的Na+量与吸附的Ni2+量仍未呈现出完美的2倍关系。因此,麦羟基硅钠石对Co2+、Ni2+的吸附主要为阳离子的交换机制(见图8c),即在麦羟基硅钠石骨架中具有强离子交换性的Na+很容易与Co2+、Ni2+进行离子交换,二价的Co2+、Ni2+进入层间以后,可以取代2倍量的一价Na+,以保证层间的离子电荷平衡。同时,麦羟基硅钠石的层间距远大于Co2+和Ni2+的半径,这有利于离子在进行离子交换时通过框架结构中的纳米通道进行迁移、扩散,从而确保麦羟基硅钠石吸附材料的结构稳定性。此外,本课题组前期研究发现硅酸盐阴离子易水解释放OH-[25],并与水溶液中的Co2+、Ni2+结合,在麦羟基硅钠石表面分别形成含Co2+、Ni2+的化学沉淀物质,该化学吸附也有利于麦羟基硅钠石对重金属离子Co2+、Ni2+的吸附与固定[26]。

图8 麦羟基硅钠石吸附过程中Co2+、Ni2+的吸附量以及所对应的Na+释放量(a、b);离子交换吸附机制示意图(c)Fig.8 Removal amount of Co2+ and Ni2+and release amount of corresponding Na+ during magadiite adsorption(a,b);Schematic diagram of ion exchange adsorption mechanism(c)
3 结论
以硅藻土为硅源,在水热环境下可以选择性地合成麦羟基硅钠石材料并表现出较好的阳离子交换性能,在构建层状硅酸盐功能材料及重金属阳离子吸附方面也具有较大的应用潜力,主要结论如下。
1)以二次擦洗的硅藻土为硅源,在合成过程中若经酸洗除杂,可以得到层状结构的麦羟基硅钠石,而若保留硅藻土原料中的Al元素杂质,可合成得到方沸石,通过理论计算发现方沸石具有更低的形成能,因此更易结晶析出。
2)麦羟基硅钠石层间具有离子交换能力,钠离子可被其他金属阳离子交换,如Li+、Mg2+、Zn2+、Co2+、Ni2+、Cu2+。水合离子半径更小的金属离子进入层间与Na+交换,导致麦羟基硅钠石结构框架的层间距缩小。在交换过程中,无论是25 ℃还是160 ℃均能保持稳定的结构框架,该结果可为基于麦羟基硅钠石获取不同类别的硅酸盐功能材料提供理论依据。
3)Co2+、Ni2+进入层间使得层间距由麦羟基硅钠石本征的1.56 nm分别降至0.24、0.23 nm。室温下,麦羟基硅钠石框架对Co2+、Ni2+的最大吸附量分别可达45、39 mg/g,吸附过程均符合Langmuir单层吸附模型且以化学吸附为主。Co2+、Ni2+置换出的Na+量约为吸附的Co2+、Ni2+量的2倍,证实了层间离子交换的化学过程,但仍存在其他类型的表面吸附作用。

