苁归益肾胶囊对糖尿病肾病大鼠肾纤维化及MEK/ERK信号通路的影响
阮诺冰,李金菊,林逸轩,王帆竞,方朝晖
(1.安徽中医药大学研究生院,安徽 合肥 230038;2.合肥市第一人民医院,安徽 合肥 230061;3.安徽省中医药科学院中医药防治糖尿病研究所,安徽 合肥 230031;4.安徽中医药大学第一附属医院,安徽 合肥 230031)
糖尿病肾病(Diabetes kidney disease,DKD)是糖尿病(Diabetes mellitus,DM)最常见的微血管并发症之一,患病率逐年增长[1],是导致终末期肾病(End stage renal disease,ESRD)最主要的病因之一[2]。本病病理特征主要为肾小球硬化及间质纤维化,致使有效肾单位逐渐减少,进而造成不可逆的肾功能受损。现阶段该疾病临床治疗手段有限,以饮食调整为基础,前期以调节糖脂代谢紊乱、稳定血压为主,肾功能严重衰竭时,则根据条件采用肾脏替代疗法[3],对于降低 DKD 的发病率及阻止进一步发展作用甚微。因此临床迫切需要寻找到一种对延缓 DKD 进展稳妥有效的治疗方法。
近年来,采用中医学防治DKD受到了愈来愈多临床工作者的重视,多项临床研究均证实运用包括中药内服、针灸、中药灌肠等在内的中医手段治疗DKD卓有成效[4-6]。DKD早期以阴虚为主,病至后期以肾脏虚损为主,故瘀血贯穿DKD的整个病程,因此治疗上以补肾化瘀通络为基本治则。苁归益肾胶囊是由导师方朝晖教授研制具有补肾益精、活血化瘀功效的中药复方制剂。前期临床研究发现应用苁归益肾胶囊治疗DKD疗效斐然[7-9],但其作用机制尚不明确。基于此,本研究以DKD大鼠为研究对象,以MEK/ERK信号通路及促纤维化因子为切入点,探讨苁归益肾胶囊作用于DKD的可能机制,为中医药防治DKD提供数据支持与科学参考。
1 材料与方法
1.1 实验动物 90只6周龄雄性SPF级大鼠,体重180~220 g,购于安徽省实验动物中心,动物许可证编号:SCXK(皖)2019-001。饲养于安徽医科大学实验动物中心,温度22.5~24.5 ℃,湿度55%左右,光照与黑暗(12 h/12 h)交替,自由饮食。
1.2 药物、试剂与仪器 苁归益肾胶囊(购于安徽省中医院药物制剂中心,皖药制字:BZ20130034)。厄贝沙坦片(浙江华海药业股份有限公司生产,国药准字H20030016)。链尿佐菌素(STZ,德国Biofroxx),RIPA细胞裂解剂(Beyotime生物),BUN、Scr检测试剂盒(上海信裕生物),Masson染色试剂盒(Solarbio),苏木素染色液、伊红染色液(Baso生物),兔抗鼠MEK、p-MEK、兔抗鼠ERK、p-ERK(美国CST),兔抗鼠TGF-β1(英国Abcam)。
全自动离心机(德国Eppendorf)、电泳仪、电泳槽、转膜仪(上海Tanon)、生化分析仪(美国BioTek)、酶标分析仪(深圳Rayto)、徕卡切片机、光学显微镜(日本Olympus)、生物组织自动脱水机(湖北亚光)。
1.3 实验方法 分组、造模及干预方式:90只SD大鼠适应性喂养1周后,随机分为空白组 10只,造模组80只,空白组予普通饲料,造模组予高糖高脂饲料继续喂养4周后造模。造模组大鼠按35 mg/kg标准腹腔注射1%链尿佐菌素(STZ),空白组大鼠腹腔注射等剂量柠檬酸钠缓冲液。3 d后若随机血糖≥16.7 mmol/L,则DM大鼠造模成功。继续饲喂糖高脂饲料2周,若24 hUP>30 mg/24 h则DKD大鼠造模成功。共成功造模65只,随机分为模型组、厄贝沙坦组及苁归益肾胶囊高、中、低剂量组,每组13只。大鼠等效剂量计算方法参照《药理实验方法学》[10],空白组与模型组按5 ml/(kg·d)予0.9%氯化钠溶液,厄贝沙坦组按15 mg/(kg·d)给药,苁归益肾胶囊高、中、低剂量组分别按1080、540、270 mg/(kg·d)剂量给药。
至药物干预周期结束,空白组存活10只大鼠;模型组因互相撕咬感染和血糖过高死亡4只;厄贝沙坦组因灌胃不当死亡2只;苁归益肾胶囊高剂量组因灌胃不当死亡2只,因互相撕咬伤口感染死亡1只;苁归益肾胶囊中剂量组因灌胃不当死亡1只;苁归益肾胶囊低剂量组因灌胃不当死亡2只。
1.4 标本采集与指标检测
1.4.1 血清、尿液、肾脏组织采集:给药12周后进行标本采集,留取24 h尿液,以备检测24 h尿蛋白定量(24 hUP)。腹腔注射1%戊巴比妥钠(40 mg/kg)麻醉大鼠,腹主动脉取血约5 ml, 高速离心机(3000 r/min)离心20 min,留取上清液,标记信息,保存于-80 ℃冰箱以备检测。快速分离肾脏表面筋膜及脂肪囊后剪下两个肾脏,其中1个分剪为小块后放入无菌冻存管,标记信息后保存于-80 ℃冰箱以备Western blot检测,另1个肾脏用4%多聚甲醛室温固定以备HE及Masson染色。
1.4.2 生化指标检测:给药前后血糖数值均为刺破大鼠尾尖用血糖仪测得。用肌酐(Scr)检测试剂盒(肌氨酸氧化酶法)检测血清Scr值,用尿素氮(BUN)检测试剂盒(脲酶法)检测血清BUN值。使用全自动生化仪进行24 hUP检测。
1.4.3 组织病理学检测:取出多聚甲醛中的大鼠肾脏,乙醇脱水、二甲苯透明、石蜡包埋、切片(4 μm/片),一部分切片进行HE染色,光学显微镜下观察病理学变化。另一部分切片进行Masson染色,根据颜色可知红色为肌纤维,蓝绿色为胶原纤维。
1.4.4 Western blot检测转化生长因子β1(TGF-β1)、MEK/ERK通路相关蛋白的表达:每组取肾脏组织0.1 g,加入1 ml细胞裂解液,匀浆,离心后提取蛋白,配制BCA工作液测定蛋白质量浓度。制备SDS-PAGE凝胶,上样后,电泳,转膜,转膜后常温封闭1 h,一抗4 ℃孵育过夜,TBST 洗3次,二抗室温孵育 30 min,洗膜后加入ECL化学发光液显影。采用Image J软件进行灰度值量化分析,目的蛋白灰度值/ GAPDH灰度值的结果为目的蛋白的相对表达量。
1.5 统计学方法 采用SPSS 21.0统计学软件进行分析。进行正态性及方差齐性检验,符合正态分布的计量资料用均数±标准差表示,采用t检验;P<0.05表示差异具有统计学意义。
2 结 果
2.1 各组大鼠FPG比较 见表1。药物干预前,模型组、厄贝沙坦组与苁归益肾胶囊各剂量组FPG比空白组高(P<0.05)。干预后,模型组、厄贝沙坦组与苁归益肾胶囊各剂量组FPG比空白组高(P<0.05);苁归益肾胶囊高、中剂量组比模型组FPG低(P<0.05)。

表1 各组大鼠FPG比较(mmol/L)
2.2 各组大鼠BUN、Scr比较 见表2。药物干预12周后,与空白组比较,模型组、厄贝沙坦组与苁归益肾胶囊各剂量组BUN、Scr上升(P<0.05);厄贝沙坦组、苁归益肾胶囊各剂量组BUN、Scr比模型组低(P<0.05);相较厄贝沙坦组,苁归益肾胶囊高剂量组BUN降低,Scr升高(P>0.05),苁归益肾胶囊中、低剂量组BUN、Scr上升(P<0.05)。

表2 各组大鼠BUN、Scr 比较
2.3 各组大鼠24 hUP比较 见表3。干预前,模型组及各药物干预组24 hUP比空白组高(P<0.05)。12周后,与空白组比较,模型组、厄贝沙坦组与苁归益肾胶囊各剂量组24 hUP升高(P<0.05),相较于模型组,厄贝沙坦组及苁归益肾胶囊各剂量组24 hUP降低(P<0.05),与厄贝沙坦组比,苁归益肾胶囊中、低剂量组24 hUP升高(P<0.05)。

表3 各组大鼠24 hUP比较 (mg)
2.4 各组大鼠HE染色结果 空白组肾脏组织结构未见明显异常,肾小球大小均一,肾小管上皮细胞整齐排列,无明显炎症细胞浸润。模型组肾脏组织结构异常,部分肾小球系膜高度增生,毛细血管基底膜增厚,肾小管大量萎缩,部分上皮细胞空泡化,只见裸核,部分肾小管严重扩张,管腔可见蛋白黏液。相较于模型组,经药物干预的各组肾组织结构、肾小球系膜增生,基底膜增厚、肾小管上皮细胞空泡变性、炎性浸润等情况减轻(图1)。
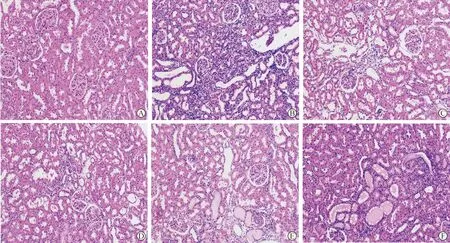
A:空白组;B:模型组;C:厄贝沙坦组;D:苁归益肾胶囊高剂量组;E:苁归益肾胶囊中剂量组;F:苁归益肾胶囊低剂量组
2.5 各组大鼠Masson染色结果 空白组大鼠肾脏组织结构正常,未见胶原纤维增殖,呈均匀的红染状态。模型组肾小管间质内可见大范围蓝染区域,分布不均匀,提示大量胶原纤维沉积。与模型组比较,厄贝沙坦组与苁归益肾胶囊各剂量组胶原纤维增殖状况有不同程度的改善(图2)。

A:空白组;B:模型组;C:厄贝沙坦组;D:苁归益肾胶囊高剂量组;E:苁归益肾胶囊中剂量组;F:苁归益肾胶囊低剂量组
2.6 各组大鼠TGF-β1、MEK/ERK通路相关蛋白表达比较 模型组及各药物干预组TGF-β1表达量及p-MEK/MEK、p-ERK/ERK比值比空白组高(P<0.05),与模型组比较,厄贝沙坦组及苁归益肾胶囊高、中剂量组TGF-β1表达量及p-MEK/MEK、p-ERK/ERK比值降低(P<0.05),苁归益肾胶囊低剂量组TGF-β1表达量及p-MEK/MEK、p-ERK/ERK比值降低(P>0.05)。见表4(图3)。

表4 各组大鼠 TGF-β1、MEK/ERK通路相关蛋白表达比较
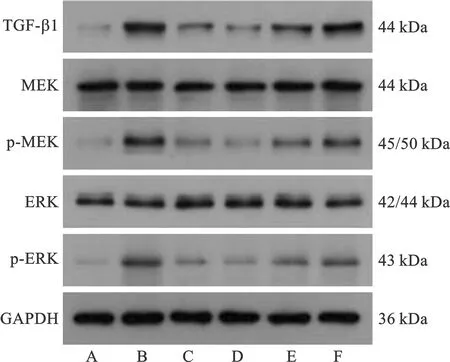
A:空白组;B:模型组;C:厄贝沙坦组;D:苁归益肾胶囊高剂
3 讨 论
DKD虽然在古籍中并无记载,但根据其症状及临床表现,其应属“下消”“关格”“水肿”等范畴。DKD由糖尿病发展而来,早期以阴虚为主,阴虚阳亢,耗气伤津,日久阴损及阳,阴阳俱虚,病至后期以肾脏虚损为主,久病入络,血脉瘀阻,故瘀血贯穿DKD的整个病程,因此治疗上以补肾化瘀通络为基本治则。本实验研究药物苁归益肾胶囊由肉苁蓉、当归、山茱萸、泽泻、桂枝和牡丹皮构成。方中肉苁蓉味甘、咸,入肾经,甘能除热补中,咸能滋肾,既可补肾阳、肾精之不足,又可制约燥热太过。山茱萸味酸、涩,能收能敛,入肝、肾两经,故能补益肝肾,肾虚失于固涩,则精微物质从小便漏出,蛋白质属人体精微物质,故肉苁蓉和山茱萸合用,补肾之不足,涩精止遗。当归补血活血,桂枝助阳化气,血为气之母,气为血之帅,二者合用则新血生,瘀血祛,血运通畅。泽泻性寒,功能利水湿,泄湿热,化浊脂。丹皮性微寒,能清热凉血、活血化瘀,二者合用可制约药物之温热,使全方温而不燥,补而不滞。诸药合用补肾益精,活血化瘀,与DKD的病机相契合。本研究发现苁归益肾胶囊可降低血糖,消减蛋白尿,改善肾功能,与团队前期研究结果一致[7]。
肾纤维化的程度是反映肾脏疾病预后的重要因素之一[11]。因此,早期干预、抑制致纤维因子的表达,对延缓DKD进展的意义深远。TGF-β是最重要的调节因子之一,与多种原因引起的肾损伤高度相关[12]。TGF-β1是TGF-β家族中推动肾脏纤维化最重要的亚型[13],可通过多种机制诱导肾脏纤维化。TGF-β1可诱导多种胶原、蛋白多糖等物质的合成,使细胞外基质(ECM)与细胞粘连增加,影响ECM代谢过程,增加堆积,抑制降解,ECM过度堆积可加速DKD的进展[14]。TGF-β1还可以通过促进上皮细胞-间充质转化影响肾脏纤维化[15]。间质纤维化(RIF)是DKD进展为ESRD的必经之路[16]。研究发现,熊果酸具有下调 TGF-β1表达,抑制炎症状态下系膜细胞增殖的作用,是肾复康Ⅱ号胶囊治疗RIF的核心成分之一[17]。
TGF-β1介导肾脏纤维化主要通过两条通路, Smads通路与MEK/ERK信号通路[18-19]。MEK/ERK信号通路参与细胞增殖、凋亡等生理过程[20],多项研究证实,MEK/ERK信号通路在DKD的发病过程中起重要作用,在肾脏纤维化过程中处于活化状态。本实验结果发现肾纤维化大鼠肾组织中TGF-β1蛋白水平及p-MEK/MEK、p-ERK/ERK比值明显升高,即TGF-β1介导的MEK/ERK信号通路被激活,苁归益肾胶囊可下调TGF-β1水平和MEK/ERK信号通路来发挥其对肾纤维化的干预作用。
综上所述,苁归益肾胶囊对DKD大鼠肾脏纤维化程度和肾脏功能具有较好的干预作用,其机制可能是通过抑制TGF-β1介导的MEK/ERK信号通路实现的,该结果可以为苁归益肾胶囊在防治糖尿病肾病及延缓肾纤维化方面的深入开发利用提供新的证据支持。

