清解化攻汤对急性胰腺炎大鼠肠黏膜屏障和血清炎症因子的影响
刘锟荣,卢 洁,秦百君,安晓霞,,李 慧,唐曦平,陈国忠
(1.广西中医药大学研究生院,广西 南宁 530001;2.广西中医药大学第一附属医院,广西 南宁 530023;3.广西中医药防治医学分子生物重点实验室,广西 南宁 530023;4.广西医科大学附属肿瘤医院,广西 南宁 530021)
急性胰腺炎(Acute pancreatitis,AP)是一种较为多见的消化系统危重疾病,相关数据显示其发病率逐年升高[1]。约20%的AP患者为中度重症及重症,常并发有器官衰竭或胰腺和胰周组织坏死,病死率高,已成为严重危及国民生命和健康的重大疾病之一[2]。最近的研究发现,肠黏膜屏障功能和完整性在AP的发病和进展过程中有着重要的作用,肠黏膜屏障损伤后导致肠黏膜通透性增加可进一步引发肠道细菌的移位,并进一步诱发胰腺感染坏死以及多器官功能障碍综合征(Multiple organ dysfunction syndrome,MODS),迫使AP向重症进展,而在AP中过度释放的炎症因子又是引起肠黏膜屏障损伤的重要因素[3-4]。因此,控制炎症因子的过度释放以及保护肠黏膜屏障在AP的治疗中显得尤为重要。
越来越多的研究发现中医药在AP的治疗中可发挥良好的作用,且国内指南也把中药对AP的治疗方法作为强推荐[1],中医药在AP中的疗效作用越来越受到重视。对于AP发病初期,广西名中医陈国忠教授结合广西所处岭南地带的气候特点,对临床AP患者的发病规律进行了总结,认为该病发病以“湿”“热”“毒”“瘀”为主要病机,邪气阻滞导致腑气不通,因此陈教授在此基础上创立的经验方清解化攻汤,在临床上对治疗AP有明确的疗效[5-7],然而其干预作用仍需进一步实验研究予以验证。本研究拟在AP动物模型上就清解化攻汤对模型动物肠黏膜屏障及血清炎症因子的干预作用予以进一步验证,拟为中医药治疗AP提供研究依据。
1 材料与方法
1.1 实验动物 24只清洁级雄性SD大鼠,鼠龄8周,体重为(200±20)g,购自湖南省长沙市天勤生物技术有限公司[许可证号SCXK(湘)2019-0014],在广西中医药大学第一附属医院医学分子生物学实验室饲养[许可证号SYXK(桂)2019-0001],饲养温度为(22±2)℃,光照与黑暗每12 h交替进行,动物自由饮水和摄食并分笼喂养,经过1周适应喂养后开始实验。
1.2 药品及主要试剂 清解化攻汤(由柴胡、黄芩、大黄、枳实、厚朴等药物组成,专利号:ZL201811021893.2,由广西中医药大学第一附属医院制剂室制作),用药前先将药液浓缩成3.6 g/ml。注射用乌司他丁(国药准字H19990134),雨蛙素(17650-98-5,上海源叶生物科技有限公司),脂多糖(L2880,美国Sigma),血清淀粉酶检测试剂盒购自南京建成生物工程研究所。大鼠的肿瘤坏死因子-α(TNF-α)、白细胞介素-1β(IL-1β)、白细胞介素-10(IL-10) 及D-乳酸、内毒素酶联免疫分析(ELISA)试剂盒为贝茵莱生物科技公司生产。Occludin抗体为博奥森生物生物技术有限公司生产。
1.3 动物造模、分组及干预 采用腹腔注射雨蛙素及脂多糖进行大鼠AP 造模,雨蛙素每次按50 μg/kg剂量注射, 1次/h,连续腹腔注射6次,最后1次注射后按10 mg/kg的剂量立即腹腔注射脂多糖。24只SD大鼠随机分成假造模组、模型组、西药组和中药组,每组各6只。模型组、西药组及中药组按上述方法造AP模型,而假造模组则每次同时予腹腔注射与雨蛙素等量的0.9%氯化钠溶液,1次/h,连续6次,最后1次注射后亦立即腹腔注射与脂多糖等量的0.9%氯化钠溶液。干预上,中药组予清解化攻汤灌胃,每次给药剂量为9 g/kg,分别于造模完成后立即给药以及每隔6 h给药1次,共给药3次;西药组予乌司他丁尾静脉注射,每次给药剂量为7.5×103U/kg,分别于造模完成后立即给药以及每隔6 h给药1次,共给药3次;模型组及假造模组用等量的0.9%氯化钠溶液灌胃,灌胃时间和频次同中药组。
1.4 标本采集 造模完成后13 h(即最后1次给药1 h后),以3 ml/kg剂量腹腔注射10%的水合氯醛,待成功麻醉后,开腹并经腹主动脉采血,静置2 h后以4 ℃的温度按3000 r/min的速度离心10 min后取上清,放在-80 ℃超低温冰箱冻存备用。取回肠靠近回盲部末段10 cm处的回肠组织,一部分回肠组织立即予4%多聚甲醛固定,余回肠组织经0.9%氯化钠溶液冲洗后迅速放于无菌冻存管中,冻存于-80 ℃超低温冰箱备用。
1.5 回肠组织病理学观察 固定胰腺和回肠组织后,予石蜡包埋,经过切片和苏木素伊红(HE)染色后,通过电子光镜查看组织切片的病理改变。
1.6 血清淀粉酶水平检测及ELISA法检测血清相关指标 血清淀粉酶的检测严格按照淀粉酶检测试剂盒所述操作要求逐步进行检测。另外,血清TNF-α、IL-1β、IL-10、D-乳酸及内毒素水平的检测严格按照所对应的ELISA试剂盒中说明书所述的操作方法和步骤进行检测。
1.7 回肠Occludin蛋白表达量检测 采用Western blot法对回肠组织中Occludin蛋白表达水平进行检测,从-80 ℃超低温冰箱将回肠组织取出,剪碎、匀浆并离心后取上清液得到总蛋白,采用SDS-PAGE电泳使不同的蛋白分离,转膜后封闭,孵育Occludin抗体予4 ℃过夜,漂洗3次后予二抗室温孵育1 h,漂洗3次后加入ECL试剂发光,在成像仪中曝光并拍照,Image J软件分析记录灰度值并予以进一步分析。
1.8 统计学方法 采用SPSS 21.0统计学软件进行分析。计量资料以均数±标准差表示,当数据呈正态分布并且方差齐时,多组间比较采用单因素方差分析,组间两两比较采用LSD法;当数据呈非正态分布或方差不齐时,采用非参数秩和检验;P<0.05表示差异具有统计学意义。
2 结 果
2.1 大鼠的一般状态观察 造模完成后13 h,假造模组大鼠无明显异常表现,与假造模组比较,模型组大鼠精神状态明显变差,部分大鼠出现紧张、烦躁和易激惹,呼吸偏快、弓背屈腹;西药组和中药组大鼠精神状态稍差,部分略见紧张,偶见烦躁和易激惹,部分呼吸稍增快,偶见弓背屈腹。
2.2 大鼠回肠黏膜病理改变 见图1。镜下观察可发现,假造模组回肠黏膜绒毛完整,上皮下间隙未见明显增宽,轻度与固有层分离,炎性细胞浸润不明显,偶可见固有层轻度充血。模型组回肠黏膜绒毛略不规整或破损,肠上皮下间隙稍见增宽,与固有层分离增大,局部炎性细胞浸润增多,内皮下及固有层充血及出血明显增多。西药组和中药组黏膜破损程度相对模型组轻,肠上皮下间隙增宽不明显,与固有层稍有分离,较模型组减轻,局部炎性细胞浸润比模型组减轻,两组可见内皮下及固有层散在充血与模型组相似,但未见明显出血,西药组和中药组比模型组病理改变明显减轻。
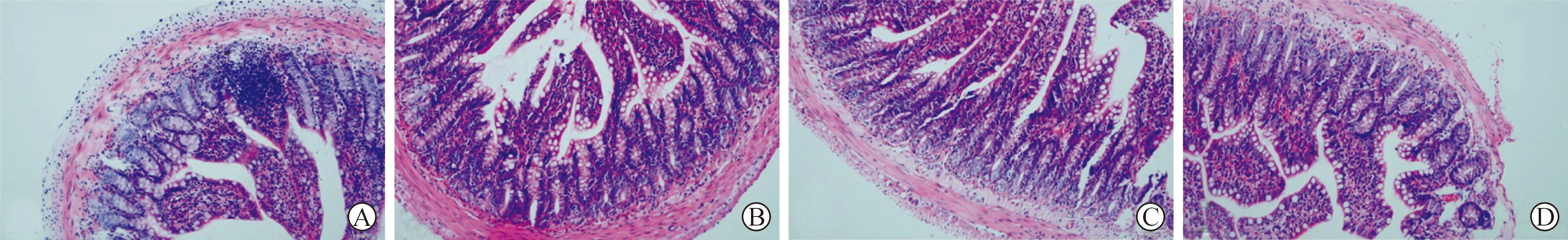
A:假造模组;B:模型组;C:西药组;D:中药组
2.3 各组大鼠血清淀粉酶及炎症因子水平比较 见表1。与假造模组比较,模型组大鼠血淀粉酶水平明显升高(P<0.01);与模型组比较,西药组及中药组均下降明显(P<0.01);与西药组比较,中药组略有下降,差异无统计学意义(P>0.05)。与假造模组比较,模型组血清TNF-α水平明显升高(P<0.01);与模型组比较,西药组及中药组均明显下降(P<0.01);且对比西药组,中药组降幅更大(P<0.05)。与假造模组比较,模型组大鼠的血清IL-1β水平明显上升(P<0.01);与模型组比较,西药组及中药组均明显下降(P<0.01);与西药组比较,中药组略有下降,但差异无统计学意义(P>0.05)。与假造模组比较,模型组血清IL-10水平明显升高(P<0.01);与模型组比较,西药组及中药组均有所升高(P<0.01);与西药组比较,中药组增高更明显,但差异无统计学意义(P>0.05)。

表1 各组大鼠血清淀粉酶、TNF-α、IL-1β及IL-10水平比较
2.4 各组大鼠血清D-乳酸及内毒素水平比较 见表2。与假造模组比较,模型组大鼠血清D-乳酸水平显著提升(P<0.01);与模型组比较,西药组及中药组均明显下降(P<0.01);中药组较西药组降幅更明显(P<0.05)。与假造模组比较,模型组大鼠血清内毒素水平显著提升(P<0.01);与模型组比较,西药组及中药组均明显下降(P<0.01);中药组较西药组降幅更大,差异有统计学意义(P<0.05)。

表2 各组大鼠血清D-乳酸及内毒素水平比较(ng/ml)
2.5 各组大鼠回肠Occludin蛋白相对表达量比较 见表3(图2)。与假造模组比较,模型组大鼠回肠黏膜组织Occludin的相对表达量明显下降(P<0.01);与模型组比较,西药组及中药组均明显增高(P<0.01);中药组较西药组增幅更大,但差异无统计学意义(P>0.05)。

表3 各组大鼠回肠Occludin蛋白相对表达量比较
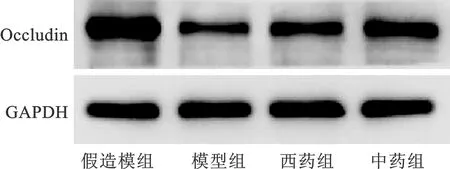
图2 各组大鼠回肠Occludin蛋白条带图
3 讨 论
至今为止AP的病死率仍偏高,且国内发病率逐年增加,然而其发病机制目前仍未完全清楚。经研究发现,AP的死亡与持续的全身炎症反应综合征(SIRS)密切相关,而MODS、胰腺或胰周继发性感染是引起该病死亡的关键因素[8-9]。肠黏膜屏障损伤是AP的主要并发症之一,是导致肠道细菌移位并进一步诱发胰腺组织感染、坏死和MODS以及因此使AP向重症发展甚至导致死亡的重要因素[10]。而肠黏膜屏障损伤与炎症因子的大量释放关系密切[3-4],且后者可引发“瀑布样级联反应”亦是引起SIRS和MODS发生以及使AP病情进展的重要原因[11-12]。由此可知,对肠黏膜屏障的保护以及对炎症因子过度释放的调控,在预防AP往重症发展并降低其病死率中起着非常重要的作用。乌司他丁属于胰蛋白酶抑制剂,为治疗AP的常用药物,临床应用可改善患者的临床结局[13-15],可抑制TNF-α、IL-6等炎症因子释放,减轻炎症反应并可改善患者肠黏膜屏障功能,减少肠内细菌和内毒素移位的发生[16-17]。
AP主要归属于中医的“腹痛”“脾心痛”“胃心痛”“胰瘅”范畴,广西名中医陈国忠教授结合AP的发病规律以及广西所处岭南地带多湿多热的气候环境特点,将AP发病主要归结于“湿”“热”“毒”“瘀”四大关键病机,由于湿热毒瘀郁滞中焦,导致气机阻滞、腑气不通,而且气机阻滞、腑气不通为贯穿AP早期的基本病机。因此陈教授认为,对AP发病早期予清解化攻汤治疗,以清热解毒化湿、活血化瘀攻下为主要功效,准确靶向上述关键病机和腑气不通的基本病机。该方组方包括柴胡、黄芩、大黄、枳实、厚朴等药物,在临床治疗上可有效缓解AP症状、保护肠黏膜屏障以及降低血清TNF-α等炎症因子水平[5-7]。因此,本研究拟通过在AP大鼠上的实验研究对该方的干预作用加以验证。
在健康人的肠道中,在肠黏膜屏障和各种结构的作用下,肠腔内的细菌及其产物难以进入血液循环[18],肠黏膜屏障是抵御肠道内细菌入侵的重要屏障。AP发生发展中多种因素作用导致肠黏膜屏障损伤,此时Occludin等肠黏膜上的紧密连接蛋白表达减少,肠道通透性增加,大量细菌及内毒素、D-乳酸等毒素产物可通过肠屏障进入血液循环[19-21],进而加重SIRS、引发感染及促使MODS的发生[22],是促使AP往重症发展的重要环节[23]。而维持人体正常的肠道黏膜结构及功能的完整性,可有效避免肠道细菌移位,从而减少继发感染的发生[24]。本研究结果表明,清解化攻汤可减轻AP大鼠回肠黏膜的病理损伤,降低大鼠血清内毒素及D-乳酸水平,并可增加其回肠黏膜上紧密连接蛋白Occludin的表达,提示清解化攻汤对AP大鼠肠黏膜屏障损伤有较好的保护作用。
在炎症因子方面,AP发病早期的无菌性化学性炎症可激活多种炎症通路,进一步促进炎症因子、趋化因子、血小板激活因子和黏附分子的表达,TNF-α、IL-1β等多种炎症因子的大量释放,可进一步促使中性粒细胞、巨噬细胞等炎症细胞激活并向胰腺及局部浸润,加剧了腺体损伤和局部炎症反应。TNF-α及IL-1β作为促炎细胞因子,是AP发展中最密切相关的炎性细胞因子,可启动对胰腺腺泡细胞损伤的炎症反应,也是介导更多炎性细胞因子从胰腺组织或其他组织释放的初始因子,可进一步诱导IL-6等炎症因子的产生和释放,使局部炎症向全身炎症反应发展。因此,TNF-α及IL-1β等炎症因子与重症AP及其并发的SIRS和MODS关系密切[25]。而抗炎细胞因子IL-10是一种负反馈调节细胞因子,可由巨噬细胞和树突状细胞分泌并反过来抑制这些细胞的活化,该细胞因子水平的上调,抑制TNF-α、IL-6、IL-1和IL-12等巨噬细胞分泌的炎症因子的表达,还可通过抑制巨噬细胞和树突状细胞上共刺激物和主要组织相容性复合体Ⅱ的表达来抑制T细胞活化[26-27]。在AP发病早期,快速产生大量的炎症因子,其中以TNF-α、IL-1β等促炎细胞因子的大量释放为主,引起与IL-10等抑炎细胞因子的不平衡,最终导致炎症因子的瀑布级联样释放、炎症反应的进一步加重以及由局部扩大向全身,诱发及加重SIRS甚至MODS的发生。因此,减轻炎症反应的关键还在于对炎症因子的调控。本研究发现清解化攻汤可降低AP大鼠血清促炎细胞因子TNF-α、IL-1β的水平,提高血清抑炎细胞因子IL-10的水平,提示清解化攻汤对AP大鼠血清炎症因子有明显的调控作用。
综上所述,本研究表明清解化攻汤对AP大鼠的肠黏膜屏障有一定的保护作用,而且该方可降低血清促炎细胞因子水平,提高抑炎细胞因子水平,对AP大鼠血清炎症因子有明显的调控作用,可为后续进一步对中医药治疗AP的研究提供依据。

