国井绵雅酱香不同轮次堆积发酵的真菌群落多样性研究
许 玲,于文娟,董乔娟,于盼盼,姜明慧,白秀彬,赵纪文
(山东扳倒井股份有限公司,山东高青 256300)
中国白酒酿造产区生态环境各异,微生态各不相同,进而导致白酒品种繁多、香型各异[1]。酱香型白酒作为中国白酒的传统典型酒种之一,具有高温制曲、高温堆积、高温发酵、高温馏酒、长期贮存的“四高一长”工艺特点[2]。独特的酿造工艺对质量风格有着至关重要的影响,微生物区系的形成及其生态功能的发挥又是关键所在。堆积发酵是酱香型白酒独有的生产工艺,该过程的主要作用是网罗堆积场地和空气中的微生物,生成多种酶类,在多种酶类的相互作用下合成酒体的前驱物质及香味物质[3-5]。
酵母菌和霉菌在酱香白酒酿造过程中发挥着巨大作用[2],酵母是产乙醇和重要风味物质的关键微生物,霉菌能够分泌多种酶类,对酿造原料降解和中国白酒风味的形成有重要贡献[6]。
本研究应用Illumina Miseq 高通量测序技术,以酱香型白酒各轮次堆积酒醅为研究对象,针对不同轮次堆积酒醅的真菌菌群结构及多样性进行对比研究,分析酱香型白酒酒醅堆积过程中真菌变化,探究各轮次高温堆积阶段的主要优势菌群动态变化规律,为优化利用酿酒微生物资源和生产质量控制提供理论基础。
1 材料与方法
1.1 材料、仪器
酒醅:取自山东扳倒井股份有限公司白酒酿造车间酱香型白酒堆积酒醅。
仪器设备:Illumina Miseq 2×300 bp 高通量测序平台,生工生物工程上海股份有限公司。
1.2 试验方法
1.2.1 取样方法
样品采自山东扳倒井股份有限公司7 个不同轮次酱香堆积发酵后的酒醅,每堆酒醅采样按照升温情况,在中轴断面分为五个层次,每个层次分别取样,取样时在每个温度层的所有位置均匀取样,最后将五个层次的样品混合,四分法取样,即可代表本轮次堆积酒醅。每轮次样品采集完后及时将样品转移至-80 ℃冰箱密封保存。
1.2.2 高通量测序分析方法
生工生物工程上海股份有限公司利用Illumina Miseq 2×300 bp 高通量测序平台测序。将检测后合格的基因组DNA稀释作为模板。
真菌扩增区域为ITS1—ITS2;细菌PCR 扩增采用16S V3—V4 可变区的引物,古菌扩增V3—V4区,采用的是巢式PCR。扩增序列通过Illumina Miseq 2×300 bp 高通量测序平台进行测序,下机数据经过cutadapt(去除接头)、PEAR(序列对拼)、Prinseq (质量剪切),去除得分低于20 分、碱基模糊、引物错配或测序长度小于150 bp的序列。
经过上述步骤,将标签分组具有97 %序列相似性的高质量OTU 序列,真菌得到的OTU 代表序列比对RDP 数据库和UNITE 数据库;细菌和古菌得到的每个OTU 代表序列比对RDP 数据库、silva数据库和NCBI 16S 数据库。最后通过人工进行检查以获得物种信息。
2 结果与分析
2.1 真菌菌群结构多样性分析
2.1.1 基于可操作分类单元聚类分析
利用MiSeq 平台的扩增子测序技术分析扳倒井酱香型白酒各轮次堆积酒醅真菌菌群结构多样性及演替规律。应用稀释曲线测序数据量可表征样本中物种的丰富度、均一性或多样性,并说明样本的测序数据量是否合理[7];Shannon 指数曲线可反映样本微生物多样性[8]。图1 表明,本研究每个样本的序列数均超过了22000,样本的稀释曲线与Shannon 指数曲线均趋于平坦,说明测序数据量足够大,可以反映样本中绝大多数微生物的多样性信息。
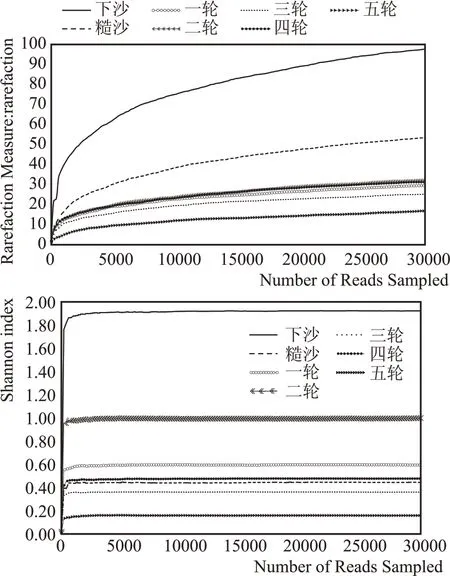
图1 样品真菌的稀释曲线和Shannon指数曲线
2.1.2 α-多样性分析
α-多样性分析可揭示堆积酒醅中微生物群落的丰富度和多样性。计算Shannon 指数、Simpson指数、ACE 指数、Chao 指数和覆盖率,以描述样本中真菌菌群的多样性[9]。
由表1 可知,不同轮次的堆积酒醅在97%水平下共得到真菌OTU 数为381,下沙轮次样本中的OTU 数最高为147,五轮次为21,是全年样本中OTU 数最低的。Shannon 指数、Simpson 指数、Chao指数和ACE 指数表明,下沙轮次堆积酒醅的真菌多样性和丰富度明显高于其他轮次,说明下沙轮次的堆积环境有利于真菌的繁殖;五轮次堆积酒醅的真菌多样性和丰富度低于其他轮次,可见随着一轮轮发酵酒醅环境越来越不适合真菌的繁殖。各个样本的覆盖率都在0.9990 以上,说明各样品文库的覆盖率足够大,绝大部分的微生物都被检测到,测序结果充分体现了国井绵雅酱香白酒堆积酒醅真菌群落多样性的真实情况。

表1 样本真菌群落多样性指数
2.2 堆积酒醅真菌群落组成分析
基于Illumina MiSeq 测序数据对国井酱香型白酒各轮次堆积酒醅中真菌的ITS1-ITS2 区序列进行分析,研究各轮次堆积酒醅真菌物种和群落结构,图2 为各轮次堆积酒醅样本在门水平上的真菌群落结构组成。

图2 不同轮次堆积酒醅真菌群落结构(门水平)
从图2 可知,堆积酒醅采集的样品中共检出4个门类。Ascomycota(子囊菌门)为第一优势菌门,各轮次占菌群相对丰度的90 %以上,在五轮次时达到最大值,占菌群相对丰度的99.99%。Basidiomycota(担子菌门)为第二优势菌门,几乎只存在于下沙阶段,说明这些Basidiomycota(担子菌门)可能主要来自于该轮次用的大曲、原辅料或者当时环境中。以上结果与已报道的酱香型白酒堆积酒醅及大曲微生物在门类结构上的研究具有相似性,孙利林[10]对酱香型白酒第四轮次酒酿造堆积酒醅研究时,发现最主要的是Ascomycota(子囊菌门);李申奥[11]对兼香型白酒高温大曲微生物研究时,发现Ascomycota(子囊菌门)为优势菌门;Hu[12]研究白云边酒高温大曲微生物发现,真菌主要为Ascomycota(子囊菌门)、Unclassfied Fungi,其中Ascomycota(子囊菌门)为优势菌门。
从图3 可知,扳倒井酱香型白酒堆积酒醅样品中共检出25 个真菌菌属。其中Issatchenkia(伊萨酵母属)、Thermomyces(嗜热真菌属)、Aspergillus(曲霉属)和Pichia(毕赤酵母属)各轮次都可检出且为优势菌属。Issatchenkia(伊萨酵母属)在各轮次中均占50 %以上,五轮次占比高达96 %;Dipodascus(双足囊菌属)仅在下沙和糙沙轮次检出,占比分别为19.59 %和0.13 %;Thermomyces(嗜热真菌属)在一轮次和二轮次占比较大,分别为12.88%和17.56 %;Pichia(毕赤酵母属)在二轮次占比较大,为19.03%;Zygosaccharomyces(接合酵母属)仅存在于四轮次,占比为2.38%。

图3 不同轮次堆积酒醅真菌群落结构(属水平)
Issatchenkia(伊萨酵母属)产乙酸乙酯能力强,具有耐高温、耐酒精度等特性;Thermomyces(嗜热真菌属)大多能产生具有高活力和热稳定性的纤维素酶、蛋白酶等,对降解高分子多糖和蛋白质具有促进作用,有利于酿酒原料被微生物利用,起到促进微生物生长繁殖以及产酒生香的作用;曲霉属(Aspergillus)可利用酱香型白酒偏酸性的酿造环境分泌酸性水解酶类,如酸性淀粉酶、酸性蛋白酶等,分解原料中的淀粉与蛋白质,为发酵提供持续性的动力[13];蔡雪梅等[14]的研究发现一株Pichia kudriavzevii(库德里阿兹氏毕赤酵母)可以产生多达64 种挥发性风味化合物,可作为白酒生香酵母。
3 结论
本研究使用高通量测序技术对堆积酒醅样品中的微生物进行了分析研究。结果表明,各轮次堆积酒醅共检出4 个真菌门类,Ascomycota(子囊菌门)为第一优势菌门;共检出25 个真菌菌属,Issatchenkia(伊萨酵母属)、Thermomyces(嗜热真菌属)、Aspergillus(曲霉属)和Pichia(毕赤酵母属)在各轮次都可检出且为优势菌属。对比各轮次的检测结果,下沙轮次堆积酒醅的真菌多样性和丰富度最好,五轮次堆积酒醅的真菌多样性和丰富度最差。

